-新しい薬剤の開発や治療計画の最適化に役立つ数理モデルを開発-
2018-02-02 国立研究開発法人日本原子力研究開発機構,国立大学法人京都大学原子炉実験所,国立大学法人筑波大学,一般財団法人電力中央研究所
【発表のポイント】
- ホウ素薬剤によるがん細胞殺傷効果の違いをマウス実験で定量的に評価
- 効果の違いが薬剤濃度の細胞内及び細胞間不均一性に起因することを解明
- 薬剤濃度の不均一性からがん細胞殺傷効果を予測する数理モデルを開発
- 開発した数理モデルは、BNCTのみならず放射線治療全般の最適化に有望
国立研究開発法人日本原子力研究開発機構(理事長 児玉敏雄、以下「原子力機構」という。)原子力基礎工学研究センター放射線挙動解析研究グループの佐藤達彦研究主幹、国立大学法人京都大学原子炉実験所の増永慎一郎教授、国立大学法人筑波大学医学医療系の熊田博明准教授、一般財団法人電力中央研究所原子力技術研究所の浜田信行主任研究員による研究グループは、ホウ素中性子捕捉療法の薬剤によるがん細胞殺傷効果の違いを理論的に予測する新たな数理モデルを開発しました。
ホウ素中性子捕捉療法(BNCT)は、同じ放射線量でも投与する薬剤の種類や濃度によってがん細胞殺傷能力(治療効果)が異なりますが、その詳細な依存性やメカニズムはまだ解明されていませんでした。そこで本研究では、2種類のホウ素薬剤を様々な濃度で投与した担がんマウスに中性子を照射し、その治療効果を定量的に調べました。また、原子力機構が中心となって開発した放射線挙動解析コードを用いた細胞レベルの放射線量解析により、動物実験で示唆された薬剤による治療効果の違いが、薬剤が細胞内及び細胞間で不均一に分布する効果に起因することを明らかにしました。この解析結果に基づき、薬剤濃度の不均一性を指標として治療効果を予測する新たな数理モデルを開発し、動物実験結果を精度よく再現することに成功しました。
開発した数理モデルを応用すれば、新しいホウ素薬剤の治療効果の予測や、患者個人の症状に合わせたより最適な放射線治療計画の提案が可能となります。また、α線源内用療法など、他の放射線治療法への応用も期待されています。本成果は、2018年1月17日に英国科学誌『Scientific Reports』に掲載*されました。
*DOI:10.1038/s41598-017-18871-0
【研究の背景】
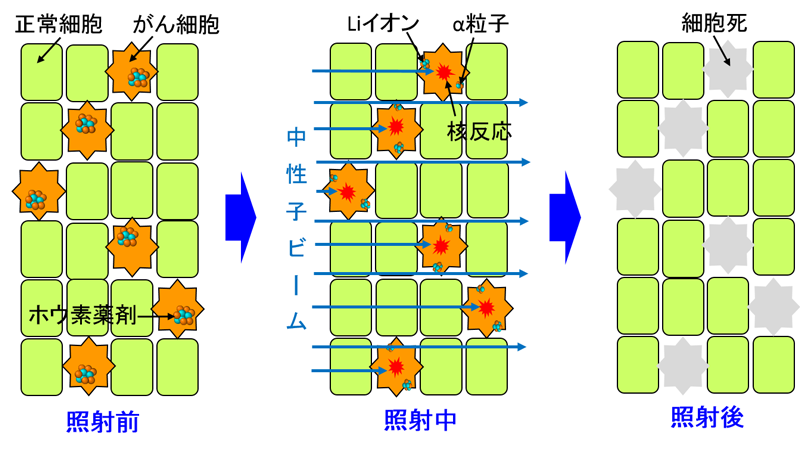
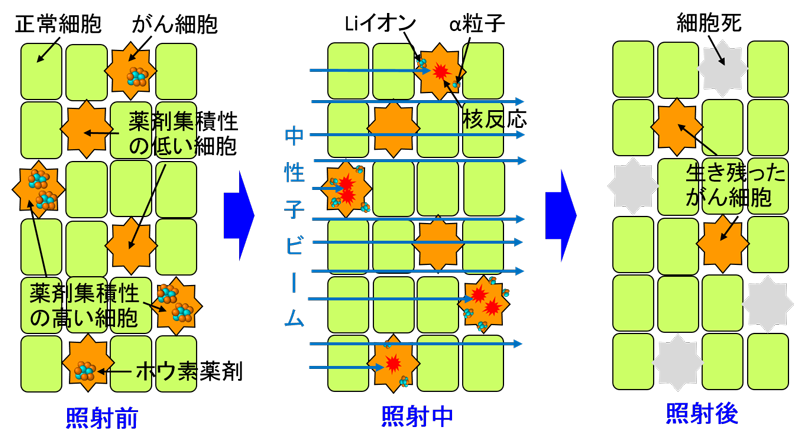
ホウ素中性子捕捉療法(Boron Neutron Capture Therapy、 以下「BNCT」という。)は、あらかじめホウ素薬剤を投与したがん患者に中性子ビームを照射し、ホウ素と中性子の核反応1)で生じるα粒子やLiイオンを用いてがん細胞を殺傷する治療方法です。体内でα粒子やLiイオンが飛べる距離は細胞1個分程度(~10μm)のため、がん細胞に薬剤を集中して取り込ませれば、正常細胞にあまり損傷を与えずにがん細胞のみ選択的に破壊することができます(図1参照)。したがって、がん細胞と正常細胞が混在している悪性度の高い脳腫瘍などに特に効果的です。BNCTの臨床研究は、従来は原子力機構*や京都大学原子炉実験所など原子炉を保有する限られた施設でしか行うことができませんでしたが、近年、加速器中性子源を用いた専用施設の建設が相次いでおり、今後は全国各地の大学や病院で実施される予定です。
* 従来は研究用原子炉JRR-4で臨床研究を実施していましたが、現在は廃炉措置中
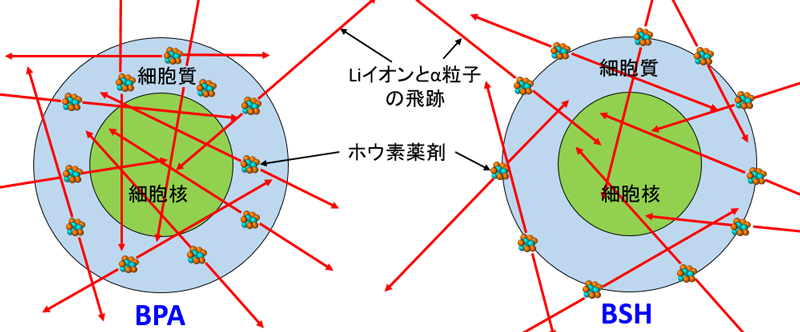
放射線による細胞殺傷効果は、細胞核に放射線がエネルギーを与えることによって引き起こされると考えられています。したがって、がん細胞、特にその細胞核内やその周辺に選択的に取り込まれるホウ素薬剤の開発を実現できれば、その治療効果は高くなると考えられます。BNCTの臨床研究で主に用いられる2つのホウ素薬剤(BPAとBSH)2)は、それぞれ細胞質及び細胞膜に集積する性質を持っており、この2つの薬剤が同じ濃度でがん細胞に集積された場合、細胞質の方が細胞膜と比べて細胞核に近いため、BPAの方がより高い治療効果が得られることが知られています(図2参照)。この薬剤による治療効果の違いは、X線による治療効果との比(Compound Biological Effectiveness、「CBE」3)、以下「薬剤治療効果比」という。)で表され、BNCTの治療計画を立案する上で極めて重要な指標となります。しかし、その値は限られた動物実験結果などから経験的に決定されており、理論的な解釈はされていませんでした。また、薬剤効果比は放射線量や薬剤濃度にも依存して変化することが知られていましたが、その詳細な依存性やメカニズムはまだ解明されていませんでした。
【研究の手法】
このような背景から、私たちの研究グループでは、担がんマウスを用いた動物実験と細胞レベルでの線量解析に基づく数理モデルにより、薬剤治療効果比を理論的に予測する研究に取り組みました。以下、その手法の概要を解説します。
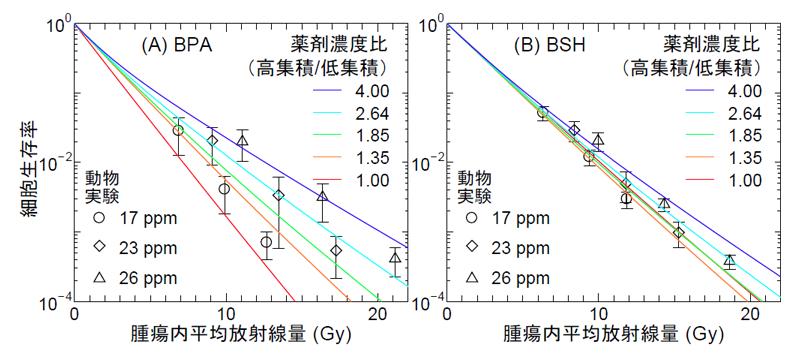
動物実験は、京都大学原子炉実験所の中性子ビームを用いて、京都大学動物実験委員会が定める規定に則して実施しました。まず、8~11週齢のマウスの足に扁平上皮がん細胞4)を接種し、14日間飼育して腫瘍の大きさが約1cmとなるようにしました。そして、それらマウスにホウ素薬剤BPA及びBSHをそれぞれ3種類の濃度で投与し、腫瘍部位のホウ素濃度が約17、23、及び26 ppmとなるようにしました。その後、それらマウスの腫瘍部位を原子炉からの中性子ビームで照射し(図3参照)、照射後、マウスからがん細胞を取り出してその生存率をコロニー形成法5)により測定することでその治療効果を推定しました。また、比較データとして、ホウ素薬剤を投与しないマウスに中性子及び光子ビームを照射した実験も行いました。なお、これらの実験結果は、既に2014年に論文として発表6)されていましたが、今回、開発した数理モデルによる解析のために放射線量のデータなどを再評価しました。
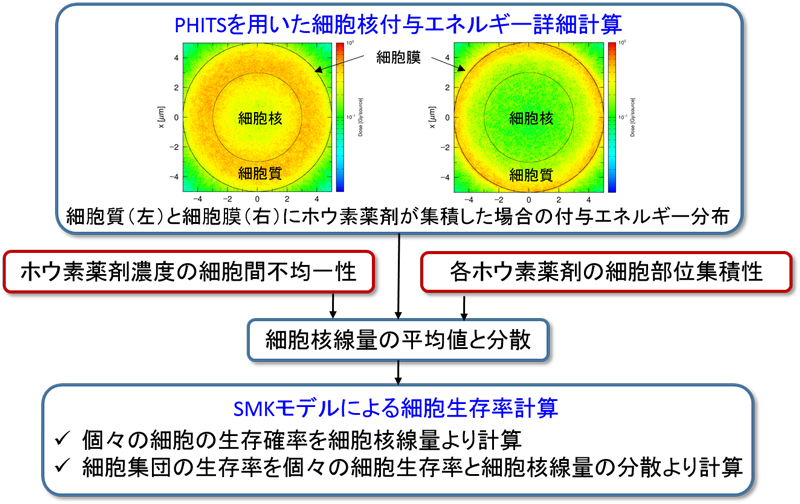
一方、数理モデルによる解析は、原子力機構が中心となって開発している粒子・重イオン輸送計算コード「PHITS」7)と、確率論的マイクロドジメトリ動態モデル(Stochastic Microdosimetric Kinetic Model、以下「SMKモデル」という。8))を組み合わせて実施しました。その解析の流れを図4に示します。まず、PHITSを用いて、ホウ素薬剤が細胞核、細胞質、細胞膜、及び細胞外に局在した場合の細胞核に与えるエネルギーをそれぞれ詳細に計算しました。そして、 各ホウ素薬剤の細胞部位の集積性を考慮し、腫瘍全体の平均放射線量ではなく、細胞生存率により直接的な関係にある細胞核内に限定した放射線量(以下、「細胞核線量」という。)の平均値と分散を評価しました。その際、薬剤ががん細胞間に均一に分布しない効果も考慮しました。そして、得られた細胞核線量の平均値と分散をSMKモデルの入力情報として、個々のがん細胞の生存確率及びそこから推定される細胞集団の生存率を計算しました。従来モデルと比較した本数理モデルの最大の特徴は、経験的に決められたパラメータを用いず、ホウ素薬剤濃度の細胞内及び細胞間不均一性から理論的に細胞生存率を計算できる点にあります。したがって、本数理モデルは、薬剤や放射線場の特性が変わっても普遍的に利用することができ、従来モデルでは困難であった様々な条件に対する包括的な解析が可能となります。
【得られた成果】
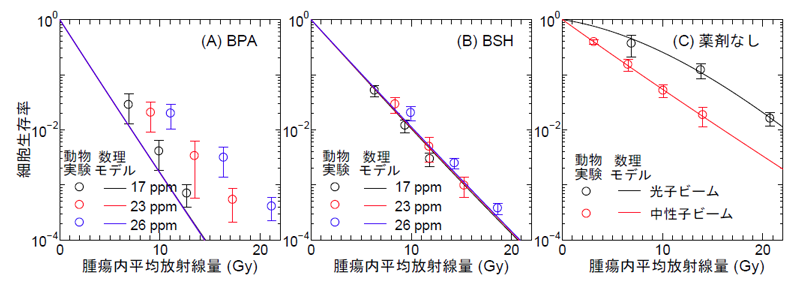
動物実験により得られた細胞生存率と開発した数理モデルによる解析結果の比較を図5に示します。図中の数理モデル解析結果は、個々の細胞に集積する薬剤濃度が均一と仮定して、細胞部位への集積性のみ考慮して導出した値です。図より、本数理モデルによる解析は、BSHを投与した場合(パネルB)及び薬剤を投与しない場合(パネルC)に対して動物実験結果を極めてよく再現できることが分かります。しかし、BPAを投与した場合(パネルA)は、特に高い放射線量及びホウ素薬剤濃度において、動物実験結果の方が本数理モデルで予想された値よりも細胞生存率が高くなってしまうことが分かりました。これは、臨床研究結果や細胞内での薬剤集積性から予想されるBPAの高い治療効果が今回の動物実験では顕著にみられなかったことを意味します。その理由として、私たちは、投与した薬剤が細胞間で不均一に分布し、一部の細胞が打ち漏らし効果(図6参照)により生き残ってしまったのではないかと考えました。
図6 薬剤濃度の細胞間不均一性に起因する打ち漏らし効果の概念図
(図1の場合と比べてホウ素薬剤の全体の個数は同じだが、一部の細胞に集中して取り込まれているため、打ち漏らしが生じてがん細胞が生き残ってしまいます)
そこで私たちは、がん細胞が薬剤低集積タイプと高集積タイプに分類できると仮定し、両者の薬剤濃度の比を変化させて細胞生存率を計算しました。その結果を図7に示します。図より、細胞生存率は薬剤濃度比が大きくなるほど高くなることが分かり、薬剤濃度が高い場合の動物実験結果と一致する傾向にあることが分かります。この傾向は、各細胞が取り込める薬剤の限度量は細胞周期に依存して分布を持つという生理学的な知見とも一致します。また、この解析から、細胞間の薬剤濃度不均一性に対する依存性がBPAと比べてBSHの方が低い理由は、細胞に集積せずに細胞外領域に漂っているホウ素薬剤の割合が大きいことに起因することが分かりました。
図7 がん細胞が薬剤低集積タイプと高集積タイプに分類できると仮定し、両者の薬剤濃度の比を変化させて細胞生存率を計算した結果。薬剤濃度比が大きくなる、すなわち細胞間での薬剤濃度の不均一性が大きくなると打ち漏らし効果が生じて細胞生存率が高くなります。
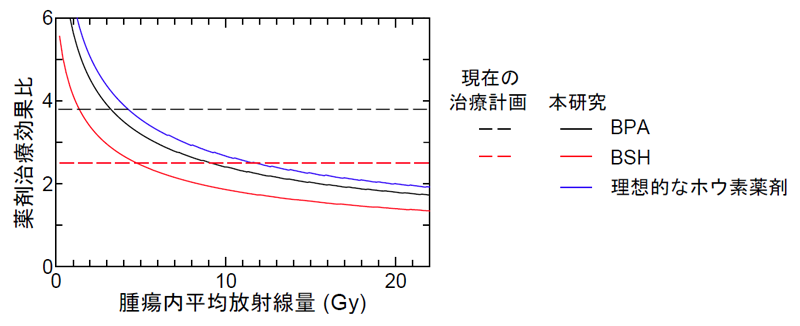
図8に、本研究で開発した数理モデルにより予想したBPAとBSHの薬剤治療効果比を示します。図より、薬剤治療効果比は腫瘍内における平均放射線量の増加と共に減少することが分かります。現在のBNCT治療計画では、薬剤治療効果比は放射線量に依存せずに一定(BPAは3.8、BSHは2.5)と仮定しているため、この結果は、現在の手法では低/高線量側での治療効果をそれぞれ過小/過大評価している可能性が高いことを示唆しています。また、図中の青線は、細胞核も含めて細胞全体に均一に分布する理想的なホウ素薬剤に対して推定した薬剤治療効果比を表しています。図より、そのような薬剤を開発できれば、BNCTの治療効果の更なる向上が期待できることが分かります。
【本研究の意義と今後の予定】
本研究により、①薬剤治療効果比を高めるためには、より細胞核近傍に集積性を持ち、細胞間に均一に分布するホウ素薬剤の開発が鍵となること、②治療計画を高度化するためには、薬剤治療効果比の放射線量依存性を考慮することが重要であること を定量的に明らかにしました。
本研究で開発した数理モデルは、これまで限られた動物実験結果などから経験的に決定されていたBNCTの薬剤治療効果比を理論的に予測可能とするため、今後の創薬研究や治療計画の最適化に役立てることができます。具体的には、開発した数理モデルを筑波大学が中心となって開発している治療計画システム「ツクバプラン(仮称)」に組み込んで、臨床研究などに応用していく予定です。そのためには、がん細胞のみならず正常細胞に対しても本研究と同様の解析を実施する必要があります。また、開発した数理モデルは、BNCTのみならず重粒子線治療やα線源を用いたRI内用療法9)など他の治療方法にも適用可能なため、複数の放射線治療方法を併用した場合の治療効果を理論的に推定することができます。この特長を活かし、将来的には、患者個人の症状に合わせて様々な放射線治療方法から最も治療効果の高い手法を見つけ出す最適治療法提案型の治療計画システムを開発し、その中核技術として本研究で開発した数理モデルを活用する予定です。なお、本研究成果は、科研費基盤研究(C)課題番号26461900により得られた成果を含みます。
【用語説明】
1) ホウ素と中性子の核反応
ホウ素の天然同位体の1つであるホウ素-10(10B)は、中性子の捕獲反応断面積が極めて高く、中性子吸収剤としてよく用いられます。また、捕獲反応により発生する2つの荷電粒子(α粒子とLiイオン)は、電離密度が高いためX線などと比べて高い細胞殺傷能力を有します。これら2つの特徴を活かし、中性子の増感剤としてホウ素薬剤を用いるのがBNCTの基本原理です。
2) ホウ素薬剤(BPAとBSH)
10Bを含み、がん細胞に選択的かつ多量に集積する特性を持つ化合物。ホウ素薬剤は、それ自身は薬効を持たずホウ素送達分子としてのみ機能する点が、通常の薬剤とは大きく異なる性質です。現在、BNCTの臨床研究で用いられているホウ素薬剤は、BPA(p-boronophenylalanine) 及びBSH(sodium borocaptate)と呼ばれる化合物のみです。それぞれ、濃縮10B-ホウ酸及び濃縮10B-水素化ホウ素化ナトリウムを出発原料として合成されます。できるだけ高濃度で10Bをがん細胞に集積することが望ましいため、10Bの濃縮度は98%以上が望ましいとされています。
3) Compound Biological Effectiveness、 「CBE」
同じ放射線量のX線治療と比較したBNCTの生物効果比。治療計画でX線等価線量を導出する際に利用されています。その値は、薬剤の種類や濃度、放射線量、対象とする生物学的なエンドポイント(治療効果、正常組織の有害事象など)に複雑に依存しますが、現在の治療計画では、薬剤濃度と放射線量に対する依存性は考慮されていません。通常、CBE値と呼ばれ日本語訳されることはありませんが、本稿では、治療効果のみについて議論しているため「薬剤治療効果比」と訳しています。
4) 扁平上皮がん細胞
扁平上皮細胞(魚の鱗のように見える薄く平らな細胞)から発生するがん。
5) コロニー形成法
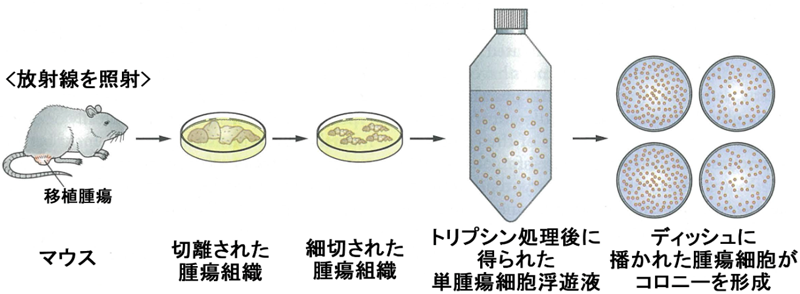
ディッシュで培養した細胞が細胞塊(コロニー)を形成できるかどうかによってその増殖能力を調べる方法。コロニー形成に成功した細胞の割合を細胞生存率と呼びます。大量に放射線を照射した細胞は、増殖能を失ってコロニーを形成できなくなります。がん細胞と正常細胞の大きな違いは、自律的に制御されない増殖を行う点にあるため、細胞生存率は治療効果と密接な関係にあります。今回の実験で実施したコロニー形成法の流れを下図に示します。
6) 実験の詳細を記載した論文
Masunaga et al. The dependency of compound biological effectiveness factors on the type and the concentration of administered neutron capture agents in boron neutron capture therapy, Springer Plus, 3:128 (2014)
参考URL (https://dx.doi.org/10.1186/2193-1801-3-128)
7) 粒子・重イオン輸送計算コード「PHITS」
あらゆる物質中での放射線の振る舞いを第一原理的に計算するシミュレーションコード。放射線施設の設計、医学物理計算、宇宙線科学など、工学・医学・理学の様々な分野で国内外3,000名以上のユーザーに利用されています。
参考URL (http://phits.jaea.go.jp/indexj.html)
8) 確率論的マイクロドジメトリ動態モデル(SMKモデル)
原子力機構が中心となって開発した微小な領域の放射線量から細胞生存率を計算する数理モデル。一般的な細胞生存率計算モデルは、放射線量を与える側(放射線の種類やエネルギー)の情報から生存率を評価しますが、SMKモデルでは、放射線量を受け取る側(染色体や細胞核の放射線量)の情報から生存率を評価するため、様々な放射線が混在する場においても精度よく計算することができます。また、個々の細胞の生存確率と細胞集団の生存率を区別して計算するため、BNCTのように個々の細胞核線量にばらつきが大きい細胞集団に対しても適応可能な唯一の細胞生存率計算モデルです。
9) RI内用療法
がん細胞に集積性のある薬剤に放射性同位元素(RI)を組み込み、その薬剤を経口的あるいは経静脈的に投与する放射線治療法の一種。現在は、ヨウ素-131(131I)などβ線を放出するRIを用いた手法が一般的ですが、近年、アスタチン-211(211At)など、よりがん細胞殺傷効果の高いα線を放出するRIを用いた治療法の研究が盛んに行われています。体内でα線が飛べる距離は、10Bの中性子捕獲反応で発生する荷電粒子と同じく細胞1個分程度であるため、その治療効果推定には本研究で開発した数理モデルが役立つと考えられます。
| 参考部門・拠点: | 原子力基礎工学研究センター |