2022-11-09 早稲田大学
発表のポイント
- 薬物に熱中性子を照射すると、原子核が活性化しX線ガンマ線を出す放射化に着目
- 独自開発の広帯域カメラを使用し、金ナノ粒子や抗がん剤などの放射化イメージングに成功
- これまでイメージングできなかった薬物の生体内での動態観察の実現につながる、診断・治療のための新しい可視化ツールとして期待
早稲田大学理工学術院の片岡 淳(かたおか じゅん)教授らの研究チームは、大阪大学放射線科学基盤機構の豊嶋 厚史(とよしま あつし)教授、同・大学院医学系研究科放射線統合医学講座の加藤 弘樹(かとう ひろき)准教授、角永 悠一郎(かどなが ゆういちろう)特任助教(常勤)、医薬分子イメージング学共同研究講座の松永 恵子(まつなが けいこ)特任助教(常勤)、理化学研究所光量子工学研究センターの小林 知洋(こばやし ともひろ)専任研究員、若林 泰生(わかばやし やすお)研究員、京都大学複合原子力科学研究所の高宮 幸一(たかみや こういち)准教授、岡山大学学術研究院医歯薬学域の上田 真史(うえだ まさし)教授らと共同で、様々な元素の分布を可視化する革新的手法「放射化イメージング」を提案し、その原理を実証しました。これまで可視化ができなかった薬物でも体の外からイメージングすることが可能となり、診断・治療の新しい可視化ツールとして幅広い応用が期待されます。
本研究成果は、2022年11月7日(月)(現地時間)に『Applied Physics Letters』のオンライン版で、また関連する論文も2022年11月3日(木)(現地時間)にCorrected Proofとして『Nuclear Instruments and Methods in Physics Research – section A』に掲載されました。
【論文情報】
(1)雑誌名:Applied Physics Letters
論文名:Activation imaging of drugs with hybrid Compton camera: A proof-of-concept study
DOI:10.1063/5.0116570
(2)雑誌名:Nuclear Instruments and Methods in Physics Research – section A
論文名:Activation imaging: New concept of visualizing drug distribution with wide-band X-ray and gamma-ray imager
DOI:10.1016/j.nima.2022.167599
(1)これまでの研究で分かっていたこと
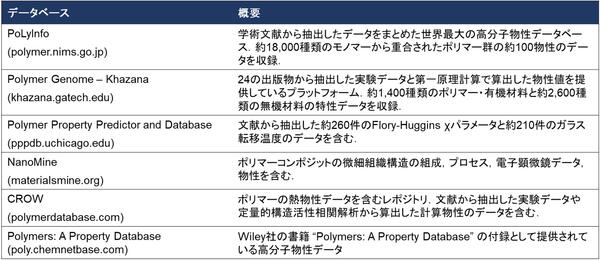
薬物を必要なときに必要な量だけ病巣に届ける「ドラッグデリバリーシステム(以下DDS)」の開発が、いま世界中で行われています。DDSを高度化すれば、注射や薬を飲む回数を減らしたり、副作用を少なくしたりすることが可能となります。一方で、薬物はひとたび体の中に入るとその動態は不明であり、狙った通りに薬物が病巣に届いたか、また目的の治療が行われているかを「その場」で確認するのは困難です。マウスなど小動物では、薬物に蛍光色素を標識してイメージングするのが一般的ですが、可視や赤外の蛍光は人体を透過することができません。これに代わる手法として、鉄やガドリニウムといった磁性体金属を標識し、MRI(磁気共鳴画像診断)でイメージングする手法も提案されています。この場合、そもそも使える元素が限られ、外部から強力な磁場をかける必要があり、また投与量が多い場合には毒性や副作用の懸念があります。また、核医学診断では放射性(RI)薬剤を用いて、ここから生ずるX線やガンマ線をSPECT(単一光子放射断層撮影)またはPET(陽電子放出断層撮影)でイメージングします。RI薬剤は超低濃度でも体の外からイメージングできるメリットがありますが、使用できる薬剤がさらに限定され、またイメージングする装置が高額で用途も限定され、汎用性に乏しい問題があります。さらに、SPECTやPETでイメージングするには、特定のRI核種を薬物に修飾する必要があり、本来の薬物がもつ性質や集積状況を変えてしまう恐れがあります。これら3つの手法のメリット・デメリットを表1にまとめます。

表1: 薬物の体内動態を可視化する、様々な手法の比較
(2)今回の研究で新たに実現しようとしたこと
投与された薬が体の中のどこにどれだけ集積しているか、移動しているかがわかると、病気の診断や治療、さらには新しい薬の研究開発に役立ちます。今回の研究では、抗がん剤として用いられるシスプラチン、DDSキャリアとして期待される金ナノ粒子とプラチナナノ粒子、造影剤として用いられるガドテリドールを試料としました。これらの薬物はそのままではイメージングできません。
そこで、薬物に熱中性子をぶつけると一部の原子核が活性化し、高エネルギーの光であるX線ガンマ線を出す「放射化」現象に着目しました。ここで生ずるX線ガンマ線は薬物に含まれる元素に固有のエネルギーをもち、また半減期と呼ばれる特徴的な時間スケールで減衰します。つまり、エネルギーと時間の両面から、「何」が「どれだけ」含まれるかを高精度で可視化することができると考えました。これまで行われてきた放射化分析では、スペクトル情報のみを用いて ppm(ppmは濃度の単位で100万分の1)以下といった極微量な元素を正確に同定します。ここに独自のイメージング技術を加えることができれば、薬物の種類だけでなく空間分布を追跡できる、全く新しい可視化技術が構築できます。たとえば、抗がん剤の一種であるシスプラチンに熱中性子を当てると、一部のプラチナ原子(Pt-196)が活性化し、質量数を1つ増やしたPt-197 が生成されます。Pt-197は不安定なため、77keV(keVはエネルギーの単位でキロ電子ボルト)のX線を出しつつ、半減期20時間で崩壊します。すなわち、このX線をイメージングすることで、RIを新たに修飾せずに、シスプラチンの体内動態を可視化することができるはずです。また、がん周辺の血管には、正常では存在しない多くの隙間が存在します。ナノ粒子は直径が数十ナノメートル(ナノメートルは10-9 m)と小さく、がん周辺のみで血管壁を抜けて組織中へと透過する性質(EPR効果:図1)が知られています。そこで、ナノ粒子に抗がん剤など薬剤を修飾すれば、有効なDDSキャリアとして働くことが期待できます。たとえば金ナノ粒子を熱中性子で放射化した場合、金(Au-197)の質量数が1つ増え、Au-198が作られます。Au-198は不安定なため半減期2.7日で崩壊し、その過程で412keVのガンマ線と、961keVのβ線(電子)を放出します(図1)。このガンマ線をイメージングすることができれば、抗がん剤など薬物動態を体の外からイメージングすることが可能となります。

図1: 金ナノ粒子を熱中性子で放射化した場合の応用例。EPR効果により、ナノ粒子はがんに選択的に取り込まれやすいため、412keV ガンマ線をイメージングすることで、がんへの薬物伝達の様子を確認できる。同時に発生するβ線は、がんへの殺傷効果が期待できる。
このように「放射化イメージング」はこれまで困難とされた様々な薬物を簡単かつ迅速に可視化する新しい手法として期待できますが、一方で元素ごとにどのようなX線やガンマ線を放出するかは全く異なります。現在、核医学診断で用いられる SPECTは概ね 300 keV以下のガンマ線のみ、またPETは 511keVのガンマ線のみを対象としたイメージング手法のため、可視化できる薬物の種類は限られてしまいます。つまり、既存の可視化装置では難しい、広エネルギーのX線やガンマ線を同時に可視化できる新しいカメラの開発が不可欠となります。
(3)新しく開発した手法と、それによる実証結果
まず、そのままではイメージングできない薬物を十分に放射化できることを示すことが重要です。本研究では、理化学研究所の小型中性子源システム RANS-II※2を用いて熱中性子照射の予備実験を行い、薬物ごとに必要な熱中性子の照射量と生成される核種について詳細な調査を行いました。続いて、より強度が高い京都大学複合原子力科学研究所の研究用原子炉 (KUR※3)において中性子照射実験を行いました。試料はろ紙にしみ込ませた状態で揮発し、金ナノ粒子、シスプラチン、プラチナナノ粒子、造影剤の一種であるガドテリドールそれぞれについて照射を行い、薬物から放出されるX線ガンマ線スペクトルを取得しました。照射条件と試料の一例を表2に、得られたスペクトルを 図2に示します。測定にはエネルギー分解能の高い、高純度ゲルマニウム検出器を用いました。金ナノ粒子は 412keV、 シスプラチンとプラチナナノ粒子は 77 keV、ガドテリドールは 364keV に強いピークを出すことが確認できます。この実験結果により、薬物が放射化されたことが実証されました。

表2: 熱中性子を照射した薬物サンプル

図2: 様々な薬剤の放射化スペクトル。黒丸は 図3のイメージングに用いた、元素特有のX線ガンマ線。
続いて、薬物動態を把握するためには、薬物がどのように移動しているのかをカメラで捉える必要があります。そのためには薬物の位置を正確かつ短時間で撮像し、逐次その位置を測定することになるため、高感度でX線ガンマ線をイメージングできるカメラが求められます。これらの元素特有のX線ガンマ線を可視化するため、独自に開発した「ハイブリッド・コンプトンカメラ※4」を用いたイメージングを試みました。 数百keV以上のガンマ線はエネルギーの一部を電子に渡し、自らは別な方向へ散乱される「コンプトン散乱」と呼ばれる反応を起こします。コンプトンカメラでは「散乱体」と「吸収体」で電子と散乱ガンマ線、両方の運動学を同時かつ正確に解くことで、入射ガンマ線の到来方向を決定することができますが、エネルギーの低いX線はイメージングすることができません。ハイブリッド・コンプトンカメラは散乱体の中心に 3×3mm 程度のピンホールを開けることで、数十キロ電子ボルトから数メガ電子ボルトの撮像を一度に可能とする装置です。図3に示す通り、すべての薬剤について20分以内の短時間でイメージングに成功しました。これらの短時間でのイメージングを繰り返すことで、薬物の移動を把握することができます。

図3: 中性子で放射化した各種薬剤のガンマ線画像。ハイブリッドコンプトンカメラ(※4)で撮影
(4)研究の波及効果や社会的影響
一般に薬物はひとたび体の中に入るとその動態を追跡することは困難です。病巣に薬物が正しく届いたか、また狙い通りの治療が行われているかを体の外から簡単に確認することができれば、様々な展開が期待できます。今回の提案である「放射化イメージング」は、従来用いられてきた (1)蛍光色素 (2)MRI (3)RI薬剤による可視化の、どの手法とも異なります。強いて言えばX線ガンマ線を用いたイメージングという観点では(3)と似ていますが、SPECTやPETに特化した、特殊なRI薬剤による修飾は必要なく、より汎用的かつ直接的に、薬物そのものの動態イメージングが可能です。とくに熱中性子を照射する場合、反応の前後で原子の質量数が+1増加します(たとえば、Pt-196がPt-197に変わる例と、Au-197 が Au-198に代わる例を前述しました)。ここで質量数が増えても、元素そのものが同じであることが重要です。そのため、薬剤としての集積状況が変わることがなく、その元素自身がX線ガンマ線を出すトレーサーとして機能するわけです。さらに、多くの放射化プロセスではX線やガンマ線だけでなく、β線を同時に放出することも注目すべき事実です。たとえば前述の金ナノ粒子では、放射化により生成された Au-198 は中性子過剰であり、半減期2.7日で電子を放出して陽子に変わろうとします。この際、余ったエネルギーである412keVのガンマ線とともに961keVのβ線を放出します。β線はがんの治療効果が期待され、治療・診断を同時に行う両面性を秘めています。
さらに、ナノ粒子は EPR効果により、様々な薬剤、とくに抗がん剤のキャリアとして多くの可能性を秘めています。たとえば高分子化合物であるmPEGを修飾した金ナノ粒子に、アルファ線放出核種であるアスタチン(At-211)をラベリングすることが提案されています。マウスを用いた実験では、腫瘍に伝達されたAt-211、つまりアルファ線の強い殺傷効果により、腫瘍の成長が大幅に抑制されたとする報告がされています※5。At-211 からもX線が発生しますが、これは半減期が 7時間と短いため、数日にわたって薬物の体内動態を探ることは困難です。そこで、たとえば一部の金ナノ粒子を投与前に放射化することができれば、金ナノ粒子から生ずるガンマ線(半減期2.7日)により薬物動態を長期間にわたってトレースすることが可能であり、かつβ線を用いた二重の治療効果(クロス・ファイア効果)が期待できます(図4)。近年、治療(Therapeutics)と診断(Diagnostics)を一体化した新しい医療技術「セラノスティクス (Theranostics)」が注目されていますが、今回の放射化イメージングはこの観点でもインパクトが大きい技術と言えます。

図4: 放射化した金ナノ粒子とアスタチンによる、セラノスティクスの開拓
(5)今後の課題
放射化による薬物動態イメージングは、ごく微量とはいえ放射性薬剤を生成し、生体内に投与することを前提とします。そのため(1)半減期が数日程度と短く、長く留まらないこと(2)放射化によって有害な物質が生成されないこと、が条件となります。金ナノ粒子やプラチナナノ粒子では、単一元素(金やプラチナ)の塊のため心配ありませんが、一般の薬剤は様々な元素から構成されます。たとえば、抗がん剤であるシスプラチンの化学式は[Pt(NH3)2Cl2]であり、プラチナのほかに窒素、水素、塩素が含まれます。この場合、必ずしも狙った元素(たとえばプラチナ)のみが放射化するとは限りません。また、放射化の過程で原子核の反跳などにより、分子の化学結合が壊れる可能性も想定する必要があります。一例として、図5では高速液体クロマトグラフィー(HPLC)で測定したシスプラチンの紫外―可視吸収スペクトルを、中性子照射前後で比べてみました。もっとも強度が強いピークがシスプラチン分子に対応し、その強度・位置共にほとんど変化がありません。一方で、その前後にあるごく小さなピークに差が見られ、これらが放射化で壊れた分子による影響と見られます。これら余剰な副産物は、HPLCで取り除くことができますが、今後は様々な薬剤の放射化による性質改変を併せて調査する予定です。

図5: 熱中性子を照射する前(左)と照射後(右)での HPLCによる紫外―可視吸収スペクトルの比較
(6)研究者のコメント
今回の研究では「安定な原子に中性子をぶつけ、質量数を1つ増やして重い原子を作る」、“中性子捕獲”と呼ばれる反応を医療に応用し、新しい薬物動態の可視化手法「放射化イメージング」を提案しました。実は全く同じ反応が、宇宙における元素合成の基礎となっています。我々の身の回りには、約300種類の安定な原子核が存在します。原子番号26番の鉄までは、星の中での核融合で生成されますが、それ以上重い元素は中性子を一つ一つ捕獲しながら、気の遠くなるような長い年月をかけて生成されてきたことが分かっています(これらは反応がゆっくり進むため、slow process または s-過程と呼ばれます)。一方で、今回の主役である金(原子番号79)やプラチナ(原子番号78)といったレアメタルは、そのようなs-過程では決して作られないことも知られていて、その起源すら謎です。近年、星の爆発した最後に残る中性子星が合体する特殊な系(キロノバ)で、重力波が発生することが発見されましたが、同時にキロノバは急速な中性子捕獲(rapid process または r-過程と呼ばれます)により、レアメタルの有力な生成現場であることも指摘されています。
今回、突飛な発想ではありますが、実験室レベルで宇宙の元素合成を真似ることで、医療分野に新しい技術展開ができることを思いつきました。医療と宇宙、実は遠いようで近い分野であることを実感していただければと思います。さらに、放射化で生ずる様々なX線ガンマ線を迅速に可視化するには、高感度かつ広帯域のカメラが必要です。本研究で用いたハイブリッド・コンプトンカメラは、もともと衛星搭載のために開発した技術であり、ここでも異分野横断の新しい架け橋が実現されています。
(7)用語解説
※1 以下の論文から画像例を転載
・蛍光色素イメージング : Wang, D. et al. 2017, J. Am. Chem. Soc.
・MRI イメージング : Schleich, N. et al. 2014, J. Control Release
・RI イメージング : Simone, E. et al. 2012, Biomaterials
※2 理研小型中性子源システム RANS-II については以下を参照
https://www.riken.jp/press/2019/20191118_4/index.html
※3 京都大学複合原子力科学研究所の研究用原子炉KUR については以下を参照
https://www.rri.kyoto-u.ac.jp/facilities/kur
※4 ハイブリッド・コンプトンカメラについては以下を参照
・Omata et al. 2020, “Performance demonstration of a hybrid Compton camera with an active pinhole for wide-band X-ray and gamma-ray imaging”, Scientific Reports, 10, 14064
DOI: 10.1038/s41598-020-71019-5
・「X線ガンマ線の同時可視化を可能に」
https://www.waseda.jp/top/news/69935
※5 以下の文献を参照
Kato et al. 2021, “Intratumoral administration of astatine-211-labeled gold nanoparticle for alpha therapy”, Journal of Nanobiotechnology, 19, 223
DOI: 10.1186/s12951-021-00963-9
(8)論文情報
雑誌名:Applied Physics Letters
論文名:Activation imaging of drugs with hybrid Compton camera: A proof-of-concept study
執筆者名:Nanase Koshikawa1、Akihisa Omata1、Miho Masubuchi1、Yu Okazaki1、Jun Kataoka1、Keiko Matsunaga2、Hiroki Kato2、Astushi Toyoshima3、Yasuo Wakabayashi4、Tomohiro Kobayashi4
1.早稲田大学理工学術院 先進理工学研究科 物理学及応用物理学専攻
越川 七星(論文筆頭著者)、小俣 陽久、増渕 美穂、岡崎 優、片岡 淳
2.大阪大学大学院医学系研究科
松永 恵子、加藤 弘樹
3.大阪大学放射線科学基盤機構
豊嶋 厚史
4. 理化学研究所光量子工学研究センター
若林 泰生、小林 知洋
掲載日(現地時間):2022年11月7日(月)
DOI:10.1063/5.0116570
掲載URL:https://doi.org/10.1063/5.0116570
雑誌名:Nuclear Instruments and Methods in Physics Research – section A
論文名:Activation imaging: New concept of visualizing drug distribution with wide-band X-ray and gamma-ray imager
執筆者名:N.Koshikawa1、A.Omata1、M.Masubuchi1、J.Kataoka1、Y.Kadonaga2、A.Toyoshima3、K.Matsunga2、H.Kato2、Y.Wakabayashi4、T.Kobayashi4、K.Takamiya5、M.Ueda6
1.早稲田大学理工学術院 先進理工学研究科 物理学及応用物理学専攻
越川 七星(論文筆頭著者)、小俣 陽久、増渕 美穂、片岡 淳
2.大阪大学大学院医学系研究科
角永 悠一郎、加藤 弘樹、松永 恵子、
3.大阪大学放射線科学基盤機構
豊嶋 厚史
4. 理化学研究所光量子工学研究センター
若林 泰生、小林 知洋
5. 京都大学複合原子力科学研究所
高宮 幸一
6. 岡山大学学術研究院医歯薬学域
上田 真史
掲載日(現地時間):2022年11月3日(木)
DOI:10.1016/j.nima.2022.167599
掲載URL:https://doi.org/10.1016/j.nima.2022.167599
(9)研究助成
本研究は、戦略的創造推進事業 ERATO「片岡ラインX線ガンマ線イメージング」(令和3~8年度;グラント番号 JPMJER2102)の支援を得て実施したものです。ここに深く感謝申し上げます。