生体内の酸性環境を高解像度で観察する新技術
2019-08-20 大阪大学,科学技術振興機構
ポイント
- 生物試料を超解像観察するための光スイッチング蛍光たんぱく質、rsGamillusを開発した。
- rsGamillusは光刺激により、蛍光のオン・オフ制御を行うことができる。
- 従来の可逆的光スイッチ蛍光たんぱく質は全て、pH5~6以下の酸性環境で蛍光を失うという課題があったが、rsGamillusはpH4.5~9.0の細胞環境pHで、安定した強度の蛍光を放つ。
- 酸性環境中の未知の生命現象を発見する基盤技術となり、医学・創薬研究への貢献も期待される。
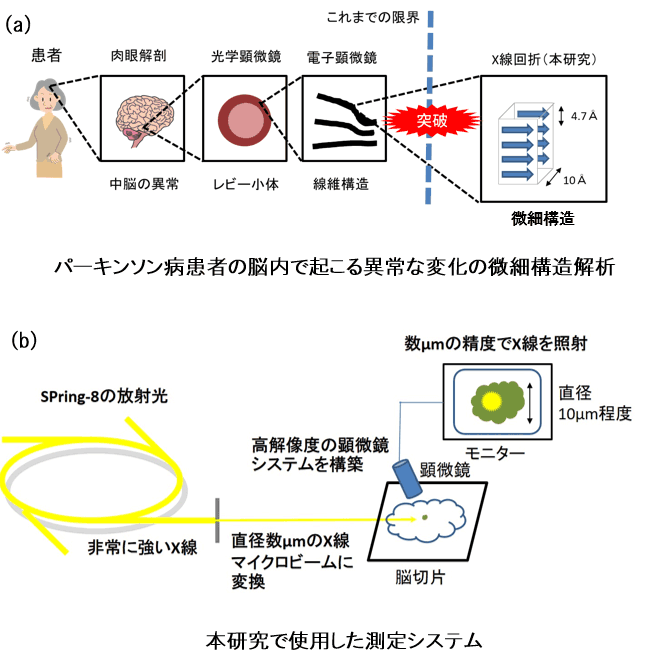
大阪大学 産業科学研究所の永井 健治 教授らの研究グループは、pH4.5~9.0の細胞環境で安定して蛍光注1)する、耐酸性の光スイッチ型緑色蛍光たんぱく質注2)“rsGamillus”の開発に成功しました。特殊な顕微鏡法と組み合わせることで、光の回折限界注3)を超えた分解能で、生きた生物試料の高解像度画像を撮影できるようになります。
研究グループは昨年、日本産ハナガサクラゲの光る触手から新規の蛍光たんぱく質を単離改変することによりpH4.5~9.0の細胞環境で安定して蛍光する耐酸性の緑色蛍光たんぱく質“Gamillus”を開発しました。
今回、吸収スペクトル測定とX線結晶解析注4)により、酸性環境下において、Gamillusの蛍光・非蛍光状態が光刺激により可逆的に切り替わること(光スイッチ)、そのメカニズムが蛍光発色団注5)のtrans-cis異性化並びにフェノール水酸基のプロトン化/脱プロトン化であることを見いだしました(図1)。このメカニズムを基にした分子設計、遺伝子変異導入により、光スイッチのコントラストを向上させた変異体rsGamillusを開発しました。
現在までに報告されている可逆的光スイッチ蛍光たんぱく質が全てpH5~6以下の酸性環境で蛍光を失うのに対して、rsGamillusは酸性環境でも安定した蛍光を放ち、細胞内のほぼ全てのpH環境で使用可能であることが分かりました(図2左)。人工的に模した細胞酸性環境中(pH4.5)で、1分子蛍光の輝点重心位置の計測に基づく超解像顕微鏡観察に応用できることを証明しました(図2右)。酸性細胞小器官は、2016年のノーベル医学・生理学賞受賞者の大隅 良典 博士が発見したオートファジーなど、多くの生命機能に密接に関わっています。しかし、既存の光スイッチ型の蛍光たんぱく質は、低pHで蛍光しないため、酸性細胞小器官内での使用が限られていました。
rsGamillusは、酸性環境中の未知の生命現象を発見するための基盤技術となり、医学・創薬研究にも大きく貢献すると期待されます。
本研究成果は、2019年8月15日に「Cell Chemical Biology」(オンライン)に掲載されました。
本研究は科学技術振興機構(JST) 戦略的創造研究推進事業 CREST「超解像『生理機能』イメージング法の開発と細胞状態解析への応用」(研究代表者:永井 健治)の一環として行われました。
<研究の背景>
リソソームなどの酸性細胞小器官(50~1500nm)は、生体分子や細胞内小器官との融合や分裂を通して、生体分子の修飾・輸送・分解など、生命活動に幅広く関わります。2016年のノーベル医学・生理学賞を受賞した大隅 良典 博士が発見したオートファジーも、酸性細胞小器官が関わる生命現象の一例です。植物細胞においては、細胞内酸性小器官に加えて、細胞間隙(細胞壁)が酸性に保たれています。細胞間隙は、単なる物質輸送だけでなく、物質代謝や成長にも関わる極めて重要な場です。
超解像顕微鏡法は、生きた細胞内の生体分子の局在や動態を、光の回折限界(~300nm)を超えた解像度で観察することができる画期的な手法です。観察対象である生体分子を標識するための蛍光タグと、特殊な照明パターン(スキーム)を組み込んだ顕微鏡の2つが必要です。光スイッチ型の蛍光たんぱく質をタグとして用いる超解像法は、たんぱく質を簡便に標識でき、細胞に対する毒性も比較的小さいことから、幅広い研究者に利用されています。しかし、現在報告されている光スイッチ型の蛍光たんぱく質の多くは、pH5~6以下の酸性環境で消失するといった問題点があります。従って、酸性細胞小器官の細かい動態や、酸性細胞環境中の微小構造を調査するためにも、耐酸性で緑色の蛍光たんぱく質が強く求められていました。
<本研究成果が社会に与える影響(本研究成果の意義)>
本研究成果を応用することで、酸性細胞小器官の動態や、酸性細胞環境中の微細構造を、より鮮明にライブ観察できるようになります。一方で、酸性細胞環境中の複数たんぱく質の相互動態を調べるためには、緑色に加えて、青・赤色領域の耐酸性の光スイッチ型蛍光たんぱく質の新規開発と、それを併用したマルチカラーでの超解像観察法が今後必要となります。こうした新規ツール開発を通じて、酸性細胞環境で起こる未知の生命現象の発見と、酸性環境中の分子異常が関わる疾病メカニズムの詳細解明が期待されます。
<参考図>
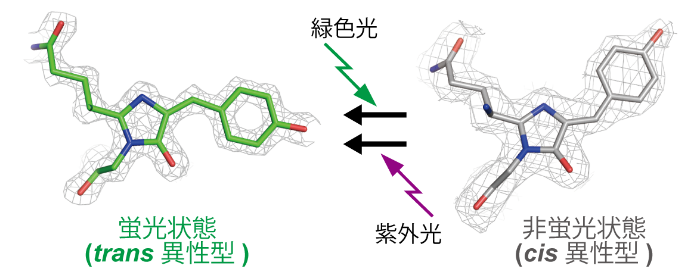
図1 Gamillus、rsGamillusの光スイッチの分子メカニズム
緑色光刺激により、蛍光発色団中のフェノール環がtrans-cis異性化し、プロトン化されることで、スイッチオフする。紫外光刺激により、元の蛍光状態に戻る。
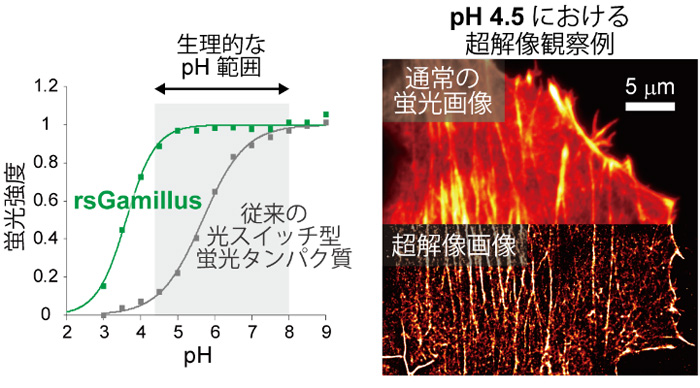
図2
(左)pHと蛍光たんぱく質の蛍光強度の相関図。
(右)人工的に模した酸性細胞環境(pH4.5)中における、アクチンという細胞骨格たんぱく質をrsGamillusで標識した哺乳類細胞の蛍光画像。超解像顕微鏡観察により、分解能の向上した細胞画像を取得できることを証明した。
<用語解説>
- 注1)蛍光
- 光を吸収し、その光よりも低エネルギー(長波長)の光を放出する物質の性質のこと。rsGamillusは青色光(~500nm)を吸収し、緑色光(~520nm)を放出する。
- 注2)蛍光たんぱく質
- 蛍光を発するたんぱく質の総称。2008年のノーベル化学賞で知られる下村 修 博士らが、1962年にオワンクラゲから初めて遺伝子を単離し、緑色蛍光たんぱく質(Green Fluorescent Protein,GFP)と命名した。
- 注3)光の回折限界
- 通常の光学イメージングでは、光学的な収差のない理想のレンズを用いた場合でも、試料面上の輝点はカメラ上である程度の広がり(~300nm)を持って集光する。像として識別することができる2点間の最小距離を回折限界という。
- 注4)X線結晶解析
- 結晶化した分子にX線を照射し、回折を記録・解析することで、その立体構造を約0.1~1nmの精度で求めることができる手法。
- 注5)蛍光発色団
- 蛍光たんぱく質中の、実際に蛍光現象に関わる部位を蛍光発色団と呼ぶ。GamillusとrsGamillusの場合、グルタミン・チロシン・グリシンの3アミノ酸から、自己触媒的に蛍光発色団が形成される。
<論文タイトル>
- “Acid-tolerant reversibly switchable green fluorescent protein for super-resolution imaging under acidic conditions”
- DOI:10.1016/j.chembiol.2019.07.012
<お問い合わせ先>
<研究に関すること>
永井 健治(ナガイ タケハル)
大阪大学 産業科学研究所 生体分子機能科学研究分野 教授
<JST事業に関すること>
中村 幹(ナカムラ ツヨシ)
科学技術振興機構 戦略研究推進部
<報道担当>
大阪大学 産業科学研究所 広報室
科学技術振興機構 広報課