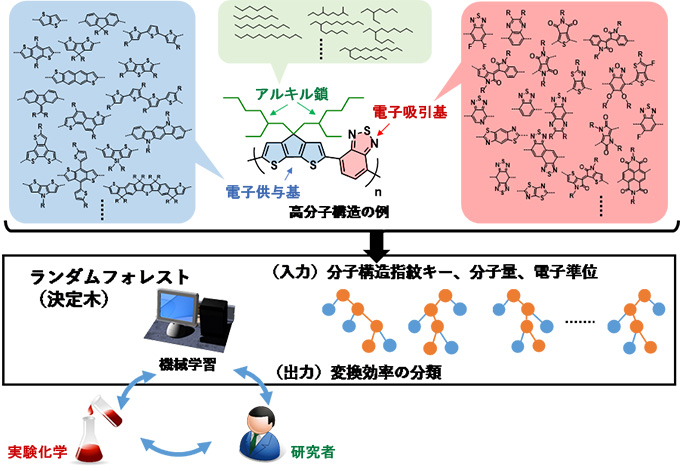
産業界との連携制度(バトンゾーン制度)を活用
2018-05-07 理化学研究所
理化学研究所(理研)脳神経科学研究センター理研CBS-オリンパス連携センター(理研BOCC)の宮脇敦史連携センター長と上喜裕テクニカルスタッフⅠ、脳神経科学研究センターの毛内拡客員研究員らの研究グループ※は、多光子励起レーザー走査型顕微鏡[1]専用の自動球面収差補正システム[2]を共同開発しました。これは、理研の産業界との連携センター制度(バトンゾーン制度)を活用した事例です(図)。
本研究成果は今後、学習や記憶の神経基盤と考えられている神経棘突起[3]の形態変化のより精密な計測などへの応用が期待できます。
生体組織などの屈折率[4]が高く厚みのある標本を、光学顕微鏡を用いて観察する際、対物レンズ[5]から出射された光は焦点面[6]にずれを生じ、観察像が不鮮明なることが知られています(球面収差[7])。球面収差は、観察位置が深くなるにつれて増大するため、深部観察を行う場合には無視できない現象であり、解決すべき課題です。
今回、研究グループはこれらの課題を解決するために、「自動球面収差補正システム(Deep-C)」を開発しました。Deep-Cをマウス生体脳イメージングに適用した結果、特に大脳皮質[8]深部において、光学的収差の少ないより鮮明な画像が得られることを見いだしました。Deep-Cを搭載したTruResolution対物レンズ(オリンパス株式会社)は、2018年1月より実用化しています注1)。
本研究は、国際科学雑誌『Biochemical and Biophysical Research Communications』(4月18日付)に掲載されました。
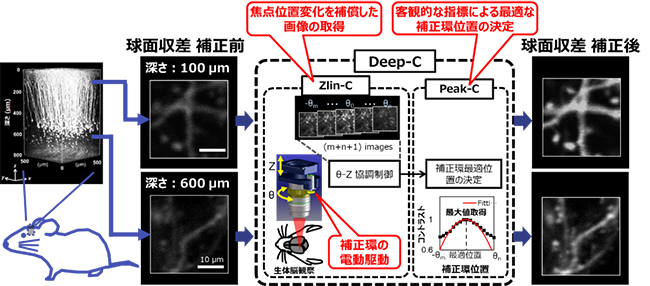
図 自動球面収差補正システム(Deep-C)の概要
注1) オリンパス株式会社 2018年1月17日ニュースリリース 脳科学研究における深部観察を最適化「多光子励起レーザー走査型顕微鏡専用のTruResolution対物レンズを発売」業界初の自動球面収差補正機能を理化学研究所と共同開発
FVMPE-RS – 多光子励起レーザー走査型顕微鏡(生産終了:2024現在はFV4000MPE)
※研究グループ
理化学研究所
脳神経科学研究センター
理研CBS-オリンパス連携センター
連携センター長 宮脇 敦史(みやわき あつし)
テクニカルスタッフⅠ 上 喜裕(うえ よしひろ)
(オリンパス株式会社科学開発2部)
テクニカルスタッフⅠ 樋口 香織(ひぐち かおり)
(オリンパス株式会社科学開発2部)
テクニカルスタッフⅠ 西脇 大介(にしわき だいすけ)
(オリンパス株式会社光学システム開発2部)
テクニカルスタッフⅠ 田島 鉄也(たじま てつや)
(オリンパス株式会社LSマーケティング部)
テクニカルスタッフⅠ(研究当時) 岡咲 賢哉(おかざき けんや)
(オリンパス株式会社科学営業企画部)
脳神経科学研究センター
客員研究員 毛内 拡(もうない ひろむ)
(お茶の水女子大学 基幹研究院自然科学系 助教)
細胞機能探索技術研究チーム
専門職研究員 濱 裕(はま ひろし)
神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究「レゾナンスバイオ(研究代表者:宮脇敦史)」、挑戦的萌芽研究「生体大脳皮質ニューロピルからのシナプスとグリアのカルシウム信号抽出と解析(研究代表者:平瀬肇)」、基盤研究A「グリア細胞により支援される皮質神経回路の可塑性(研究代表者:平瀬肇)」および国立研究開発法人日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」の一環として行われました。
背景
理研CBS-オリンパス連携センター(理研BOCC)は、理化学研究所の産業界との連携センター制度注2)に基づき2007年に設置した連携センターです。設立の目的は、脳神経科学研究センター(CBS)の脳科学に関する知見とオリンパスの技術を連携させ、バイオイメージングに関しての基盤技術と機器を開発し、脳科学研究の向上に貢献することです。この実現に向けて、バイオイメージングに関する、①技術・機器開発、②研究支援、③技術の普及・移転を3本の柱として活動しています。
近年、バイオイメージング技術を飛躍的に向上させた技術・機器の一つとして、多光子励起レーザー走査型顕微鏡が挙げられます。この特殊な顕微鏡は、従来と比べてより深部の構造を高解像度で観察できるため、特に脳研究分野で幅広く使われています。高解像度でのイメージングを実現するためには、高い開口数[9]の対物レンズが必要ですが、対物レンズの先端部分を満たす媒質と観察対象の屈折率が異なっていると、全光線は1点に集光せず、得られる観察画像が不鮮明になります(球面収差)(図1B上)。球面収差は、水とガラスの間のみならず、水と生体組織の間でも生じることが知られています。このため通常、対物レンズには、補正環と呼ばれる、球面収差を補正するリング状の調整機構が備わっており、標本に応じて補正環を回転させることにより球面収差を補正できるように設計されています(図1C上)。
例えば、図1B下および図1C下は、マウス脳の神経細胞群のみを標識し、その樹状突起[10]の一部を拡大してイメージングした画像を3次元再構成した図ですが、補正前(B)に比べて補正後(C)では、画像の質が格段に向上していることが分かります。脳深部の微細な構造を鮮明に観察し、再現性のある画像データを取得するには補正環を適切に調整することが必須です。
しかし、これまで球面収差が最小となる最適な補正環位置を客観的に決定する指標が存在しませんでした。画像の輝度などを頼りに補正環位置を手動で動かしていたため、正確で再現可能な調整を行うことは極めて困難でした。さらに、補正環を回転させると、それに追従して焦点位置も変化するため、観察対象を見失ってしまい、球面収差が最小となったかを評価することも困難でした。異なる深さにある複数の部位を往来しながら観察することは、ほとんど不可能でした。
研究手法と成果
これらの問題を解決するために、共同研究グループは補正環の回転を電動化し、顕微鏡のZステージ[11]と連動させることで、焦点位置の変化を補償する(Zlin-C)デバイスと、取得画像のコントラスト値[12]が最大となるように最適な補正環位置を計算するアルゴリズム[13](Peak-C)とから構成される自動球面収差補正システム(Deep-C)を開発しました(図2)。
Deep-Cは、任意の深さにおいて、焦点位置を固定しながら補正環位置を連続的に変化させて複数枚の画像を取得し、Peek-Cによって取得画像のコントラストを評価し、コントラストの最大値が得られる補正環位置を最適のものとして決定します。図3は、直径0.5マイクロメートル(μm、1μmは1,000分の1mm)の蛍光ビーズを用いて、補正環回転による焦点位置変化を補正するZ-linCの効果を検討した実験結果を示しています。
まず、Z-linCの機能がない場合(図3A)は、蛍光ビーズをある深さz0に固定します。補正環の初期位置θ0で、この蛍光ビーズが視野に入るように対物レンズの位置(Z)の調整を行います。その後、補正環位置を-θ1からθ5まで連続的に変化させます。ここでは、蛍光ビーズの縦横(xy)断面の画像に加え、蛍光ビーズの深さ方向の情報、すなわちxz断面画像を示しています。実際のイメージングにおいて、リアルタイムで観察できるのはxy断面画像のみであり、球面収差を補正するにはxy断面画像から最適な補正環位置を決定する必要があります。しかし、補正環位置を変化させると焦点位置が変化するため、焦点面(xy断面)の蛍光ビーズは、見失われてしまいます。この状態でPeek-Cによってコントラストの最大値が得られる補正環位置を計算すると、実際はθ3が真の補正環最適位置であるにもかかわらず、θ1を見かけ上の最適位置と誤決定してしまいます(図3A)。
一方、図3BはZ-linCの機能がある場合を示しています。補正環位置に追従して焦点位置の変化を補償するように対物レンズの深さ位置を調節することで、蛍光ビーズと焦点面は常に一致しています。これによって、補正環の真の最適位置θ3に正しく到達することができています(図3B)。
次に、神経細胞の一部を黄色蛍光タンパク質で標識した遺伝子改変マウス(YFP-H)を用いて、生体脳イメージングにおけるDeep-Cの効果を検証しました。麻酔下の成体マウスの頭部を固定し、頭蓋骨の一部にカバーガラス(厚さ0.17mm)を用いて観測用の窓を作製しました。対物レンズの先端は生理食塩水で満たし、脳表から深さ800μmまでの大脳皮質領域で、各深さにおける補正環の最適位置をDeep-Cによって決定しました。
一方、顕微鏡に対物レンズを装着する際、補正環をつかんだまま右回しにねじ込むことが多く、その場合、補正環は調整範囲の終端位置(50°)に固定されます。このとき、球面収差の影響により観察画像は大きく劣化し、特に微細構造の解像度は低くなってしまいます(図4A)。Deep-Cを適用したところ、観察深さに応じて補正環の最適位置が変化することが見いだされました(図4B)。実際には、脳表から800μmの深さまでほぼ連続的に最適な補正環位置での撮像が可能となりました(図4C)。
今後の期待
本研究によって、脳内部の球面収差を観測する深さに応じて連続的に自動補正することで、スパインに代表される脳内の微細構造の形態やその時系列的な変化などを、より精密に再現性高く測定することができます。従来、高開口数の対物レンズは、複数の人で共有して使用される場合が多いため、実験時の補正環位置が最適化されないまま、スパインの密度や大きさを誤って計測する可能性があります。スパインの形態変化は、学習や記憶の神経基盤と密接な関係があると考えられており、定量的かつ再現性の高い観察技術が渇望されています。
生物学は多様性の学問であり、生物顕微鏡を巡る多様な課題が山積されています。BOCCにおいて研究者と技術者がうまく連携して、そうした課題解決に取り組むことでさまざまな価値を創出すると期待できます。
原論文情報
Yoshihiro Ue, Hiromu Monai, Kaori Higuchi, Daisuke Nishiwaki, Tetsuya Tajima, Kenya Okazaki, Hiroshi Hama, Hajime Hirase and Atsushi Miyawaki, “A spherical aberration-free microscopy system for live brain imaging”, Biochemical and Biophysical Research Communications, 10.1016/j.bbrc.2018.04.049
発表者
理化学研究所
脳神経科学研究センター 理研CBS-オリンパス連携センター
連携センター長 宮脇 敦史(みやわき あつし)
テクニカルスタッフⅠ 上 喜裕(うえ よしひろ)
脳神経科学研究センター
客員研究員 毛内 拡(もうない ひろむ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 多光子励起レーザー走査型顕微鏡
- レーザー走査型顕微鏡とは、標本上の1点に集光したレーザーを2次元に走査することで画像を取得する顕微鏡のこと。ライフサイエンスの分野では一般的に、レーザーを励起光とし、標本に含まれる蛍光物質を励起し、蛍光物質から発せられる蛍光を検出するレーザー走査型蛍光顕微鏡が使われる。蛍光は、通常一つの光子が蛍光物質に吸収されて蛍光を発する1光子励起蛍光であるが、光子の密度を極めて高くすると、2つ以上の光子が同時に蛍光物質に吸収されて蛍光を発する多光子励起蛍光を起こすことができる。多光子励起レーザー走査型顕微鏡は、この多光子励起を利用しており、多くは二つの光子を吸収する2光子励起(two-photon excitation)であるため2光子励起レーザー走査型顕微鏡とも呼ばれる。多光子励起では励起光の波長が1光子励起に比べ倍以上に長くなるため、標本のもつ散乱の影響を低減でき、組織の深部まで届きやすいという特徴がある。
-
- 自動球面収差補正システム
- 観察画像を不鮮明にする球面収差を、誰もが容易に自動補正できるようにしたシステム。
-
- 神経棘突起(しんけいきょくとっき)
- 神経細胞の樹状突起から突き出ているトゲ状の隆起。スパインとも呼ばれる。
-
- 屈折率
- 真空中における光の速度と、媒質中における光の速度の比(n)。n=c/c’c:真空中の光速、c’:媒質中の光速。光が二つの異なる媒質中を一方の媒質から他方の媒質に進むとき、スネルの法則n・sinθ=n’・sinθ’に従って光は屈折され、光の進む方向が変わる。
-
- 対物レンズ
- 観察対象に最も近いレンズ。対物レンズは光学顕微鏡の基本的な性能・機能を決定付ける最重要光学ユニット。対物レンズは基本的に、使用用途・観察法・倍率・性能(収差補正)によって大別される。
-
- 焦点面
- 対物レンズの焦点を通る、光軸に対して垂直な平面。
-
- 球面収差
- 理想的な結像と、光学系を通った実際の結像とのズレを指す。光軸上の物点から出た光線が結像する場合、物点から射出される光線と光軸とのなす角の大きさによって、結像位置での光線が光軸と交わる位置が異なる収差のこと。
-
- 大脳皮質
- 大脳の表面の灰白質の部分のこと。主として神経細胞やグリア細胞から成る。
-
- 開口数
- 対物レンズの性能(分解能、焦点深度、明るさなど)を判断するための重要な指標で、NAとも呼ばれる。物体から対物レンズに入射(もしくは出射)する光線の光軸とのなす最大角度をθ、物体と対物レンズ間の媒質の屈折率をnとしたとき、NA=n・sinθ。この値が大きい(高開口数)ほど、対物レンズの性能は高くなる。
-
- 樹状突起
- 神経細胞の細胞体から樹木のように分岐した複数の突起のこと。軸索からの興奮を細胞体に伝える役目がある。
-
- Zステージ
- 対物レンズを光軸方向に移動させ、サンプルと対物レンズの相対的な位置関係を変化させる駆動機構。
-
- コントラスト値
- 一般的に明るい部分と暗い部分の輝度の差を表す指標。
-
- アルゴリズム
- 計算の手法、やり方。
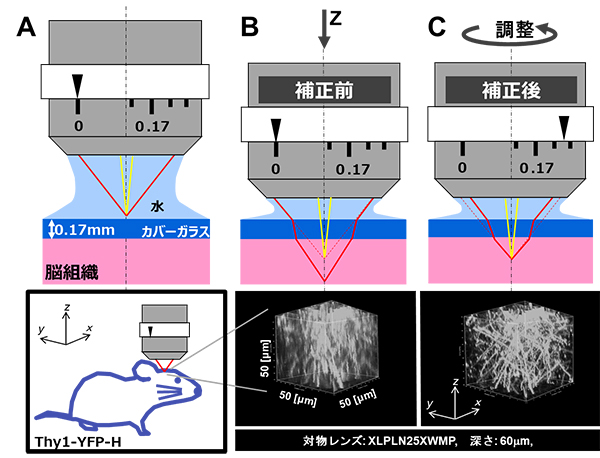
図1 補正環による球面収差補正前後での画像の比較
(A)水浸対物レンズ(XLPLN25XWMP)は、入射光線が水中の焦点に収束するように設計されている。
(B-C)上:カバーガラスの下の脳組織内部の観察。カバーガラスと脳組織を通過した励起光は焦点に収束せず、球面収差を生じる。一方、補正環をカバーガラスの厚さ(一般に0.17mm)と脳組織の観察深さに応じた位置に手動調整することで、全光線が1点に集光し球面収差が補正できる。
下:マウス生体脳の脳表より深さ60マイクロメートル(μm、1μmは1,000分の1mm)から深さ110μmで得られた神経細胞群の3次元再構成画像の比較。図中のx,y,zはそれぞれ、縦横高さを表している。一辺の長さは50μm。
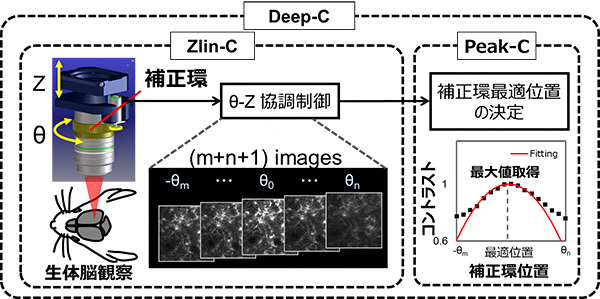
図2 Deep-C概略図
デバイスZlin-Cは、補正環の回転(θ)と観察深さ(Z)を協調的に動作させることで、補正環を回転させた際にもターゲットにピントを合わせたまま複数枚の画像を取得する。アルゴリズムPeak-Cは、複数枚の取得画像のコントラスト評価を行い、コントラスト最大値が得られる補正環最適位置を決定する。
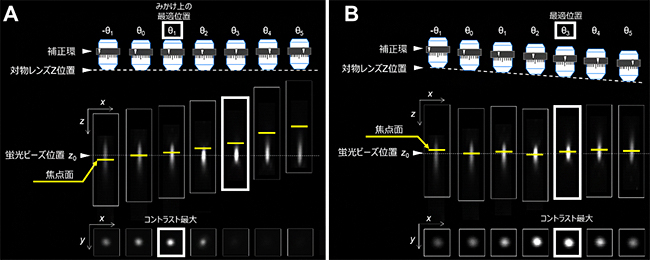
図3 補正環の回転による焦点位置変化とZlin-Cの効果
(A)Zlin-Cなしで補正環位置を変化させた場合、ビーズと焦点面は一致しなくなり、xy断面ではビーズを観察できない。
(B)一方、Zlin-Cによって補正環位置と対物レンズのZ位置が協調的に動くことによって補正環位置を変化させてもビーズと焦点面は常に一致する。

図4 マウス生体脳イメージングにおけるDeep-Cの効果検証
(A) 補正環位置を終端位置(50°)に固定した場合の、深さ100μmと600μmにおける微細構造のxy断面を一部拡大して表示した。スケールバーは10μmを表している
(B) 深さ100μmから600μmまで100μmごとに最適な補正環位置[deg]を決定し、深さ100μmと600μmにおける微細構造のxy断面を一部拡大して表示した。
(C) Deep-Cによって決定した最適な補正環位置における、脳表より深さ800μmまでの連続的なイメージング画像の3次元再構築画像。