2022-01-14 分子科学研究所
発表のポイント
- H–超イオン導電性を示す固体電解質材料を初めて創出
- H–導電を利用した新たな電気化学デバイス開発への展開が期待
概要
分子科学研究所の小林玄器 准教授、竹入史隆 助教、渡邉明尋 博士(当時 分子研特別共同利用研究員、東京工業大学 博士課程学生)らは、東京工業大学の菅野了次 特命教授、高エネルギー加速器研究機構 物質構造科学研究所の神山崇 名誉教授、大友季哉 教授、ヘルムホルツ研究所のDominic Bresser博士、フランス原子力・代替エネルギー庁のSandrine Lyonnard博士、ラウエ・ランジュバン研究所のBernhard Frick博士らとの国際共同研究によって、負の電荷をもつ水素“ヒドリド(H–)” ※1を高速かつ低い活化エネルギーで拡散する超イオン導電体※2Ba1.75LiH2.7O0.9 (以下、BLHO)を開発しました。
固体内を水素が拡散するイオン導電体※3は、燃料電池を始めとした水素エネルギーデバイスの固体電解質として利用されています。一般的には正電荷のプロトン(H+)が電荷輸送を担うことが知られていますが、近年、H–も可動イオンになることが明らかとなり、水素の新たな電荷担体※4として注目を集めています。H–は一価、適度なイオン半径、軟らかさといった“高速拡散に適した特徴”を有することから、中低温域(室温〜400 ºC程度)で作動する固体電解質の開発が期待されていますが、高い導電率と低い活性化エネルギーを兼ね備えた物質は見いだされていませんでした。
本研究チームは、電荷担体となるH–と酸化物イオン(O2–)が共存する酸水素化物※5を対象にした物質探索をおこない、新規H–イオン導電体BLHOを開発することに成功しました。酸水素化物の合成にこれまで主に用いられてきた高圧合成法※6ではなく、常圧下での一般的な固相反応で酸水素化物を合成したことで、多量の空孔を含む常圧安定組成[Ba1.75VBa0.25]Li[H2.7VH0.4O0.9](VBa: Ba空孔、VH: H空孔)の存在を見いだせたことがH–超イオン導電相の発見の鍵となりました。
BLHOは、300ºCで生じる構造相転移※7により、実用性能の基準である10–2 S/cmを越える高いイオン導電率がほぼ温度依存性なく得られる、いわゆる超イオン導電体になります。イオン導電体の研究開発の歴史において、超イオン導電状態の発見は、その後の固体電解質の開発を促進するきっかけとなってきました。今回、H–導電体で初めて超イオン導電状態が発見されたことは一つの分岐点であり、今後、H–導電体の更なる高性能化や新たな水素利活用技術の創出に向けて物質開発が大きく進展することが期待できます。
本研究は、JST戦略的創造研究推進事業(さきがけ「新物質科学と元素戦略」)、NEDOエネルギー・環境新技術先導研究プログラム、文部科学省科学研究費助成事業 新学術領域研究「ハイドロジェノミクス:高次水素機能による革新的材料・デバイス・反応プロセスの創成」、「複合アニオン化合物の創製と新機能」、日本学術振興会 科学研究費助成事業の支援を受けて行われました。
本研究成果は、2022年1月13日午後4時(英国ロンドン時間)にSpringer Natureが発行する国際学術誌「Nature Materials」に掲載されました。
研究の背景
H–は、一価、適度なイオン半径、大きな分極率といった高速イオン導電に適した特徴をもつだけでなく、卑な酸化還元電位※8(–2.25 V vs. SHE)に基づく強力な還元力を有しています。このため、H–のイオン導電現象を電気化学デバイスに応用することができれば、蓄電においては高エネルギー密度化が、発電や物質変換においては高い反応性をもたらすことが期待でき、応用の観点からH–は魅力的な電荷担体といえます。小林准教授の研究グループでは、このH–の電荷担体としての優位性にいち早く着目し、これまでに、初めて固体電解質としての機能を示したH–導電体La 2–x–ySrx+yLiH1–x+yO3–y (以下、LSLHO)を報告するなど、精力的に物質開発を進めてきました(2016年にプレスリリース:https://www.ims.ac.jp/news/2016/03/post_99.html)。LSLHOの発見をきっかけに、H–導電体が固体イオニクス※9の新たな研究対象として認知され、現在では、H–導電体の開発競争が活発化してきています。しかし、物質開発は発展途上の段階にあり、H–を活用した新たな電気化学デバイスを創出するためにはH–導電体の高性能化が必要不可欠です。
研究の成果
今回開発したBLHOは、既報のH–導電体Sr2LiH3O (LSLHO: x = 0, y = 2)のSrをBaで置換した物質に相当し、LSLHOと同じK2NiF4型の層状構造※10をとりますが、BaとH位置に多量の空孔を含む欠損組成[Ba1.75VBa0.25]Li[H2.7VH0.4O0.9](VBa: Ba空孔、VH: H空孔)である点が大きく異なります。室温~300 ºCでは、BaとVBa、LiX6 (X = H–, O2–)八面体の面内のH–とVH、八面体頂点位置のH–とO2–が規則化した超格子を形成しています(β-BLHO)(図1)。このβ-BLHO における三種の長距離秩序は、温度上昇に伴って無秩序化し、300 ºC でBa/VBaと面内のH/VH、350 ºCで頂点位置におけるH/Oの秩序が逐次的に解消されます(300 ≤ T < 350 ºC: γ-BLHO、T ≥ 350 ºC: δ-BLHO)。このBLHOの結晶構造と相転移挙動は、大強度陽子加速器施設J-PARC※11に設置された中性子回折装置SPICAとNOVAで実施した粉末中性子回折測定※12と、大型放射光施設SPring-8※13のBL02B2で実施した放射光X線回折測定から明らかにしました。
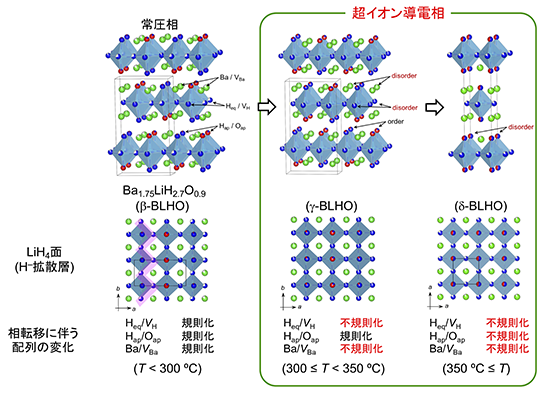
図1 Ba1.75LiH2.7O0.9の結晶構造と相転移挙動。結晶構造中の青球、赤球、緑球、水色球、白はそれぞれH、O、Ba、Li、空孔に相当。
BLHOのイオン導電率の温度依存性を交流インピーダンス法※14で評価すると、図2に示すように、β相からγ相への相転移温度に相当する300 ºC付近から導電率が1,000倍程度上昇し、固体電解質としての実用性能の指標である10–2 S/cmに達することが分かりました。LSLHOのようなLiが八面体中心を占有するK2NiF4型構造のH–導電性酸水素化物では、LiH4面でH–が空孔を介して二次元拡散することが理論的に支持されており、同じ骨格構造を有するBLHOも同様のH–拡散機構をとることが予想されます。BLHOのβ-γ転移は、H–拡散層内で局在化していたVHが非局在化したことを意味しており、これが導電率の急激な上昇に主に関与したと考えられます。さらに、特筆すべきは、相転移後に導電率がほぼ温度依存性を示さなくなったことであり、H–が極めて低い活性化エネルギーで高速拡散していることを示しています。このような導電特性を示す物質は超イオン導電体と呼ばれ、結晶格子内でイオンが液体のように集団運動している状態と考えられています。従って、BLHOはH–超イオン導電体であり、γ-,δ-相では、H–の集団運動が生じていることが示唆されます。なお、観測された導電率がH–の拡散由来であることは、水素濃淡電池による起電力測定※15と、ラウエ・ランジュバン研究所で実施した中性子準弾性散乱測定※16から確認しました。
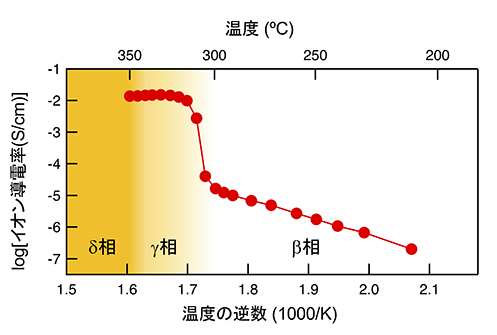
図2. Ba1.75LiH2.7O0.9のイオン導電率の温度依存性
今後の展開・この研究の社会的意義
本研究を通して、H–超イオン導電性を示す固体電解質材料を初めて創出することができました。実用性能の基準である10–2 S/cm以上の導電率が中温域で達成できたことは、H–導電体の研究が、電気化学デバイスへの応用を検討する新たなステージに進んだことを示唆しています。H–導電を活用した電気化学反応による物質変換や水素貯蔵などへの応用を目指し、デバイス設計や要素技術の開発を産学連携等も活用しながら取り組んでいきたいと考えています。H–導電体の物質探索においては、BLHOの超イオン導電相(γ-,δ-BLHO)を低温まで安定化させ、より広い温度範囲で作動する固体電解質材料の創出を目指すと共に、焼結性、電気化学的安定性など、固体電解質としての性能をより多角的に検証していきます。
用語解説
※1 ヒドリドイオン
水素原子が電子を一つ受けとり、アニオン(陰イオン)となった状態。ヘリウムと同じ電子配置をとり1s軌道内を2つの電子が占有する。
※2 超イオン導電体
固体中をイオンがあたかも液体のように動き回る物質の総称。担体となるイオンの拡散は、個別のジャンププロセスではなく、イオン間で相互作用しながら集団運動していると考えられている。10–3以上の導電率と30 kJ/mol以下の活性化エネルギーを兼ねそなえた物質が多い。現在、室温で超イオン導電性が得られるイオンはAg+、Cu+、Li+、Na+、F–に限られる(H+は単体では拡散が遅いが、水を介してH3O+として高速拡散できる)。
※3 イオン導電体
イオンが拡散することで電気伝導が生じる物質。固体電解質には電気伝導にイオンのみが寄与する物質が用いられるのに対し、電極材料には電子とイオンが同時に伝導する混合導電体が用いられることが多い。
※4 電荷担体
電気伝導の担い手。金属では電子、半導体では電子とホール、イオン導電体ではイオンが拡散することで電気が流れる。
※5 酸水素化物
結晶格子内に酸化物イオン(O2–)とヒドリド(H–)が共存する物質。酸化物イオンとの共有結合により水酸化物イオン(OH–)として格子間を占有することの多いプロトン(H+)と異なり、H–は酸化物イオンと同様に陰イオン位置を占有する。
※6 高圧合成法
原料を圧力媒体内に密閉してGPa(ギガパスカル:1GPaが1万気圧に相当)オーダーの高圧下で熱処理する合成法。高圧相の合成や、水素やリチウムのように揮発性の高い元素を反応系内に留めることができるため、酸水素化物の合成に適している。
※7 構造相転移
物質の有する結晶構造が温度や圧力などの外的要因によって異なる対称性の構造に変化する現象。
※8 酸化還元電位
標準酸化還元反応における電子授受に必要な電位。水素標準電極(SHE:2H+ + 2e– = H2)に対してプラス側に大きな電位を持つ物質を貴な物質、マイナス側に大きな電位を持つものを卑な物質とする。電子の放出または受取りやすさの定量的な尺度でもあり、マイナス側に大きいほど(卑な物質)電子供与性が強い。ヒドリドでのH2 + 2e– = 2H–の酸化還元電位は、水素標準電極に対して–2.25 Vの電位である。リチウム二次電池に用いられているLi、次世代二次電池への検討がなされているマグネシウム(Mg)の酸化還元電位は–3.04 Vと–2.38 Vであり、H–はMgと同程度の標準酸化還元電位をもつ。
※9 固体イオニクス
固体内のイオンの動きを研究する学問分野。高いイオン導電率を持ついわゆる固体電解質やイオン・電子混合導電体を対象とし、それらについての基礎研究と利用技術の開発が中心課題となっている。
※10 K2NiF4型構造
陽イオンが陰イオンと6配位8面体を構成しているペロブスカイト型構造と岩塩型構造が一層ずつ積層した構造。イオン導電体、超伝導体、磁性体など、さまざまな物性を示す物質が発見されている結晶構造。
※11 大強度陽子加速器施設J-PARC
高エネルギー加速器研究機構と日本原子力研究開発機構が共同で茨城県東海村に建設した大強度陽子加速器施設と利用施設群の総称。加速した陽子を原子核標的に衝突させることにより発生する中性子、ミュオン、中間子、ニュートリノなどの二次粒子を用いて、物質、生命科学、原子核、素粒子物理学などの最先端学術研究及び産業利用がおこなわれている。
※12 中性子回折測定
中性子線の回折を利用して物質の結晶構造や磁気構造を調べる測定。X線回折ではX線が外殻電子によって散乱するのに対し、中性子回折では、原子核が散乱に関与する。このため、X線では検出しにくい水素やリチウムなどの軽元素の情報を得るのに適している。本研究では、中性子回折を用いてBLHOに含まれる水素濃度と結晶格子内の水素の位置を決定した。
※13 大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出すことができる大型放射光施設。放射光とは、電子を光速に近い速度まで加速し、電磁石によって進行方向を曲げた時に発生する、強力な電磁波のことである。SPring-8では、この放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究がおこなわれている。
※14 交流インピーダンス法
交流電圧を用いたイオン導電率の一般的な測定手法。印加する交流電圧に対する周波数応答の違いを利用し、目的物質の粒内抵抗と粒界抵抗などの成分を分離して求めることが可能。
※15 水素濃淡電池による起電力測定
水素濃度の差によって発生する起電力を利用した電池。理論電圧と実測値を比較することで輸率を見積もることができる。
※16 中性子準弾性散乱測定
中性子ビームを物質の構成原子に当てると、原子に当たった中性子は散乱される。中性子が散乱される際に、エネルギーのやり取りがある場合には、散乱中性子のエネルギーは入射中性子のそれに比べて変化している。このエネルギー変化を伴う中性子の散乱を中性子準弾性散乱という。本研究では、中性子ビームを水素に当て、準弾性散乱された中性子の方向やエネルギー変化を調べることにより、水素の運動の大きさや速さなどを解析した。
論文情報
掲載誌:Nature Materials
論文タイトル:“Hydride-ion-conducting K2NiF4-type Ba-Li oxyhydride solid electrolyte”(K2NiF4型構造を有するBa-Li酸水素化物系ヒドリドイオン導電性固体電解質)
著者:Fumitaka Takeiri1,2, Akihiro Watanabe1,3, Kei Okamoto1,2, Dominic Bresser4,5,6, Sandrine Lyonnard4,7, Bernhard Frick8, Asad Ali1,2, Yumiko Imai1, Masako Nishikawa1, Masao Yonemura9,10, Takashi Saito9,10, Kazutaka Ikeda9,10, Toshiya Otomo9,10, Takashi Kamiyama9,10, Ryoji Kanno3, and Genki Kobayashi1,2
掲載日:2022年1月13日(英国ロンドン時間午後4時)オンライン公開
DOI:10.1038/s41563-021-01175-0
研究グループ
1分子科学研究所 物質分子科学研究領域
2総合研究大学院大学 物理科学研究科 構造分子科学専攻
3東京工業大学 科学技術創成研究院 全固体電池研究センター
4(仏)グルノーブル・アルプス大学
5(独)ヘルムホルツ研究所
6(独)カールスルーエ工科大
7(仏)フランス原子力・代替エネルギー庁
8(仏)ラウエ・ランジュバン研究所 (ILL)
9高エネルギー加速器研究機構 (KEK) 物質構造科学研究所
10総合研究大学院大学 高エネルギー加速器科学研究科
研究サポート
• JSTさきがけ「新物質科学と元素戦略」(JPMJPR1295)
• NEDO エネルギー・環境新技術先導研究プログラム (16823906)
• 文部科学省科学研究費助成事業新学術領域「ハイドロジェノミクス:高次水素機能による革新的材料・デバイス・反応プロセスの創成」(18H05516, 18H05518)
• 文部科学省科学研究費助成事業新学術領域「複合アニオン化合物の創製と新機能」(17H05492, 19H04710)
• 日本学術振興会 科学研究費補助金 (15H05497, 17H06145, 20H02828)
• 中性子共同利用S1型実験課題(2014S06, 2014S10, 2019S10)
• SPring-8実験課題 (2016A1673, 2016B1767, 2018B1099)
• ラウエ・ランジュバン研究所 実験課題(http://doi.ill.fr/10.5291/ILL-DATA.7-03-144)
研究に関するお問い合わせ先
小林玄器(こばやしげんき)
分子科学研究所 准教授
報道担当
自然科学研究機構・分子科学研究所 研究力強化戦略室 広報担当
東京工業大学 総務部 広報課
大学共同利用機関法人高エネルギー加速器研究機構 広報室
J-PARCセンター 広報セクション