放射線の当たり方が一様でない場合、従来の単純な予測は当てはまらない
2019-10-01 量子科学技術研究開発機構
発表のポイント
- マウス精巣に対してX線を微細なストライプ状に照射すると、均一に照射した場合では起こらない組織機能の回復が生じ、放射線影響が軽減されることを発見した。
- そのメカニズムとして、X線が直接当たらなかった精子形成細胞が移動することによって、組織全体としての機能がカバーされることをイメージング実験によって示した。
- 本研究により、空間的に不均一に放射線が当たる場合には、「生体器官のダメージは線量に応じて増加する」という従来のモデルが当てはまらないことを実験的に証明した。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という)量子生命科学領域の神長輝一博士研究員、横谷明徳量子細胞システム研究グループリーダー及び英国Queen’s University Belfastの福永久典博士課程大学院生(現:医療法人 沖縄徳洲会湘南鎌倉総合病院放射線科)、Kevin M. Prise教授らは、公立大学法人横浜市立大学の小川毅彦教授、大学共同利用機関法人高エネルギー加速器研究機構物質構造科学研究所の宇佐美徳子講師らとともに、放射光X線マイクロビーム技術とマウス精巣器官培養法を組み合わせて、空間的に不均一に放射線を当てた場合には組織機能の回復が生じ、放射線量から単純に予測されるよりも影響が軽減されること、さらにそのメカニズムとして放射線の直接当たらなかった細胞の移動が起きていることを実験的に証明しました。
従来、生体器官への放射線の影響は、放射線の量(線量)に応じてその度合いが大きくなるというモデルで説明されてきました。そこには「器官全体が一様に影響を受ける」という暗黙の前提がありますが、医療放射線も含め私たちが日常浴びる放射線は、地面に落ちた雨粒の跡と同様に、身体の中に当たる細胞と当たらない細胞が混在しているのが普通で、それほど単純ではないはずです。そこで本研究では、高度な量子ビーム制御技術により微細なストライプ状にしたX線を、細胞の生死や成熟の様子が蛍光観察できるようにしたマウス精巣に照射し、顕微鏡下でその影響を解析しました。その結果、X線が当たっていない微細な領域の細胞が移動し、組織全体の能力をカバーする現象が起きていることを発見しました。
この結果は、従来の「用量(線量)―反応モデル」の限界を示すもので、今後、より精緻な放射線影響の予測法の確立に貢献し、将来的には放射線治療における副作用の低減などにもつながることが期待されます。
この研究成果は、生物学・医療分野でインパクトの大きい論文が数多く発表されている英国の総合科学誌「Scientific Reports」2019年10月1日号に掲載されます。
この成果は、文部科学省科学研究費補助金基盤研究(B) (No.16KT0079)、一般財団法人丸文財団 交流研究助成事業、公益財団法人放射線影響協会 研究奨励助成金、Department of Health UK (Ref 091/0205) を受けて行われたものです。
研究開発の背景と目的
医療放射線も含め私たちが日常浴びる放射線の多くは低線量、低線量率ですが、これらの放射線被ばくの影響については未だ不明な点が多く、ことそのメカニズムに関しては、科学的な検証が未だ乏しいのが実情です。とくに、放射線が生体に与えるエネルギーの量の増加に応じてその影響も増大するという、従来の「用量(放射線の場合は線量)―反応モデル」に従わない現象が見出されています。この理由として、私たちは、現実には放射線の細胞への「当たり方(ヒットと呼びます)」があたかも地面の上の雨粒のようにランダムな確率事象であることに起因すると考えました。空間的に不均一なヒットであるために、すべての細胞が一様にエネルギーを受けているのではなく、一部の細胞のみが偏ってエネルギーを受けているため、生き残った細胞が死んだ細胞を代償する「組織代償効果」が起きている可能性があります。
しかし、この現象を実験的に検証することは困難でした。なぜなら、空間的に不均一なエネルギー付与を生物器官に対して精密・正確に行い、さらにその生物学的な効果を測定することは、高度にコントロールされた照射技術[1]と器官培養技術が必須であるためです。今回、放射光X線マイクロビーム装置を利用した微細なストライプ状の照射と、細胞の生死と分化・成熟の様子を総合的に評価することができる実験系であるマウス精巣の器官培養法を組み合わせることで、不均一なX線照射が精子形成能に与える影響を評価することに挑戦しました。
研究の手法と成果
シンクロトロン加速器から得られる指向性(光線の拡がりにくさ)の高い放射光X線の特性を巧みに利用することで、放射線の照射範囲をマイクロメートルオーダーで自由自在に操作することができます。研究チームはこれまで、高エネルギー加速器研究機構フォトンファクトリーの放射光X線マイクロビーム1)装置を利用し、細胞集団内の一部、あるいは一細胞内の特定部位にのみ放射線を照射し、照射部位および非照射部位におけるその後の生物学的変化をリアルタイムに解析するという実験手法を開発してきました[2,3]。
我々の研究グループの一員である小川毅彦教授らは、2011年に「精巣器官培養法」によるマウス精子形成系2)(Acr-GFPトランスジェニックマウス)[4]を世界で初めて開発しました。このマウスでは、精子形成過程の途上で発現するアクロシン(Acr)というタンパク質が緑色蛍光タンパク質(Green Fluorescence Protein、以下GFP)を融合した状態で発現します。このため、蛍光顕微鏡下で緑色蛍光を観察することで、精子形成に至る細胞の成熟の過程を生きた状態でリアルタイムに解析できます。
今回、我々はこの二つの技術を組み合わせて[5]、実験を行いました。7日齢の雄マウスから精巣を摘出し、1 mm3程度の大きさのブロックに切り分けた後1.5%アガロースゲル上で培養しました。翌日にこの試料に対して5.35 keV放射光X線マイクロビームを照射しました。その際、マイクロビーム照射範囲をストライプ状にして、精巣組織の体積の約50%に集中して5 Gy(Gy(グレイ):組織重量当たりに放射線から受け取るエネルギーの大きさを表す単位)のX線を照射した場合(すなわち組織全体で平均すると2.5 Gy相当)と、2.5 GyのX線を全体に均一に照射した場合の、二つのパターンを検討しました。
その後のGFP発現の変化を蛍光顕微鏡下でリアルタイムに解析し、比較したところ、ストライプ状に照射した場合には、GFPの発現が非照射サンプルと同様(=精子形成能有り)であったのに対し、全体に均一に照射した場合にはGFPの発現をほとんど検出できず、精子形成能が失われたことが示唆されました(図1)。
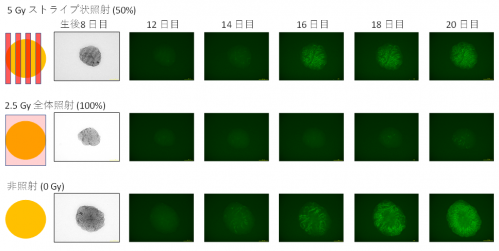
図1. ストライプ状マイクロビーム照射後の精子形成
200㎛間隔で5 Gyをストライプ状に照射したサンプル(上段)と、2.5 Gyを全体に照射したサンプル(中段)では、どちらも組織全体としては2.5 Gy相当の放射線被ばくであるものの、その後の精子形成に明らかな違いが顕微鏡下で観察された。生後12日目以降の写真中の緑色は、精子形成に至る減数分裂期に特異的なタンパク質(Acrosin)を発現している細胞を示す。生後8日目の写真は明視野顕微鏡撮影したもの。ストライプ状に照射した組織試料では、損傷領域が縞状の色の濃い部位として確認できる。
ストライプ状照射と均一照射では、器官レベルでは同じ2.5 Gy相当の放射線被ばくであるのに、ミクロな空間スケールでは放射線によるエネルギー付与の分布が明らかに異なっています。本研究成果は、このような線量分布の差異によって、「組織代償効果3)」が生じて器官としての機能が温存されるという現象を、実際の生きた状態の生体試料を用いて初めて可視化したものです。
本研究では、ストライプ状照射でX線が当たっている部位においても次第に緑色蛍光が現れてきた事実から、放射線が照射されていない部分(正常部分)にある精子形成細胞が、精細管を介して放射線が照射された部分(損傷部分)に移動して、精巣組織全体の精子形成能を修復・保全している可能性を見出しました(図2)。すなわち、組織代償効果のメカニズムとして、精子形成細胞の移動が起こることにより組織修復が起こる可能性を示唆しています。
この二つの実験結果は、低線量または低線量率の宇宙放射線や環境放射線の被ばく影響や、放射線治療時の周辺組織への影響など、しばしば見られる空間的に不均一な放射線照射がもたらす影響について考察する場合、従来の線量依存的な「用量―反応モデル」では説明できない現象が起こることを示しています。
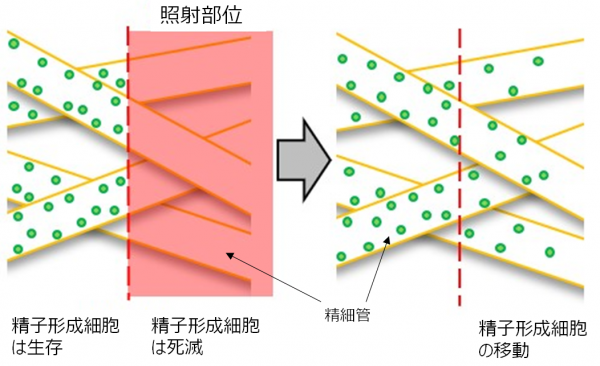
図2. 不均一な放射線被ばく後の精巣における精子形成細胞の移動(モデル)
不均一な放射線被ばく後、放射線がヒットしていない部分(正常部分)から放射線がヒットした部分(損傷部分)へ、精子形成細胞が精細管を伝って移動する。そして、損傷部分で増殖、分化して、精子形成能を修復・保存する。
今後の展望
本研究では、不均一照射された精巣で組織代償効果による機能維持が起こることを初めて見出しましたが、精子形成細胞の移動がなぜ起こるのかという分子メカニズムは明らかになっていません。「用量―反応モデル」に必ずしも一致しない、何か潜在的な生体反応がある可能性も示唆されます[6]。今後、様々な条件での不均一照射の影響を実験的に検証することにより、放射線生物学的影響の理解と予測がさらに進展すると考えられます。将来的には、放射線治療における有害事象の発生リスクをさらに低減する、新しい放射線治療法の開発につながると期待されます。
用語解説
1)放射光X線マイクロビーム
放射光(シンクロトロン放射)とは、真空中で光速に近い速度で直進する電子が、その進行方向を変えられた際に放射する電磁波(光)のことである。この放射光から、電子の進行方向の変化の大きさによって様々な波長の電磁波を取り出すことができ、電波、赤外線、可視光線、紫外線、X線までの幅広い波長領域をカバーする線源にもなる。
さらに、レーザーのような鋭い指向性を持つため、遮蔽力の大きい金属などをスリットとして用いることで、任意の形状のX線マイクロビームを比較的簡便に得ることができる。例えば細胞核を除いた細胞質のみへ照射できるビーム形状も選択でき、これまでに細胞核への照射とそれ以外の細胞質への放射線照射効果が大きく異なることなども報告されている。
2)精巣器官培養法によるマウス精子形成系
我々の研究グループの一員である小川毅彦教授らによって2011年に開発された、ほ乳類で初となるin vitro精子形成系である。このマウス精巣を用いた精巣器官培養法では、雄性生殖幹細胞(精子幹細胞)から精子産生までの完全な精子形成を誘導維持することができる。
3)組織代償効果
組織代償効果(Tissue Sparing Effect)とは、空間的な分割照射によって生じる放射線耐性獲得の現象を意味する。1909年にAlban Köhler博士が、格子状に放射線源を配置して空間的な分割照射を行うという格子放射線治療(grid radiotherapy)により、世界で初めて組織代償効果の臨床観察を報告した。組織代償効果は臨床条件だけでなく、環境放射線などによる不均一な被ばく後の生物学的影響においても重要であると考えられている。
掲載論文情報
タイトル:High-precision microbeam radiotherapy reveals testicular tissue-sparing effects for male fertility preservation
雑誌名:Scientific Reports(オンライン版 10月 1 日) 著者名:Hisanori Fukunaga, Kiichi Kaminaga, Takuya Sato, Karl T. Butterworth, Ritsuko Watanabe, Noriko Usami, Takehiko Ogawa, Akinari Yokoya, & Kevin M. Prise.
参考文献
1. Prise KM, Schettino G. Microbeams in radiation biology: review and critical comparison. Radiat Prot Dosimetry 2011;143:335–9.
2. Narita A, Kaminaga K, Yokoya A, Noguchi M, Kobayashi K, Usami N, et al. Real-time observation of irradiated HeLa-cell modified by fluorescent ubiquitination-based cell-cycle indicator using synchrotron X-ray microbeam. Radiat Prot Dosimetry 2015;166:192–6.
3. Kaminaga K, Noguchi M, Narita A, Hattori Y, Usami N, Yokoya A. Cell cycle tracking for irradiated and unirradiated bystander cells in a single colony with exposure to a soft X-ray microbeam. Int J Radiat Biol 2016;92:739–44.
4. Sato T, Katagiri K, Gohbara A, Inoue K, Ogonuki N, Ogura A, Kubota Y, Ogawa T. In vitro production of functional sperm in cultured neonatal mouse testes. Nature 2011;471:504–7.
5. Fukunaga H, Kaminaga K, Sato T, Usami N, Watanabe R, Butterworth KT, et al. Application of an Ex Vivo Tissue Model to Investigate Radiobiological Effects on Spermatogenesis. Radiat Res 2018;189:661–7.
6. Fukunaga H, Prise KM. Non-uniform radiation-induced biological responses at the tissue level involved in the health risk of environmental radiation: a radiobiological hypothesis. Environ Heal. 2018;17:93.