サルファーフリー燃料ほか有用物合成に威力
2018/07/09 東京工業大学 科学技術振興機構(JST)
ポイント
- 化学工業において重要な選択酸化反応では、酸素分子のみを用いた環境調和型の触媒プロセスの開発が切望。
- ルテニウムを含むペロブスカイト触媒を独自手法で合成。低温・高効率で硫黄化合物を酸化、有用物の合成に成功。
- スケールアップ可能で再利用が容易な固体触媒として、広範な応用に期待。
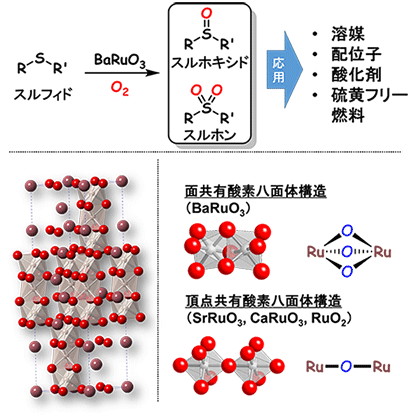
東京工業大学 科学技術創成研究院フロンティア材料研究所の原 亨和 教授、鎌田 慶吾 准教授と元素戦略研究センターの熊谷 悠 特任准教授、フロンティア材料研究所の大場 史康 教授らは、ルテニウム酸バリウム(BaRuO3)菱面体晶ペロブスカイト注1)触媒が、硫黄化合物のスルフィド注2)から酸素分子(O2)のみを酸素源として有用なスルホキシドやスルホン注2)を合成できることを発見した。
酸素分子のみを酸化剤とする選択酸化反応は高難度反応の1つであり、新しい固体触媒の設計と開発が切望されている。原教授らは、実験と理論計算による反応機構を検討し、BaRuO3触媒中の近接する2つのルテニウムを架橋する酸素原子(面共有酸素八面体構造注3))が酸化反応に寄与し、温和な条件でも高い触媒性能が発現することを明らかにした。この研究成果は複合酸化物中の反応性の高い特異な酸素原子の活用が高効率酸化反応開発の有用な手法であることを示している。
従来の合成手法では、望みの組成と大きな表面積を併せ持つペロブスカイト型酸化物触媒を合成することは困難とされていた。原教授らが独自開発したゾルゲル法注4)により、大きな表面積を持つBaRuO3ナノ粒子を合成でき、温和な条件下においても高い触媒性能を発現させることに成功した。
研究成果は2018年7月9日(日本時間16時)に米国科学誌「ACS Applied Materials & Interfaces」オンライン速報版で公開される。
本成果は、以下の事業・研究領域・研究課題によって得られました。
JST 戦略的創造研究推進事業 個人型研究(さきがけ)
研究領域:「革新的触媒の科学と創製」(研究総括:北川 宏 京都大学 教授)
研究課題名:「低級炭化水素の選択的酸化アップグレーディングを目指した金属酸化物触媒の創製」
研究代表者:鎌田 慶吾(東京工業大学 科学技術創成研究院 フロンティア材料研究所)
研究実施場所:東京工業大学
研究期間:平成27年12月~平成31年3月
<背景と研究の経緯>
化学プロセスの3割を占める選択酸化反応は、汎用化成品・プラスチックや医薬品原料などの高付加価値製品の製造において重要な反応である。毒性が高く、廃棄物を大量に副生する酸化剤を用いたプロセスとは大きく異なり、酸素分子のみを酸化剤とした選択酸化反応は最も理想的な反応である。しかしながら、反応制御において今なお多くの課題を抱えている高難度反応の1つであり、温和な条件で選択的に原料を酸化できる新しい触媒の開発が急務となっている。
スルフィドを酸化して得られるスルホキシドやスルホンは、生合成における中間体、不斉反応での配位子、酸素ドナーとして有用な有機硫黄化合物である。しかし、不活性な芳香族スルフィド類を、添加物を用いず酸素分子のみを酸化剤として選択酸化反応させる固体触媒の報告例はほとんどなかった。
このような研究背景のもと、構成元素により化学的性質を制御できるペロブスカイト型酸化物が優れた酸化触媒として機能すると考えた。原教授らが独自に開発したゾルゲル法を用いることで、従来合成法の問題点であった低い表面積・元素適用性を解決することに成功した。ペロブスカイト型酸化物は、電気化学反応、光触媒反応、高温での気相反応の触媒としては研究されているが、環境調和型反応を含む液相反応への応用研究例はほとんどなかった。BaRuO3触媒は、これまでに硫黄化合物の選択酸化反応を含む液相反応における固体触媒としての利用はなく、今回の研究が初めての報告例となる。
<研究の成果>
東工大の原教授らは、リンゴ酸注5)を用いたゾルゲル法により得られた菱面体晶構造を持つペロブスカイト酸化物(BaRuO3)のナノ粒子が、従来の固体触媒や他のルテニウム酸化物触媒とは異なり、硫黄化合物であるスルフィドの酸化反応を極めて温和な条件で促進する固体触媒として機能することを発見した(図1上)。固体触媒のため、反応後の触媒をろ過により容易に分離回収でき、活性や選択性に変化なく再利用できる。
X線回折を用いた構造解析から、BaRuO3は近接したルテニウムが酸素原子3つで架橋された面共有酸素八面体構造を持っていることが分かった(図1左下)。一方、他のルテニウム酸化物(SrRuO3、CaRuO3、RuO2)では、近接したルテニウムが酸素原子1つで架橋された頂点共有酸素八面体構造注3)のみを持っている(図1右下)。また、ゾルゲル法で合成したBaRuO3は従来の合成法よりも大きい比表面積を持ち、走査型電子顕微鏡を用いたBaRuO3の観察からも20–50ナノメートル(nm)程度のナノ粒子の集合体であることが分かった。
種々の触媒を用いたチオアニソール注6)の酸化反応結果を表1に示す。ペロブスカイト型酸化物ARuO3(A=Ca、Sr、Ba)の中でも、面共有酸素八面体構造を持つBaRuO3が最も高い活性を示した。ルテニウムの単純酸化物や原料である塩は不活性であった。またBaRuO3は、酸化反応に有効なマンガン系酸化物よりも表面積が小さいにも関わらず高い活性を示した。特に、40℃という温和な条件下においてスルホキシドへの酸化反応が効率的に進行し、従来の固体触媒では高い反応温度(100–150℃)を必要とするのと比較してプロセスの低エネルギー化に成功した。
詳細な反応機構の検討から、BaRuO3中の酸素原子が直接スルフィドと反応して酸化反応が進行することが分かった。そこで、各ルテニウム酸化物について第一原理計算注7)を用いて結晶構造内の酸素の空孔形成エネルギー注8)を算出したところ、BaRuO3の面共有酸素八面体構造の酸素が最も空孔になりやすい(=反応しやすい)ことが分かった。また、金属Ruへの還元反応のエネルギー変化はBaRuO3が最も小さいことが分かった。これらの結果は、BaRuO3中の酸素原子が最も反応しやすく、酸素分子により再び活性な酸化状態に戻りやすいことを示しており、このような性質を持つBaRuO3が本反応において従来触媒とは異なる役割を果たしていることが分かった。
BaRuO3の酸化触媒能は、種々の原料(基質)を用いたスルフィドの酸化反応に適用できる。芳香族および脂肪族スルフィド化合物の選択酸化反応を効率的に促進する触媒として機能し、10種の化合物合成に適用できた。また、大きなスケールでの反応にも応用できるため、対応する生成物をグラムスケールで単離回収することができる。水素化脱硫注9)が困難なジベンゾチオフェンの酸化反応では、対応するスルホンを高収率で得られることが分かった(図2)。
<今後の展開>
BaRuO3触媒は、さまざまなスルホキシド・スルホン化合物合成に適用できる優れた固体触媒として機能し、得られた生成物は、溶媒、ファインケミカル(高付加価値の化学物質)、配位子、サルファーフリー燃料など広範な製品への応用が期待される。
今回の結果は、錯体や金属塩では合成困難な特異構造(高原子価金属からなる面共有酸素八面体構造)を持つ固体触媒の開発が重要であることを示している。今後、本アプローチを他の複合酸化物触媒にも応用することで、さらなる活性向上や他の反応への展開が可能となり、温和な条件下での高効率触媒反応開発に大きく貢献することが期待できる。
<付記>
本研究成果はJSPS(日本学術振興会)の基盤研究(B)研究開発課題「セラミックス材料の構造制御に立脚した高機能選択酸化触媒の開発」(研究代表者:鎌田 慶吾 研究開発期間:平成27年4月~平成30年3月)の一環として行われました。
<参考図>
![]()
図1
(上)酸素分子のみを酸化剤としたBaRuO3によるスルフィドの選択酸化反応。
(左下)BaRuO3の構造(紫色、灰色、赤色の球はそれぞれバリウム、ルテニウム、酸素原子を示している)。
(右下)面共有酸素八面体構造と頂点共有酸素八面体構造の模式図。
![]()
| 触媒 | 比表面積 (m2g–1) | 収率 (%) | 選択率 (%) | |
| スルホキシド | スルホン | |||
| BaRuO3 | 25 | 73 | 79 | 21 |
| BaRuO3b | 25 | 92 | 84 | 16 |
| SrRuO3 | 25 | 42 | 90 | 10 |
| CaRuO3 | 4 | 3 | >99 | <1 |
| RuO2 | 18 | 9 | 95 | 5 |
| 酢酸ルテニウム | – | 3 | >99 | <1 |
| MnO2 | 122 | 23 | >99 | <1 |
| なし | – | <1 | – | – |
a反応条件: 触媒 (50 mg), チオアニソール (0.25 mmol),溶媒 t-BuOH (1 mL), O2圧力 (1気圧), 60 ℃, 10 h. bBaRuO3は40℃という温和な条件で酸化反応を効率的に促進(反応条件:bチオアニソール (0.50 mmol), pO2 (1.0 MPa), 40 ℃, 24 h).
表1 酸素分子のみを酸化剤としたチオアニソールの酸化反応における触媒効果a
![]()
図2 BaRuO3触媒によるジベンゾチオフェンの酸化反応
<用語解説>
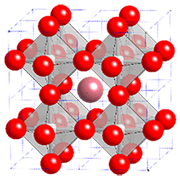
- 注1)ペロブスカイト
- 一般的にABO3という組成式を持つ遷移金属酸化物などの結晶。元素の構成により物理・化学的性質を制御できるため、圧電体、強誘電体、磁性体、超伝導体、触媒などの分野で広く研究されている。理想的には頂点共有酸素八面体構造注3)のBO6の間に12配位のAがある立方晶構造(下図参照)をとるが、Aが大きなアルカリ土類金属イオンの場合に面共有酸素八面体構造注3)を持つ六方晶あるいは菱面体晶構造をとることがある。
- 注2)スルフィド、スルホキシド、スルホン
- スルフィドは–2価の硫黄原子が2個の有機官能基と結合した有機化合物である。スルフィドが酸化され、硫黄原子に酸素原子が1および2個結合したものをそれぞれスルホキシド、スルホンという。スルホキシドやスルホンは、溶媒、ファインケミカル(高付加価値の化学物質)合成の中間体、錯体触媒の配位子、酸化反応の酸素源などとして使われる。(図1参照)
- 注3)面共有酸素八面体構造、頂点共有酸素八面体構造
- 酸素原子6個に囲まれた金属Mは、頂点と中心にそれぞれ酸素と金属を位置させた正八面体MO6で表すことができる。MO6八面体同士が頂点で結合したもの(金属同士が酸素原子1個で架橋)を頂点共有酸素八面体構造、面で結合したもの(金属同士が酸素原子3個で架橋)を頂点共有酸素八面体構造という。
- 注4)ゾルゲル法
- コロイドの一種であるゾルをゲル化する手順を経る、固体材料を液相で調製する手法の1つ。
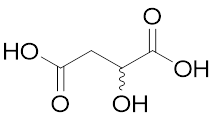
- 注5)リンゴ酸
- ヒドロキシ酸の一種で、以下の構造を持つ。金属酢酸塩と反応させて得られたアモルファス前駆体を焼成することで、高い表面積を持つ多様なペロブスカイトを合成できる。
- 注6)チオアニソール
- 芳香族スルフィドの一種。酸素雰囲気下において触媒を用いなくても酸化反応が進行する脂肪族スルフィドと比較して、一般的に反応性は低い。
- 注7)第一原理計算
- 実験で得られた結果を参照しないで構成元素と構造のみをパラメーターとし、系の電子状態やエネルギーなどを求める計算手法。
- 注8)酸素の空孔形成エネルギー
- 酸化物の結晶構造から酸素原子が酸素分子として抜けて酸素空孔(本来酸素原子がある場所が空の状態)が形成する際のエネルギー変化。
- 注9)水素化脱硫
- 石油製品から不純物として含まれる硫黄を触媒の存在下で水素と反応させ、硫化水素として除去するプロセス。燃料燃焼後に生成する硫黄酸化物による大気汚染を抑制する上で重要である。
<論文情報>
タイトル:Heterogeneously Catalyzed Aerobic Oxidation of Sulfides with a BaRuO3 Nanoperovskite”
著者名:Keigo Kamata, Kosei Sugahara, Yuuki Kato, Satoshi Muratsugu, Yu Kumagai, Fumiyasu Oba, Michikazu Hara
<お問い合わせ先>
<研究に関すること>
鎌田 慶吾(カマタ ケイゴ)
東京工業大学 科学技術創成研究院 フロンティア材料研究所 准教授
<JST事業に関すること>
中村 幹(ナカムラ ツヨシ)
科学技術振興機構 戦略研究推進部
<報道対応>
東京工業大学 広報・社会連携本部 広報・地域連携部門
科学技術振興機構 広報課