2021-04-05 東京大学
山下 恭弘(化学専攻 准教授)
小林 修(化学専攻 教授)
発表のポイント
- 有機反応の中でも最も基本的かつ重要なマンニッヒ反応(注1) において、40年来の懸案であったアミドやエステルを原料として直接用いる触媒的不斉マンニッヒ反応を開発し、光学活性β―アミノ酸誘導体(注2) を効率的に得ることに成功した。
- カリウムヘキサメチルジシラジド(注3) と光学活性なビスオキサゾリン(注4) のカリウム塩からなる、これまでの不斉触媒に比べて高い活性を有する新しい不斉強塩基ハイブリッド触媒系(注5) を用いることにより、目的の反応が高収率にて進行し、高い不斉選択性が得られた。
- 本研究成果は、光学活性β―アミノ酸誘導体の効率的合成法の提供につながるのみでなく、反応性に乏しい原料を用いる、さまざまな触媒的不斉合成(注6)法の開拓につながることが期待される。
発表概要
光学活性化合物(注7)を効率的かつ高選択的に得ることのできる触媒的不斉合成は、医薬品等のファインケミカルズを効率的に合成する重要な方法の一つである。今回、東京大学大学院理学系研究科の小林 修教授らのグループは、医薬品原料である光学活性β―アミノ酸誘導体を合成できる触媒的不斉マンニッヒ反応において新たな高活性触媒系を開発し、有機合成化学において40年来の懸案であった、反応性の非常に乏しいアミドやエステルを予め活性化することなくそのまま原料として用いる反応を実現した。これまでに報告されている触媒では、活性が低いためこれらの原料を用いることは不可能であった。
これまでこの反応でよく用いられてきたアルデヒドやケトンといった反応性の高い原料ではなく、容易に入手可能であるが反応性が乏しいためそのまま用いることが困難なアミドやエステルを原料とする不斉マンニッヒ反応を検討したところ、塩基性が非常に強い化合物であるカリウムヘキサメチルジシラジド(KHMDS)と光学活性なビスオキサゾリンから調製される触媒系を用いることにより、目的の反応が高い不斉選択性(注8)で進行することを見出した。また、有効な触媒種の構築のためには、ビスオキサゾリンに対してKHMDSを過剰量用いるという、従来法とは異なる触媒調製手法が重要であり、新たな触媒系である不斉強塩基ハイブリッド触媒系が生成し、機能していることが明らかになった。本研究は、有機合成化学の中で長年の懸案であった、反応性の非常に乏しいアミドやエステルを原料としてそのまま用いる触媒的不斉マンニッヒ反応を初めて実現した点で、学術的にも非常に重要であると言える。
本研究成果は、「Journal of the American Chemical Society」のオンライン速報版で(日本時間4月5日)に公開された。なお本研究は、国立研究開発法人 日本医療研究開発機構(AMED)、および文部科学省科学研究費新学術領域研究「ハイブリッド触媒」(JP 17H06448)の研究の一環として行われた。
発表内容
研究の背景
医薬品等のファインケミカルズは人類の福祉を維持していくためになくてはならないものであり、その迅速な供給が社会から強く望まれている。そのために、現在石油等の天然資源を原料としてファインケミカルズ を作り出す有機合成が重要視されている。これまでに、多くの化学産業が有機合成によってさまざまな製品を生み出し市場に供給しているが、一方でこのような製品の生産の伴い副生する廃棄物が地球環境に大きな影響を与えることが社会問題になっている。特に、化石燃料の使用による二酸化炭素の放出や、有害な金属を含む廃棄物の発生は地球温暖化や環境汚染を引き起こすことがわかっており、大きな改善が必要とされている。有機合成においてこのような問題を解決する手段として、化学反応を省エネルギーで進行させることができ、かつ廃棄物を少なくすることのできる「触媒」の使用が重要である。その一方で、医薬品等のファインケミカルズ の構造上には、不斉点が存在することが多い。しかし、そのような不斉点の効率的かつ立体選択的な構築は難しく、これまでに多くの廃棄物を副生させながら構築が行われてきた。この問題に対して、不斉点を持つ化合物の高効率的かつ高立体選択的な合成手法として、2001年の野依良治らのノーベル化学賞受賞に代表されるような、高活性な不斉触媒を用いるさまざまな触媒的不斉合成反応が開発され、化学産業でも応用がなされている。
β―アミノ酸誘導体は、医薬品合成にしばしば使われる窒素原子をもつ重要な有機化合物であり、その効率的な合成法の開発が求められている(図1左)。特に光学活性なβ―アミノ酸誘導体の合成法の一つである不斉マンニッヒ反応は、炭素―窒素二重結合を有する化合物であるイミンとカルボニル化合物との間で炭素―炭素結合を形成しつつ、かつ同時にアミノ基の根元に不斉点を高立体選択的に構築できる基本的かつ重要な反応である。この反応は約40年前にカルボニル化合物を予め活性化しておいてマンニッヒ反応を行う手法が報告されて以来、触媒的不斉反応の開発を含めて多くの研究例があるが、事前の活性化に多くの反応剤が別途必要となってしまうため、原子効率性(注9) が低くなってしまう大きな問題があった。そこで、原子効率性の高い、原料のカルボニル化合物を予め活性化することなく使用する不斉マンニッヒ反応の開発が強く望まれていたが、原料として反応性の高いマロン酸エステルやアルデヒド、ケトン等を用いる反応が多数報告されている一方で、β―アミノ酸誘導体を直接的に合成できる入手容易なアミドやエステルを原料としてそのまま用いる不斉マンニッヒ反応は、従来の触媒では活性が低くこれまで実現が非常に困難であった(図1右)。
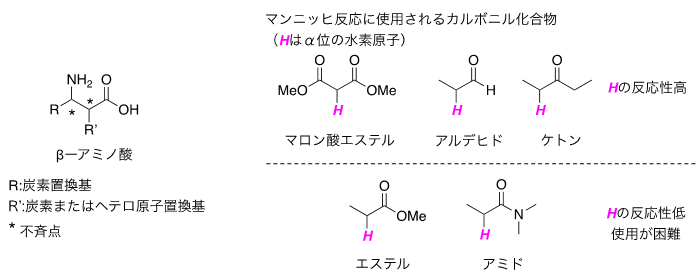
図1:β―アミノ酸と反応原料となるカルボニル化合物
研究内容
窒素原子上に置換基をもつイミンと市販品であるN,N-ジメチルプロピオンアミドを原料とし、不斉塩基触媒を用いた反応開発を行った。N,N-ジメチルプロピオンアミドは反応点上に存在する水素原子の酸性度が非常に低いため、一般に用いられている塩基触媒では脱プロトン化(注10) 反応を行ってアニオン性活性種を発生させることが困難であった。そこで、そのような反応性の低い原料を活性化するために、より強力な反応性をもつカリウム強塩基であるカリウムヘキサメチルジシラジド(KHMDS)を触媒として用い、かつ触媒的な反応を実現するために、イミンの窒素原子上に保護基として電子豊富な芳香環を導入して検討を行なった。カリウム塩基触媒を不斉修飾するための不斉配位子を種々検討したところ、これまでに頻繁に用いられてきた光学活性なクラウンエーテル(注11)はほとんど機能しない一方で、さまざまな金属に対してよく用いられる不斉配位子である光学活性なビスオキサゾリンが有効に機能することを発見した。さらに、有効な触媒種の構築のためには、ビスオキサゾリンに対してKHMDSを過剰量用いることが重要であることが判明した。従来の光学活性カリウム強塩基触媒の構築法では、不斉配位子に対してカリウム強塩基触媒をほぼ同じ量用いることが重要であったが、今回の触媒ではカリウム強塩基が不斉配位子に対して過剰量必要であることが大きな特徴である。最適条件で、さまざまなイミンとアミドやエステルを用いて反応を行なった結果、高い不斉選択性が発現することを明らかにした(図2)。また、本手法を使ってコレステロール吸収阻害活性を有するβ―ラクタム化合物であるSCH-48462を効率的に合成することができた。
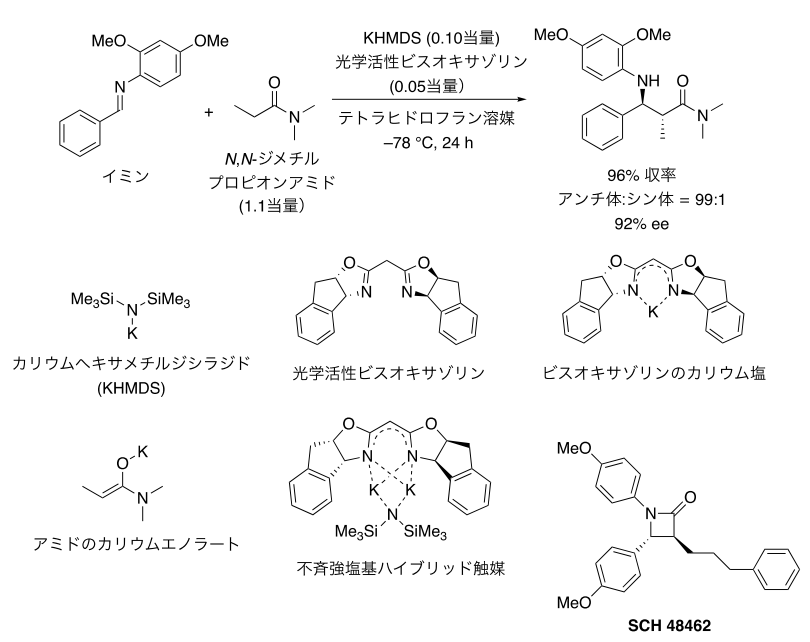
図2:反応性の乏しいアミドを直接用いる触媒的不斉マンニッヒ反応
本触媒系は、ビスオキサゾリンに対してカリウム強塩基を倍量以上用いることが必要であり、従来の強塩基触媒とは異なるものであった。そこで、核磁気共鳴(NMR)分光法や計算化学的手法によりその構造の解明を行なったところ、はじめにビスオキサゾリンがKHMDSによって脱プロトン化されてそのカリウム塩が生成し、さらに、そのカリウム塩が不斉配位子として別のKHMDSと相互作用して不斉強塩基ハイブリッド触媒系を形成することがわかった。この反応ではこの新たな触媒系が原料であるアミドを脱プロトン化してアミドのカリウムエノラート(注12)が発生し、それとイミンが反応して目的物が生成していることが判明した。さらに、その詳しい構造について計算化学による解明を試み、ビスオキサゾリンの二つの窒素原子の間に二つのカリウムイオンが均等に収まるようなこれまでにない特殊な構造(図3)をとっている可能性が示唆された。
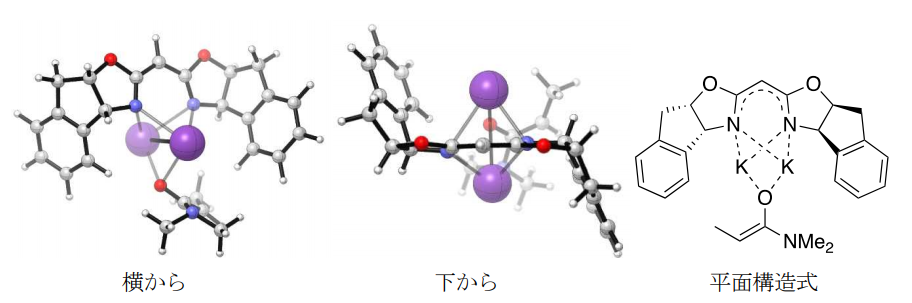
図3:計算化学によって示されたビスオキサゾリンのカリウム塩とカリウムエノラートからなるハイブリッド型反応活性種の構造
本研究は、有機合成化学の中で長年課題となっていた、実現が極めて困難であった反応性の乏しいアミドを原料のカルボニル化合物としてそのまま用いる触媒的不斉マンニッヒ反応を初めて実現した点で、学術的にも非常に重要であると言える。
今後の展開
本研究で得られた成果により、反応点上に存在する水素原子の酸性度が非常に低い地球上に豊富に存在する原料を用いる、さまざまな触媒的不斉合成反応の開拓につながることが期待される。
発表雑誌
- 雑誌名
Journal of the American Chemical Society論文タイトル
Chiral Metal Salts as Ligands for Catalytic Asymmetric Mannich Reactions with Simple Amides著者
Yasuhiro Yamashita*, Aika Noguchi, Seiya Fushimi, Miho Hatanaka and Shū Kobayashi*DOI番号
10.1021/jacs.0c13317
用語解説
注1 マンニッヒ反応
炭素―窒素二重結合をもつイミンと呼ばれる化合物とアルデヒドやケトン等のカルボニル化合物との間で起こる反応。イミンの二重結合に含まれる炭素原子とカルボニル化合物のカルボニル基の隣(α位)の炭素原子とが反応して炭素―炭素単結合ができると同時に、イミンの炭素―窒素二重結合が単結合に変化する。その際、反応した炭素上に不斉点が生まれる。この不斉点の立体を制御して片方の鏡像異性体を選択的に得る反応を不斉マンニッヒ反応という。
注2 β―アミノ酸誘導体
一般的に知られているアミノ酸(α―アミノ酸)よりもアミノ基とカルボニル基の間が一炭素原子分長いアミノ酸の誘導体。ここではβ―アミノアミドやβ―アミノエステルを指す。
注3 カリウムへキサメチルジシラジド (KHMDS)
カリウムイオンを有する強塩基。カリウム-窒素結合もち、その窒素原子上には二つのケイ素置換基が存在する。この窒素原子が強い塩基性を示す。
注4 ビスオキサゾリン
オキサゾリンと呼ばれるヘテロ環が一炭素原子を介して二つつながっている構造。そのヘテロ環上に存在する窒素原子が金属原子と強く相互作用できる。
注5 ハイブリッド触媒系
独立した機能を持つ複数の触媒(あるいは触媒部位)の働きを重奏的に活かした触媒系。ここでは光学活性な金属塩触媒と強塩基触媒とがハイブリッドした触媒系のことを指す。
注6 触媒的不斉合成
わずかな不斉源(不斉配位子)を用いて理論的に無限の片方の鏡像異性体を合成する手法。野依良治らが2001年にノーベル化学賞を受賞している。鏡像異性体とは、鏡に映した像が元の像と重なり合わない関係(右手と左手の関係)にある分子構造を持つ分子のこと。
注7 光学活性化合物
不斉点をもつ化合物の二つの鏡像異性体のうち、片方の異性体が過剰に存在している状況の化合物。
注8 不斉選択性
片方の鏡像異性体をどれだけ優先的(選択的)に得られたかを示す値。光学収率(enantiomeric excess, ee(%))で表す。両鏡像体の比率が99:1の場合、98% eeとなる。
注9 原子効率性
反応で用いた原料に含まれる原子うち、どのくらいの割合の原子が生成物に含まれたかを示す値。原料中の原子の生成物に取り込まれる割合が高いほど原子効率が高いという。生成物に取り込まれなかった原子は廃棄物となる。
注10 脱プロトン化
炭素―水素結合の水素原子をプロトン(H+)として除く反応。残された炭素原子はアニオン性(負電荷)を帯びる。
注11 クラウンエーテル
複数の酸素原子が構造上に規則正しく存在する環状のエーテル化合物。
注12 カリウムエノラート
カルボニル化合物のカルボニル基の隣(α位)の炭素原子上の水素原子がカリウム塩基によって脱プロトン化をされて生成する反応性の高い化学種。生成する負電荷はカルボニル基由来の酸素原子上に主に存在し、カルボニル炭素とα位の炭素原子の結合が二重結合性を帯びる。カリウムイオンは酸素原子と主に相互作用している。