2020-06-10 自治医科大学,日本医療研究開発機構
概要
自治医科大学医学部感染免疫学講座細菌学部門の崔龍洙教授、氣駕恒太朗講師らは、RNA標的型CRISPR-Cas[1](CRISPR-Cas13a[2])の遺伝子群をバクテリオファージ[3]に搭載することで、特定の遺伝子を持つ細菌を殺菌できる新しい殺菌技術を開発しました。本技術は、抗菌薬で殺菌できない薬剤耐性菌[4]や毒素を産生する悪玉菌を狙って殺菌することができます。
本研究は、日本医療研究開発機構(AMED)感染症研究革新イニシアティブ(J-PRIDE)(研究開発代表者 崔龍洙)、日本学術振興会(JSPS)科学研究費補助金 挑戦的萌芽研究(研究開発代表者 崔龍洙)、同若手研究(研究開発代表者 氣駕恒太朗)、武田科学振興財団(研究開発代表者 崔龍洙)、持田記念医学薬学振興財団(研究開発代表者 氣駕恒太朗)による支援を受けて行ったものです。
本研究の成果は、科学雑誌『Nature Communications』(日本時間6月10日18時 DOI : 10.1038/s41467-020-16731-6)に掲載されます。
研究背景
私たち人類は、これまでに数多くの抗菌薬を開発し、さまざまな細菌感染症を克服してきました。しかし、抗菌薬の使用から間もなく薬剤耐性菌(抗菌薬が効かない細菌)が報告され始め、今や耐性菌は世界中至るところに存在しています。既に臨床で使用されているほぼ全ての抗菌薬に対して耐性菌が出現しています。その一方で、新しい抗菌薬の開発は進んでおらず、薬剤耐性菌感染症の治療はますます困難になっています。WHO(世界保健機関)は、このような状況が続くと2050年には耐性菌によって年間1,000万人の死者が出ると警告しており、薬剤耐性菌問題は緊急に解決しなければならない課題となっています。この危機的な状況を打開するため、近年本国を含め、世界各国が相次いで薬剤耐性対策アクションプランを策定し、耐性菌に対する新たな予防・診断・治療法の開発を推進しています。また、昨今の新型コロナウイルスのように耐性菌もパンデミックを起こす恐れがあるため、既存の抗菌薬とは異なるメカニズムで殺菌できる抗菌薬や、耐性菌を簡易に検出できる診断システムの開発が求められています。
研究手法と成果
本研究では、薬剤耐性遺伝子を認識するように設計したCRISPR-Cas13a(後述)をバクテリオファージ(通称ファージ)に搭載することで、薬剤耐性菌を選択的に殺菌できる抗菌薬の開発を目指しました。CRISPR-Cas13aは2016年に機能が解明されたRNA分解形のリボ核タンパク質複合体です。CRISPR-Cas13aのコンポーネントであるcrRNA(CRISPR RNA)が標的RNA配列を認識すると、RNA分解能酵素であるCas13aが活性化され、宿主細菌のRNAを無差別に切断することで細菌の増殖を抑制します(図1A、Abudayyeh O. O. et al.、2016、Science)。初めに、Cas13aがどの程度増殖阻害を引き起こすのかを調べました。まず、Abudayyehらの報告を元に実験を行ったところ、既報通りCas13aを発現した細菌では緩やかな増殖遅延が確認されました。その一方で、標的遺伝子に対するcrRNA配列を最適化すると、Cas13aは強力な増殖抑制作用を発揮すること(図1B、C)、更には宿主細菌の細胞死を引き起こすことが分かりました(図1D)。これらの結果から、CRISPR-Cas13aは設計次第で強力な殺菌剤として使用できることが示唆されました。
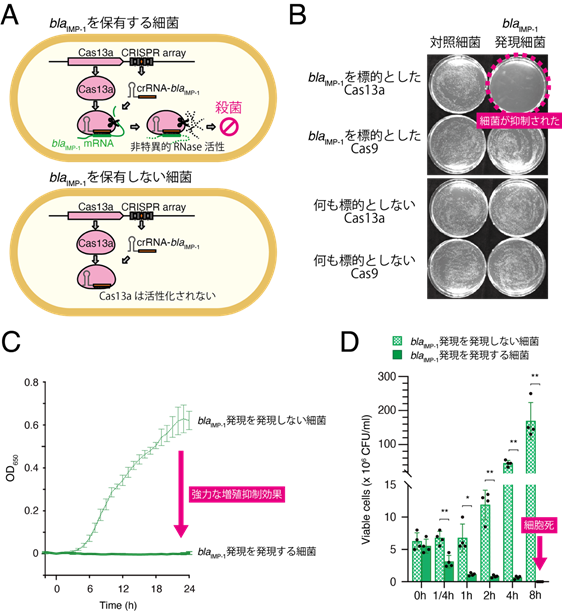
図1. CRISPR-Cas13aの遺伝子標的型殺菌機構A:CRISPR-Cas13aのゲノム領域からは、それぞれCas13aタンパク質とcrRNAが生成される。これらは複合体を作り、crRNAが標的遺伝子(カルバペネム耐性遺伝子であるblaIMP-1)を認識すると、Cas13aのRNase活性部位が露出し、菌体内のRNAを分解する。この作用により、細菌の増殖が抑制され、細胞死も引き起こされる。
B:カルバペネム耐性遺伝子であるblaIMP-1を標的としたCas13aを、blaIMP-1を保有(プラスミド性)する大腸菌に形質転換し、寒天培地上での発育を観察した。Cas13aは標的遺伝子blaIMP-1を発現した細胞の増殖を抑制した。
C:blaIMP-1を標的としたCas13aを、blaIMP-1を保有(プラスミド性)する大腸菌に発現させ、液体培地中での増殖を観察した。blaIMP-1の発現には、無水テトラサイクリン添加による発現誘導系を用いている。Cas13aはblaIMP-1発現細胞の増殖を著しく抑制した。
D:blaIMP-1を標的としたCas13aをblaIMP-1発現大腸菌に作用させ、液体培地中での生菌数をカウントした。blaIMP-1の発現には、無水テトラサイクリン添加による発現誘導系を用いている。Cas13aはblaIMP-1発現細胞の増殖を抑制するだけではく、顕著な殺菌活性を示した。
上述の実験から、Cas13aは非常に強い殺菌効果を示すことが明らかになったため、その抗菌活性を利用した殺菌剤を構築することにしました。この殺菌剤は非常にユニークで、例えばCRISPR-Cas13aの標的遺伝子を耐性遺伝子に設定すれば、薬剤耐性菌(耐性遺伝子を持つ菌)を選択的に殺菌できます。また、標的遺伝子を毒素産生遺伝子に設定すれば、毒素産生菌を選択的に殺菌できます。つまり、狙った細菌を選択的に殺菌できることになります。しかし、殺菌剤として使用するには、CRISPR-Cas13aを対象細菌内に導入する必要がありました。そこで本研究では、CRISPR-Cas13aのデリバリーシステムとしてファージを利用しました。ファージは細菌に感染するウイルスで、自身の核酸(DNAやRNA)を宿主細菌に注入することができます。本研究では、ファージのカプシド(タンパク質の殻)内にCRISPR-Cas13aを封入することに成功し(図2A)、標的細菌を選択的に殺菌できる新規抗菌製剤(抗菌カプシド[5]と名付けました)を作製しました。以下3つの医学分野で抗菌カプシドの応用可能性を検討しました。
1)抗菌カプシドを利用した抗菌治療
抗菌カプシドは標的遺伝子を保有する細菌を選択的に殺菌できるため、標的細菌(病原菌や薬剤耐性菌)を選択的に殺菌できる抗菌治療薬として使用できる可能性が考えられます。実際に、カルバペネム耐性遺伝子[6]であるblaIMP-1を標的とした抗菌カプシドは、blaIMP-1発現株を感染させたハチノスツヅリガの幼虫の致死率を有意に下げることを確認しました(図2B)。この治療薬は標的細菌に選択的に作用するため、細菌叢のバランスを乱さない抗菌治療が可能になります。また、DNA標的型の抗菌カプシド(例えばCas9抗菌カプシド)は、プラスミド[7](細菌の生存に必須ではないDNA)上の遺伝子を標的とした場合に殺菌効果が無く(図1B)、更には標的遺伝子を切断することにより細菌に予期せぬ変異を引き起こす恐れがありました。そのため、Cas13aはCas9よりも安全に使用できる可能性が示唆されました。
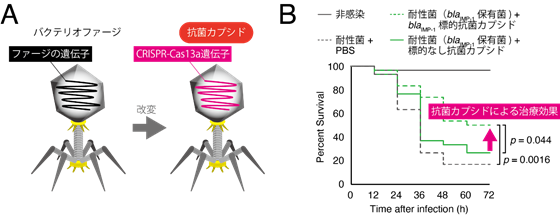
図2. 抗菌カプシドの標的細菌に対する選択的殺菌A:バクテリオファージ(ファージ)のカプシド内のゲノムをCRISPR-Cas13a遺伝子に置き換えることで、抗菌カプシドを合成した。
B:ハチノスツヅリガの幼虫にblaIMP-1発現株(薬剤耐性菌)を感染させた後、抗菌カプシド100 MOI(菌1個当たりの抗菌カプシドの数)を投与した。12時間毎にハチノスツヅリガの生存数をカウントした。blaIMP-1を標的とした抗菌カプシドの抗菌治療効果が見られた。
2)抗菌カプシドを利用した細菌叢の編集
生体細菌叢の乱れが様々な疾病に関わっていることが明らかになり、その関連研究は国内外問わず活発に行われています。しかし現在、特定の疾患の起因菌を選択的に取り除く方法がないため、その疾病に関連する細菌の同定や、起因菌に対する抗菌治療は困難です。本抗菌カプシドは、細菌叢から狙った細菌のみを取り除くことができるため、上記問題の解決に応用できることが考えられました。blaIMP-1を標的にする抗菌カプシドと、コリスチン耐性遺伝子[8]mcr-2を標的とする抗菌カプシドを合成し、3種類の大腸菌(野生型、blaIMP-1発現細菌、mcr-2発現細菌)を混合した細菌叢から標的細菌のみを減少させることに成功しました(図3)。
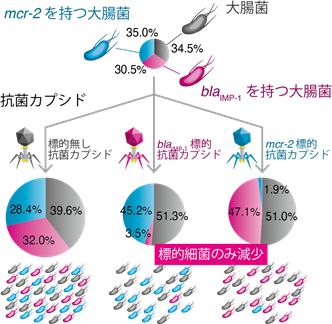
図3. 抗菌カプシドによる細菌の選択的殺菌大腸菌[9]、blaIMP-1発現大腸菌、mcr-2発現大腸菌を等量ずつ混合し、blaIMP-1標的型抗菌カプシドとmcr-2標的型抗菌カプシドを添加した。6時間後、それぞれの添加群では、blaIMP-1発現大腸菌、mcr-2発現大腸菌の比率が減少していた。混合細菌集団の中で、抗菌カプシドによる遺伝子特異的な殺菌効果が見られた。
3)抗菌カプシドを利用した細菌の遺伝子検査
合成した抗菌カプシドは標的遺伝子を保有する細菌を選択的に殺菌できます。裏を返せば、抗菌カプシドにより殺菌される細菌は標的遺伝子を保有していることを意味します。このアイデアを利用し、細菌における遺伝子の保有状況を判別するシステムを構築しました。実際に、「Big5」と呼ばれるカルバペネム耐性遺伝子(blaIMP, blaOXA, blaVIM, blaNDM, blaKPC)それぞれを標的とした抗菌カプシドを設計したところ、それぞれの抗菌カプシドが標的の細菌を選択的に殺菌することが確認されました。この結果から、細菌の遺伝子の保有状況を視覚的に判別することもできました(図4A)。さらに、グラム陰性菌だけでなく、グラム陽性菌の黄色ブドウ球菌[10]でも遺伝子特異的殺菌(遺伝子検査)ができることを確認しました。図4Bで示したように、メチシリン耐性黄色ブドウ球菌(MRSA)のメチシリン耐性遺伝子であるmecAを標的とし殺菌作用が確認できたため、臨床で非常に問題となっているMRSA対策(検出、治療)に応用できることが大いに期待されます。本細菌遺伝子の検査は、検査対象細菌に抗菌カプシドを添加して培養するだけで目的遺伝子の有無が判定できるため非常に簡便です。現在、本細菌遺伝子検査手法の臨床応用に向け、国内の企業と共同開発を行っています。
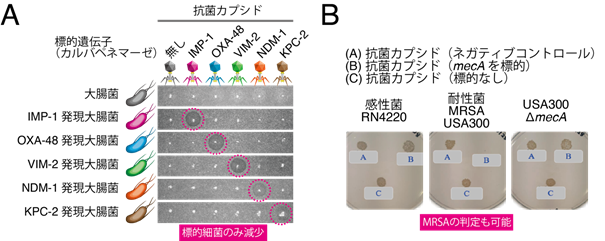
図4. 抗菌カプシドを用いた遺伝子検査A:カルバペネム耐性遺伝子を発現させた大腸菌を軟寒天培地上にプレーティングし、その上から抗菌カプシドをスポットして培養した。抗菌カプシドはそれぞれの標的遺伝子を有する細菌に対して殺菌斑を形成した。
B:抗菌カプシドによるMRSA[10]の選択的殺菌。MRSAをテトラサイクリン含有軟寒天培地上にプレーティングし、その上からテトラサイクリン耐性遺伝子とCas13a遺伝子を含む抗菌カプシドをスポットして培養した。メチシリン耐性遺伝子(mecA)を標的とした抗菌カプシド(B)はmecAを保有するMRSAを選択的に殺菌した。
研究成果の意義と今後の期待
- Cas13aは、遺伝子ノックダウンやRNA編集、遺伝子治療、遺伝子検査などさまざまな領域での応用が期待されている分子です。本研究で、Cas13aはRNAを切断して殺菌する生物活性を有していることが明らかになりました。特に、遺伝子配列特異的に細胞死を誘導する機構は、がん細胞の死滅やウイルス感染細胞の除去などに用いることができる可能性があります。
- Cas13aの塩基配列依存的な殺菌活性を利用して、新しいタイプの抗菌薬の開発に成功しました。この抗菌薬は耐性遺伝子を含む特定の遺伝子を保有する細菌のみを殺菌するため、耐性菌の選択的殺菌や毒素産生性細菌の選択的殺菌が可能になります。従って、これまでの抗菌薬で治療が不可能な耐性菌による感染症、抗菌薬を使えない毒素産生菌による感染症などに対する抗菌治療が可能であると考えられます。また、本抗菌薬は、ファージ由来のカプシドにCas13aを搭載した抗菌カプシド(核酸医薬品)であり、未知の遺伝子を含まず、自己増殖もしないため、安全性の高い生物製剤として実用化しやすいことが期待されます。
- 抗菌カプシドを用いて細菌の遺伝子検査ができることが示されました。従来の細菌遺伝子検査は、PCRなど核酸増幅法を基本としますが、本方法は細菌の増殖の有無で判定できます。PCRによる遺伝子検査に用いるサーマルサイクラーや電気泳動、撮影装置などの機器が不要なため、安価で簡便に検査を実施できます。
論文情報
- タイトル:
- Development of CRISPR-Cas13a-based antimicrobials capable of sequence-specific killing of target bacteria
- 著者名:
- Kotaro Kiga, Xin-Ee Tan, Rodrigo Ibarra-Chávez, Shinya Watanabe, Yoshifumi Aiba, Yusuke Sato’o, Feng-Yu Li, Teppei Sasahara, Bintao Cui, Moriyuki Kawauchi, Tanit Boonsiri, Kanate Thitiananpakorn, Yusuke Taki, Aa Haeruman Azam, Masato Suzuki, José R Penadés, and Longzhu Cui
- 雑誌:
- Nature Communications
- DOI:
- 10.1038/s41467-020-16731-6
補足説明
- [1] CRISPR-Cas
- CRISPR-Casは、細菌が保有するリボ核タンパク質複合体で、外来核酸に対する防御機構として機能する。外来の核酸が侵入すると、菌体はその配列を認識して切断する。この配列特異的切断機構はゲノム編集など幅広い分野で利用されている。
- [2] CRISPR-Cas13
- CRISPR-Cas13は、RNA標的とするCRISPR-Casの一種である。Cas13はcollateral effectと呼ばれる作用により、配列非特異的なRNA分解能が活性化され、宿主細菌の細胞増殖を抑制する。この作用は、感染細胞の自殺メカニズムで、周囲の細菌にファージウイルスの感染が広がらないようにしていると考えられている。
- [3] バクテリオファージ(ファージ)
- 細菌に寄生するウイルス。カプシド(殻)に核酸(DNAまたはRNA)を封入しているが、感染時には核酸が菌体内に注入される。殺菌を主に行うvirulent phage(溶菌性ファージ)と、細菌のゲノムに入り込めるtemperate phage(溶原性ファージ)がある。ファージ療法として、ファージの溶菌活性を生かして抗菌治療を行う治療法がある。これは、旧ソ連の国々で長年行われてきた治療法であったが、最近では米国や欧州、豪州などで実験的臨床使用が行われている。
- [4] 薬剤耐性菌
- 抗菌薬が効かない細菌の総称。抗菌薬が発見されて以来、人類は抗菌薬を使い続けた結果、抗菌薬が効かない菌を生み出してしまった。現在は、臨床で使用されている全ての抗菌薬に対して耐性菌が確認されている。
- [5] 抗菌カプシド
- 開発者が提唱した造語。抗菌活性物質を搭載したファージカプシドのこと。
- [6] カルバペネム耐性遺伝子(カルバペネム耐性菌)
- βラクタム系抗菌薬であるカルバペネムに対する耐性を示す遺伝子のこと。それを有する細菌をカルバペネム耐性菌という。カルバペネムは広域スペクトラムを持ち、他の抗菌薬が使用できない場合の最後の切り札として使用される場合も多い。カルバペネム耐性菌は他の多くの抗菌薬に対しても耐性である場合が多く、抗菌治療が困難になるケースが多い。
- [7] プラスミド
- 染色体DNAとは独立して複製を行う環状二本鎖DNAの総称。染色体DNAは生体の生存に必須であるが、プラスミドDNAは一般的に必須でない。薬剤耐性遺伝子はプラスミドによって伝搬されることも多い。
- [8] コリスチン耐性遺伝子(コリスチン耐性菌)
- コリスチンは、細菌の外膜に結合することにより抗菌活性を発揮する、ポリペプチド系の抗菌薬である。腎障害や神経障害の副作用があるため、臨床ではあまり使用されないが、カルバペネムが効かなくなったグラム陰性菌に用いられる。しかし、 mcrと呼ばれるコリスチン耐性遺伝子群が蔓延しつつあることが報告されている。
- [9] 大腸菌
- 大腸菌はグラム陰性の細菌で、ヒトの腸内にも常在している。尿路感染症の主な原因菌である。また、O157などの一部の大腸菌は下痢症を引き起こす。
- [10] 黄色ブドウ球菌(感染症)
- 黄色ブドウ球菌は、医療施設で分離頻度が最も高い病原細菌である。その多剤耐性菌であるメチシリン耐性黄色ブドウ球菌(MRSA)は、市場抗菌薬の半数以上を占めるβ-ラクタム薬の全てに耐性を示す。
研究者プロフィール
自治医科大学医学部 感染・免疫学講座 細菌学部門
講師 氣駕 恒太朗(きが こうたろう)
自治医科大学医学部 感染・免疫学講座 細菌学部門
教授 崔 龍洙 (さい りゅうしゅ)
お問い合わせ先
研究に関するお問い合わせ先
自治医科大学 医学部 感染・免疫学講座 細菌学部門
崔 龍洙
報道に関するお問い合わせ先
自治医科大学 大学事務部 研究支援課
AMED事業に関する問合せ先
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課