THzパルス光が衝撃波として生体内部へ到達する可能性を発見
2020-06-03 量子科学技術研究開発機構
理化学研究所(理研)光量子工学研究センターテラヘルツイメージング研究チームの山崎祥他基礎科学特別研究員、保科宏道上級研究員、大谷知行チームリーダー、東北大学大学院農学研究科の原田昌彦教授、量子科学技術研究開発機構の坪内雅明上席研究員、大阪大学産業科学研究所の磯山悟朗特任教授、京都大学大学院農学研究科の小川雄一准教授らの共同研究グループ※は、水溶液中で培養した細胞にテラヘルツ(THz)[1]パルス光を照射した際、その光エネルギーが水溶液中を「衝撃波[2]」として伝搬し、細胞内のタンパク質重合体を断片化することを明らかにしました。
本研究成果は、THzパルス光が生体内の水に吸収されて衝撃波を生み出し、生体内部の細胞や組織に作用する可能性を示しており、今後の安全指針策定や、THz光を用いた新しい細胞操作技術の創出につながると期待できます。
今回、共同研究グループは、大阪大学産業科学研究所の自由電子レーザー[3]によって発生したTHzパルス光(周波数4 THz、80~250μJ/cm2)を、水溶液中の培養細胞に向けて照射したところ、細胞内に存在するタンパク質重合体(アクチン[4]繊維)が切断され、断片化することを発見しました。この断片化は、THz光が到達できない水深数mmで観察されたことから、THz光がタンパク質重合体に直接作用したのではなく、水表面で吸収された光エネルギーが衝撃波として水溶液中を伝搬し、細胞内のタンパク質重合体構造の変化を誘起したと考えられます。
本研究は、科学雑誌『Scientific Reports』オンライン版(6月2日付)に掲載されます。
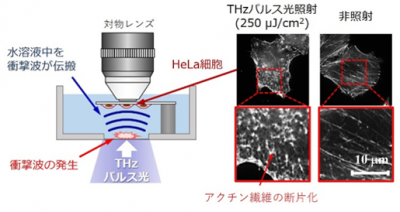
水溶液表面で吸収されたTHzパルス光が衝撃波を発生させ、
細胞内のタンパク質重合体(アクチン繊維)を断片化する
1.背景
近年、技術的な発展を遂げたテラヘルツ(THz)光は、物質の内部構造を観測する検査技術や、次世代の無線通信帯域として、その応用が期待されています。この社会的背景から、THz光のばく露による生体組織への影響が注目されています。
THz光は水に強く吸収される性質があるため、生体組織のような水を含む物質では、10マイクロメートル(μm 、1 μmは1,000分の1 mm)程度しか透過できません。そのため、THz光の生体への影響に関するこれまでの研究は、主に皮膚や目など生体表面の組織を対象としており、生体深部の組織については研究が進んでいませんでした。
2.研究手法と成果
共同研究グループは、細胞内の高分子構造や機能に対してTHz光が与える影響を明らかにするため、多様な生命現象に関わるタンパク質のアクチンに着目し調査しました。アクチンは重合することで繊維構造を形成します。この繊維形成能は細胞から単離・精製した後も維持することから、精製したアクチンを用いることで、THz光照射によるタンパク質への直接的な影響を評価できます。また、精製アクチンで生じた影響は細胞内でも良く再現されるため、タンパク質から細胞へと段階的な調査を効率よく進めることができます。
組織から精製したアクチンの水溶液に塩を添加すると、重合が開始し繊維が形成されます。その過程で、自由電子レーザーを光源としたTHzパルス光(周波数4 THz、80μJ/cm2)を照射し、アクチン繊維の形成に及ぼす影響を調査しました。アクチン繊維を蛍光プローブ[5]で可視化し、その構造と本数を比較したところ、THzパルス光を照射すると、繊維の形成率が非照射と比較して約40%減少することが分かりました(図1)。
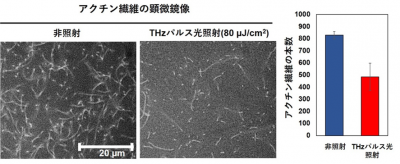
図1 THzパルス光の照射によるアクチン繊維形成への影響
左: アクチン繊維を蛍光プローブで染色し、顕微鏡で観察した。THzパルス光(80μJ/cm2)の照射により、繊維数の減少が見られた。
右: アクチン繊維の本数を比較したグラフ。THzパルス光を照射すると繊維の形成率は非照射と比べて、約40%減少した。
次に、生きた細胞の中にあるアクチン繊維を蛍光プローブにより可視化し、THzパルス光の照射が及ぼす影響を観察しました。その結果、THzパルス光の照射により、細胞内に存在するアクチン繊維の断片化が起きることが分かりました(図2上)。細胞内のアクチン繊維の量は、蛍光プローブの輝度と相関関係があります。そこで蛍光輝度を測定し、繊維量を定量的に解析しました。その結果、THzパルス光の照射面から約2 mm離れた水中であっても、細胞内のアクチン繊維が切断され、蛍光輝度が減少することが分かりました(図2下)。人体において2 mmはヒトの皮膚に相当する厚さであり、この結果はTHzパルス光の影響が皮膚組織の深部まで到達する可能性を示しています。
THz周波数帯は水に吸収されやすく、4 THzでは約10 μmしかその光エネルギーは伝搬しません。しかし、THzパルス光のエネルギーが水分子に吸収され、水溶液中を衝撃波(圧力波)として数mm伝搬することはできます。そのため、THzパルス光の照射により水表面で発生した衝撃波が水溶液中を伝搬し、アクチン繊維を切断したと考えられます。
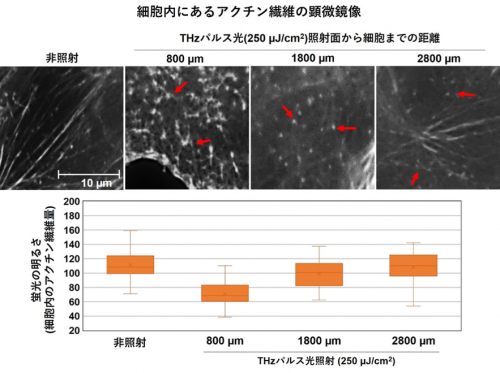
図2 THzパルス光の照射による細胞内アクチン繊維への影響
上: THzパルス光(250μJ/cm2)の照射後、細胞内のアクチン繊維を蛍光プローブで染色し、顕微鏡で観察した。赤矢印は断片化したアクチン繊維を示す。THzパルス光の照射位置から2800μm(2.8 mm)の深さでも、アクチン繊維の断片化が観察された。
下: 蛍光プローブの輝度計測からアクチン繊維の量を定量的に解析した。アクチン繊維量はTHz光の照射位置から深さ800μm(0.8 mm)で約40%、1800μmで約10%、2800μm(2.8 mm)でもわずかに減少を示した。
3.今後の期待
近年、THz周波数帯は次世代の「超高速・大容量」無線通信技術としての利用が想定されています。しかし、日本の電波防護指針では10kHz~300GHz(Gは10億)の範囲でしか安全に関わる指針が定められていません。これまでの安全指針では、100kHzより高いミリ波~サブミリ波周波数帯の生体影響は「熱作用」が支配的であると考えられ、光が連続波であるかパルスであるかといった発振方式については明確に区別されていません。また、水分子に吸収される性質から、THz周波数帯のばく露影響は皮膚表層や角膜など組織の表面のみを対象として行われてきました。
本研究では、パルス発振したTHz光が「衝撃波」として組織の深部まで到達する可能性を明らかにしましたが、連続波では衝撃波を発生させることはできません。そのため本成果は、THz光の発振方式に加え、組織深部における安全性についても皮膚表層と同様に考慮する必要があることを示し、今後の安全指針策定における基盤情報として役立つと期待できます。
また本研究により、THzパルス光の照射によりアクチン繊維を断片化できることが明らかになりました。アクチン繊維は、傷が治る際の細胞の移動や、がん細胞の浸潤・転移など組織深部で起きる現象において中心的な役割を果たします。そのため、これまでにもその繊維形成に影響を与える薬剤が多数開発され、医療応用も進められていますが、これらの薬剤を効率良く組織の深い部位へ運ぶことは困難でした。本成果は、今後、組織深部の生体高分子を標的とした効率的な細胞機能操作技術の開発につながると期待できます。
4.論文情報
<タイトル>
Propagation of THz irradiation energy through aqueous layers: Demolition of actin filaments in living cells
<著者名>
Shota Yamazaki, Masahiko Harata,Yuya Ueno, Masaaki Tsubouchi, Keiji Konagaya, Yuichi Ogawa, Goro Isoyama, Chiko Otani and Hiromichi Hoshina
<雑誌>
Scientific Reports
<DOI>
10.1038/s41598-020-65955-5
5.補足説明
[1] テラヘルツ(THz)
周波数が1012Hz(1兆ヘルツ)付近(0.1T~10THz)の電磁波。THz光は電波と光の中間に位置しており、その両方の特性を持っている。
[2] 衝撃波
圧力の不連続な変化(面)が流体内を伝播する現象。
[3] 自由電子レーザー
加速器で発生した高エネルギー電子線が、交互に反転した磁場分布を持つウィグラーと呼ばれる装置を通過するときに、光共振器に蓄えた光を何度も増幅して、大強度単色コヒーレント光ビームを発生する装置。大阪大学産業科学研究所のTHz自由電子レーザーは日本で唯一のTHz自由電子レーザーであり、この周波数領域では、他国のTHz自由電子レーザーより1桁ピーク強度が高いTHzビームを発生する。
[4] アクチン
アクチンは繊維化して細胞骨格構造を形成する主要タンパク質。皮膚の傷が治る際の細胞の移動や、がん細胞の浸潤・転移などにも中心的な役割を果たす。
[5] 蛍光プローブ
特定波長の光で励起され、蛍光を発する分子。本研究では、アクチン繊維へ選択的に結合し、蛍光を発するプローブを使用した。
共同研究グループ
理化学研究所 光量子工学研究センター テラヘルツイメージング研究チーム
基礎科学特別研究員 山崎 祥他 (やまざき しょうた)
上級研究員 保科 宏道 (ほしな ひろみち)
チームリーダー 大谷 知行 (おおたに ちこう)
東北大学大学院 農学研究科
教授 原田 昌彦 (はらた まさひこ)
大学院生 上野 祐也 (うえの ゆうや)
量子科学技術研究開発機構
上席研究員 坪内 雅明 (つぼうち まさあき)
大阪大学 産業科学研究所
特任教授 磯山 悟朗 (いそやま ごろう)
京都大学大学院 農学研究科
准教授 小川 雄一 (おがわ ゆういち)
大学院生 小長谷 圭志 (こながや けいじ)
研究支援
本研究は、日本学術振興会(JSPS)学術研究助成基金助成金「生体高分子を標的としたテラヘルツ波照射による細胞機能制御(代表者:山崎祥他)」、理研‐産総研「チャレンジ研究」(准本格研究)による支援を受けて行われました。また、本研究は「物質・デバイス領域共同研究拠点」の共同研究プログラムの助成を受けたものです。