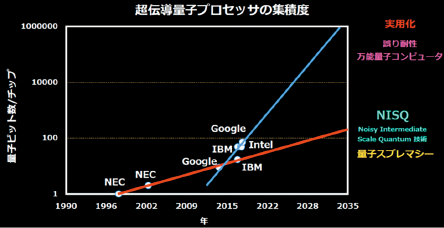
機能をプログラム可能な分子ロボットの開発に期待
2019-09-24 京都大学
遠藤政幸 理学研究科准教授、瀧ノ上正浩 東京工業大学准教授、石川大輔 同研究員(現・首都大学東京)、鈴木勇輝 東北大学助教、川野竜司 東京農工大学准教授、柳澤実穂 東京大学准教授らの研究グループは、DNAオリガミで作製したDNAナノプレートによって細胞膜を模倣した、人工細胞(微小カプセル)の開発に世界で初めて成功しました。
人工的な膜に細胞膜のような複雑な機能を持たせるには、性質や機能を自在に設計可能な物質を材料とする必要がありました。本研究で開発した、DNAを膜の材料とする微小カプセルでは、DNAの塩基配列を設計することで膜の機能を自在に設計でき、「プログラム」した機能をコンピュータソフトウェアのようにインストールできます。
本技術は、分子コンピュータや分子センサーを搭載した分子ロボットや、薬剤送達等への応用が期待されます。
本研究成果は、2019年9月13日に、国際学術誌「Angewandte Chemie International Edition」のオンライン版に掲載されました。

図:DNAオリガミによる人工細胞微小カプセルのイメージ
詳しい研究内容について
DNA オリガミによる人工細胞微小カプセルの開発に成功
-機能をプログラム可能な分子ロボットの開発に期待-
【要点】
○DNA オリガミによるナノプレートで細胞膜を模倣した、人工細胞としての微 小カプセルを開発
○人工的なイオンチャネルを形成させ、微小カプセル間のイオンの輸送に成功
○分子コンピュータ/分子センサーを搭載した分子ロボットや、人工ニューラ ルネットワーク、高機能薬剤送達などへの応用に期待
【概要】
東京工業大学 情報理工学院の瀧ノ上正浩准教授、石川大輔研究員(現首都大 学東京)、東北大学の鈴木勇輝助教、東京農工大学の川野竜司准教授、東京大学 大学院総合文化研究科の柳澤実穂准教授、京都大学の遠藤政幸准教授らの研究 グループは、DNA オリガミ(用語 1)で作製した DNA ナノプレートによって 細胞膜を模倣した、人工細胞(微小カプセル、図 1)の開発に世界で初めて成 功した。
人工的な膜に細胞膜のような複雑な機能を持たせるには、性質や機能を自在 に設計可能な物質を材料とする必要があった。今回開発した、DNA を膜の材料 とする微小カプセルでは、DNA の塩基配列を設計することで膜の機能を自在 に設計でき、“プログラム”した機能をコンピュータソフトウェアのようにイン ストールできる。この技術は、分子コンピュータ/分子センサーを搭載した分子ロボット(用語 2)や薬剤送達等への応用が期待される。
研究成果は現地時間 9 月 13 日にドイツ化学会誌「Angewandte Chemie International Edition」のオンライン版で公開された。
図 1. DNA オリガミによる人工細胞微小カプセルのイメージ
●研究の背景と経緯
細胞のような、分子スケールからマイクロスケールにおよぶ、複雑で高機能な システムを人工的に創ることは、科学技術において究極の目標の一つである。こ れまでにも、細胞膜を模倣した人工的な膜を持つ人工細胞(微小カプセル:用語 3)の構築が試みられているが、細胞膜のような機能のある膜を設計・作製する ことは困難であった。
人工細胞となる微小カプセルの構築には、脂質分子(細胞膜の構成分子)を構 成素材とする人工的な膜で水滴を覆った、油中水滴エマルション(用語 4)や脂 質二重膜小胞(リポソーム)が一般的に用いられる。膜の構成素材としては、脂 質分子以外に、ナノ・マイクロサイズ(用語 5)の微粒子であるコロイド粒子も 利用されており、その場合の油中水滴エマルションは Pickering(ピッカリング) エマルション(用語 6)、小胞はコロイドソームと呼ばれている。コロイド粒子 の膜によるエマルションや小胞には、物理的な安定性があるだけではなく、コロ イド粒子の形状やその表面の改質などにより、さまざまな用途へ利用できると いう利点がある。しかし、プラスチックなどの通常の物質を材料とするコロイド 粒子には、設計性と拡張性の限界が存在する。したがって細胞膜のように、外部 からの分子刺激に応答したり、エネルギー(栄養)となる物質を取り込んだりと いった複雑な機能を人工的な膜に持たせるには、性質や機能を自在に設計可能 な物質を材料とするコロイド粒子を用いる必要があった。
●研究成果
研究グループは、生体高分子であるDNAを素材とするDNAオリガミにより、 両親媒性(用語 7)の DNA ナノ構造体(DNA ナノプレート)を設計・作製した。 この DNA ナノプレートを一種のナノサイズのコロイド粒子として用いて、油中 水滴を覆う膜を形成させ、微小なカプセルを実現した(図 2)。さらに、DNA ナ ノプレートにナノサイズの孔を開けることで、微小カプセル間でイオンを輸送 可能にし、細胞膜のイオンチャネルのような機能を実現することに成功した。
DNA は本来、親水性の物質であるため、油中水滴エマルションを作るのに必 要とされる、界面活性剤のような両親媒性を持たない。そこで研究グループは、 DNA オリガミで作製した DNA ナノプレートの片面だけに疎水性の有機分子(コ レステロール基)を取り付けることで、疎水性と親水性の両方を持つ両親媒性の DNA ナノプレートを得ることに成功した。この両親媒性 DNA ナノプレートを 用いて油中水滴エマルションを作製したところ、DNA ナノプレートは油水界面 に集積することがわかった(図 3)。さらに、界面に集積した DNA ナノプレート は、脂質分子のように流動的に動くのではなく、積層した非流動的なコロイド粒 子のようにふるまうことが明らかになった。
また、一般的には細胞膜の膜タンパク質を介して行われるイオンチャネル機 能を、両親媒性 DNA ナノプレートで安定化された微小カプセルへ実装すること を試みた。DNA ナノプレートにナノサイズの孔を構築し、2 つの微小カプセル 同士を接触させたところ、イオンの輸送による微小電流が測定された(図 4)。 さらに測定された電流値から、形成したナノチャネルの大きさを算出するため、 数値シミュレーションも行った。これらの結果から、DNA ナノプレートが十数 層重なることにより、イオンを輸送するチャネルが形成されているということ がわかった。
このように、細胞膜を模倣した微小カプセルの膜の素材に、性質や機能を自 在に設計可能な DNA を用いることで、油中水滴を安定に保つ界面活性剤のよ うな機能と、イオンチャネル機能を同時に発現できる DNA ナノプレートを設 計し、細胞のようなイオンの輸送を実現した。これは、微小カプセルの構築に 従来用いられてきた脂質分子や固体粒子の設計性と拡張性の限界を超え、膜の 性質と機能を分子レベルから自在に設計できることを示す成果であり、細胞の ような複雑な機能を人工的に創り出すために重要な方法論となる。
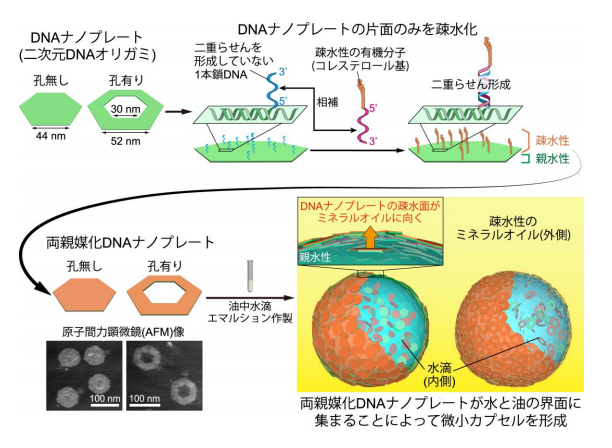
図 2. 両親媒性 DNA ナノプレートおよび微小カプセル作製の概念図。DNA オリガミで、中心 の孔無し・有りの 2 種類の六角形 DNA ナノプレートを作製した。DNA はもともと親水性であ るため、DNA ナノプレートを親水(水)/疎水(ミネラルオイル)界面に集積させるには、 DNA を部分的に疎水化する必要がある。そこで、DNA ナノプレートの片面のみに 1 本鎖 DNA を伸ばし、そこへ相補な 1 本鎖 DNA を二重らせん形成させることで、疎水性有機分子であ るコレステロールを取り付け、両親媒性化した。DNA ナノプレートの形成は、原子間力顕微 鏡観察から確認された。両親媒性化した DNA ナノプレートを含む水溶液をミネラルオイル に加え、油中水滴エマルションを作製すると、疎水化した面がミネラルオイルに向かうこと で DNA ナノプレートが界面に集積する。これによって、微小カプセル様の油中水滴空間が形 成される。
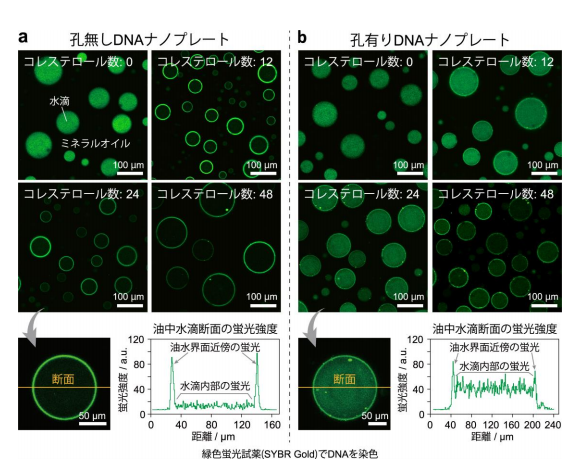
図 3. 両親媒性化した(a)孔無しおよび(b)孔有り DNA ナノプレートを用いて作製した、 油中水滴エマルションの共焦点レーザー顕微鏡像。DNA を緑色蛍光試薬で染色しており、緑 色部分に DNA ナノプレートが存在することを示している。両親媒性化していない場合(コレ ステロール数:0)、DNA ナノプレートは親水性のため、水滴中に均一に分散した。一方、両 親媒性化した場合(コレステロール数:12 以上)、孔無し、孔有りいずれの DNA ナノプレー トも、親水(水)/疎水(ミネラルオイル)界面に集まっている様子が観察された。
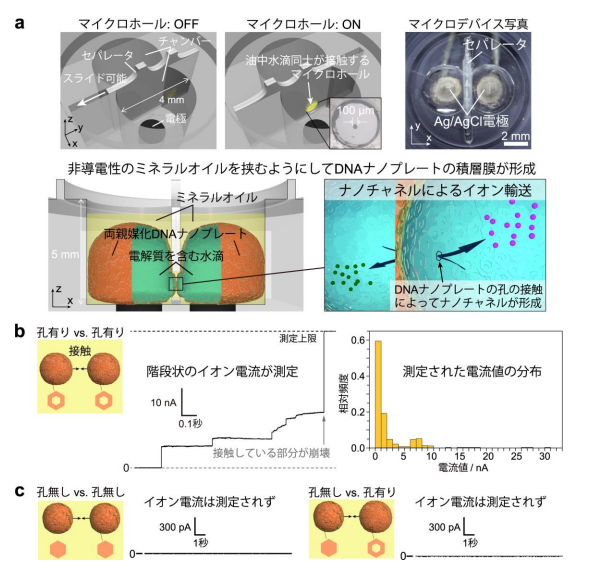
図 4. (a) DNA ナノプレートで覆われた微小カプセル間のイオン電流を測定するために作 製したマイクロデバイスの模式図。油中水滴を作るための 2 つの円柱状のくぼみが、直径 100 µm のマイクロホールがあるセパレータで分割されている。くぼみの底には電極が取り 付けられており、外部から電圧の制御が可能である。孔有り DNA ナノプレートで覆われた油 中水滴を、マイクロホール内でミネラルオイルを挟むようにして接触させると、DNA ナノプ レートの孔がつながり、この孔(ナノチャネル)を通ってイオンが輸送される。(b)孔有り DNA ナノプレートを接触させた場合、階段状のイオン電流が測定され、ナノチャネルの形成 が確認された。(c)微小カプセルの少なくとも一方に孔無し DNA ナノプレートを用いた場 合、接触させてもイオン電流は測定されなかった。
●今後の展開
この研究の結果、性質や機能を自在に設計可能な DNA によって、細胞膜を模 倣した人工的な膜を持つ微小カプセルを作製することが可能となった。DNA を 素材とする研究は、2006 年の DNA オリガミ発表後に急激に増加しており、酵素 反応デバイスや情報処理デバイスなど、細胞の個々の機能をナノスケールの DNA 構造体で人工的に創り出す技術が報告されている。今回の研究成果である 微小カプセル技術は、膜の性質と機能を DNA の塩基配列から自在に設計できる という利点を活かして、細胞の個々の機能をコンピュータソフトウェアのよう にインストールできる技術となり得る。今後は、分子センサーや分子コンピュー タによる感覚や知能を持った分子ロボットや、生命科学の工学的研究、薬剤送達 等の医薬研究への応用が期待される。
本研究成果は、文部科学省新学術領域研究「感覚と知能を備えた分子ロボット の創成(略称 分子ロボティクス)」および文部科学省 科学研究費補助金、「東工 大の星」支援【STAR】、旭硝子財団研究奨励、油脂工業会館研究助成、内藤記念 科学振興財団内藤記念女性研究者研究助成金の支援のもとで得られたものであ る。また東京工業大学の森田雅宗日本学術振興会特別研究員(現 産業技術総合 研究所 研究員)、土屋美恵修士課程大学院生(当時)、東京農工大学の大原正行 修士課程大学院生(当時)、黒川知加子修士課程大学院生(当時)との共同研究 である。
【用語説明】
(1) DNA オリガミ:長い 1 本鎖 DNA(主に 7,000~8,000 塩基)と多数の短い 1 本鎖 DNA(数十塩基)から構成される、二次元・三次元の DNA ナノ構 造体。作りたい形状に合わせて、長い 1 本鎖 DNA を一筆書き状に折りた たみ、相補となるように設計された短い 1 本鎖で固定することで、数十ナ ノメートルの構造体を作製できる。カリフォルニア工科大学の Paul Rothemund 博士によって 2006 年に報告された。
(2) 分子ロボット:外部から分子の信号を受信し、分子の計算によって判断を 下すことで、その環境に対して自律的に反応する、感覚・知能・動作を併 せ持つ人工的な分子システム。
(3) 人工細胞:実際の細胞の大きさに相当する数十マイクロメートル程度の 微小な空間において、細胞の一部の機能を再構成したカプセル状の構造 体。細胞膜と同じ成分である脂質分子で覆われた微小なカプセルが一般 的だが、本研究のように、コロイド粒子で覆われたものも報告されている。
(4) 油中水滴エマルション:互いに混ざり合わない水と油が乳化剤等を加え ることで混ざり合い、水滴が油中に分散した状態。食品では、バターや マーガリンなどが挙げられる。一方、油滴が水中に分散したものを水中油 滴エマルションといい、牛乳やマヨネーズがこれに当たる。
(5) ナノ・マイクロサイズ:ナノメートル(nm)は 10−9 メートル、マイクロ メートル(µm)は 10−6 メートルである。水素原子が 0.1 nm 程度、バクテ リアが 1 µm 程度の大きさである。
(6) Pickering(ピッカリング)エマルション:洗剤などの界面活性剤分子では なく、コロイドなどの固体粒子によって安定化されたエマルション。固体 粒子の素材は、粘土鉱物や金属などの無機物、またポリマーやタンパク質 などの有機物など、多種多様なものが報告されている。この現象は Walter Ramsden 博士によって 1903 年に、また Spencer U. Pickering 氏によって 1907 年にそれぞれ報告されており、一般的には後者の名前を冠して Pickering(ピッカリング)エマルションと呼ばれる。
(7) 両親媒性:水となじみやすい(親水性)部分と、油となじみやすい(疎水 性)部分の両方を持つ性質。この性質を持つ分子やコロイド粒子は、水と 油のような、親水性と疎水性の 2 つの相が互いに接触している境界面(界 面)に集まる性質を持つ。両親媒性物質を界面活性剤と呼ぶこともあり、 洗剤は界面活性剤の一種である。
【論文情報】
掲載誌:Angewandte Chemie International Edition
論文タイトル:DNA Origami Nanoplate-Based Emulsion with Nanopore Function
著者:Daisuke Ishikawa, Yuki Suzuki, Chikako Kurokawa, Masayuki Ohara, Misato Tsuchiya, Masamune Morita, Miho Yanagisawa, Masayuki Endo, Ryuji Kawano, Masahiro Takinoue* (石川大輔、鈴木勇輝、黒川知加子、大原正行、土屋美恵、 森田雅宗、柳澤実穂、遠藤政幸、川野竜司、瀧ノ上正浩*)
DOI:10.1002/anie.201908392