2019-07-18 東京大学
戸田 圭一郎(物理学専攻 博士課程1年生)
玉光 未侑(物理学専攻 博士課程2年生)
長島 優(医学部附属病院神経内科 助教)
堀﨑 遼一(大阪大学大学院情報科学研究科情報数理学専攻 助教)
井手口 拓郎(附属フォトンサイエンス研究機構 准教授)
発表のポイント
- 広く普及している光学顕微鏡を活用して、試料を構成する分子分布画像を取得する簡便な手法を開発した。
- 顕微分光による分子分布の可視化機能が備わることで、試料の化学的な性質を調べることが可能となった。
- 光学顕微鏡による通常の形状観察だけでは判断できなかった病気の診断や、生命科学の基礎研究への利用が期待される。
発表概要
物体のミクロな形状を観察する際には顕微鏡が使われます。光学顕微鏡は、マイクロメートル以下の分解能で対象試料を観察することを可能とし、科学や産業の様々な場面において利用されています。しかしながら、通常の顕微鏡で観察できるのは物体の形状のみです。もし、物体を構成する分子情報を取得することができれば、計測対象の化学的な情報を得られるようになり、計測の質を向上することができます。広く普及した市販の顕微鏡を用いて分子の分布を計測することはできるでしょうか。
東京大学大学院理学系研究科の井手口拓郎准教授らの研究グループは、市販の位相差顕微鏡に赤外レーザー光を照射するユニットを付与するのみで、通常の顕微画像の上に分子の空間分布画像をのせる新技術の開発に成功しました。汎用的に用いられている顕微鏡にユニットを追加するのみで実装できる簡便な手法であることから、基礎科学への利用のみならず、病気の診断や工業製品・食品の品質検査など、医療や産業での利用も期待されます。
発表内容
研究の背景
光学顕微鏡は物体のミクロな形状を観察する際に利用されます。通常の顕微鏡では、光の散乱、吸収、回折などの現象で生じるコントラストにより物体の形状を観ています。そのため、物体を構成し、その性質を司る各種分子の位置情報を得ることはできません。
分子の情報を得るためには、特殊な技術を用いる必要があります。広く知られている技術として、蛍光プローブを用いる手法、ラマン散乱を用いる手法、赤外吸収を用いる手法があります。蛍光プローブを用いる手法は光を当てると蛍光を発する分子を観る手法であり、蛍光染色を伴います。そのため、再生医療に用いる幹細胞などの人体への導入を想定する試料の計測、あるいは、薬剤などの蛍光プローブよりも小さな分子の計測などへの利用に向きません。いっぽうで、ラマン散乱や赤外吸収は分光により分子そのものの振動を観る、染色を用いないラベルフリーの顕微分光(注1)技術であり、あらゆる分子を対象にできるという利点があります。しかしながら、ラマン散乱顕微鏡は空間分解能は高いものの感度が低く長時間の計測を要するという欠点を、また、赤外吸収顕微鏡は感度は高いものの空間分解能が低いという欠点を、それぞれ持つため、両者の性能はトレードオフの関係にあります。超短パルスレーザーの照射で得られる強いラマン散乱を利用するコヒーレントラマン散乱顕微鏡は、感度と空間分解能を両立する手法ですが、高価で複雑な装置が必要である上、強いパルス光による試料のダメージが避けられないという欠点を持ちます。
開発した手法の概要
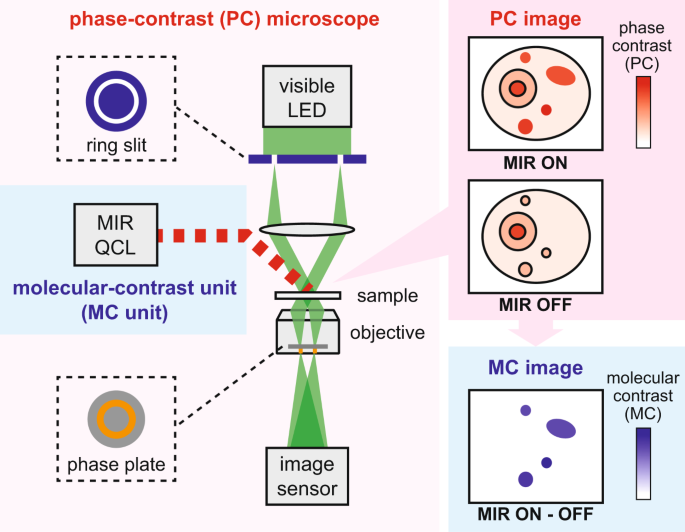
東京大学大学院理学系研究科の戸田圭一郎大学院生、玉光未侑大学院生、井手口拓郎准教授らのグループは、ラマン散乱顕微鏡や赤外吸収顕微鏡の欠点を克服する新しいラベルフリー手法「赤外フォトサーマル位相差顕微鏡」を開発しました。この手法では、赤外光と可視光の照明を組み合わせることで、赤外吸収による高い感度を利用しつつ、可視光の空間分解能を実現することができます。対象とする分子振動に対応する波長の赤外光を顕微鏡の視野内に広く照射すると、対象分子が存在する部分のみが光を吸収します。赤外光の吸収により得られたエネルギーは熱に変換され、分子の存在する位置でのみ温度上昇が誘起され、屈折率の変化が生じます。この屈折率の変化を可視光の位相変化として定量することで、可視光の高い空間分解能での分子振動の画像化が実現します(図1)。
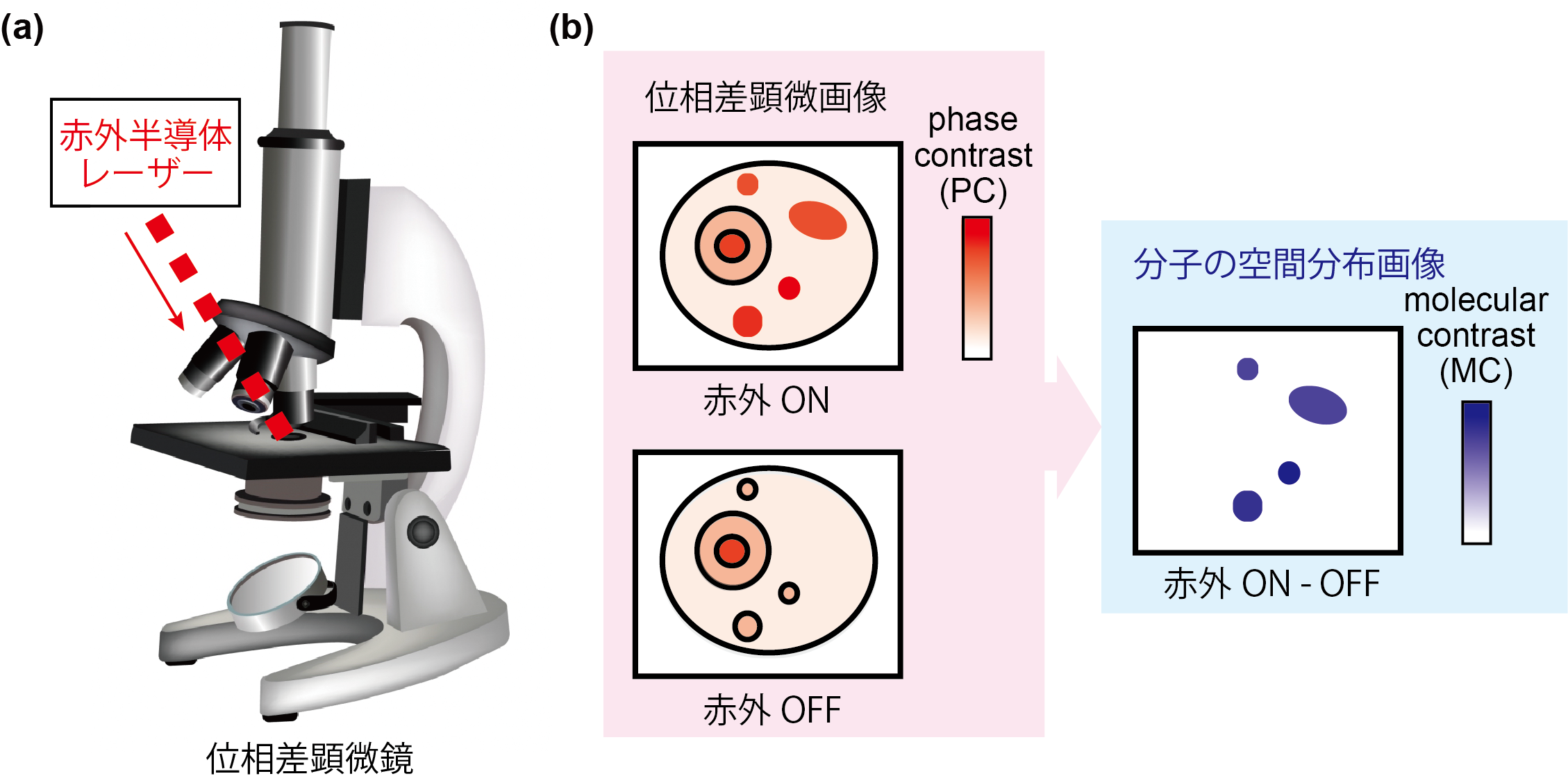
図1.赤外フォトサーマル位相差顕微鏡
(a)顕微鏡の概念図。(b)分子の空間分布情報を得る原理の概念図。
また、照射する赤外光の波長を変えて分光計測をすることで、複数種類の分子振動を観ることができます。本研究では、可視光による位相計測に市販の位相差顕微鏡を用いましたが、デジタルホログラフィーなど、他の手法を用いることもできます。
開発した顕微鏡を用いて、HeLa細胞(ヒト子宮頸がん由来の培養細胞)内の分子の分布を観る原理検証実験を行いました。タンパク質分子に含まれるペプチド結合の分子振動に共鳴する赤外光(6.5 μm、1,530 cm-1)を用いることで、HeLa細胞中の核周辺に存在するタンパク質の分布を可視化することに成功しました(図2左)。また、赤外光の波長を掃引することで空間の各点における赤外吸収スペクトルの取得を実現しました(図2右)。
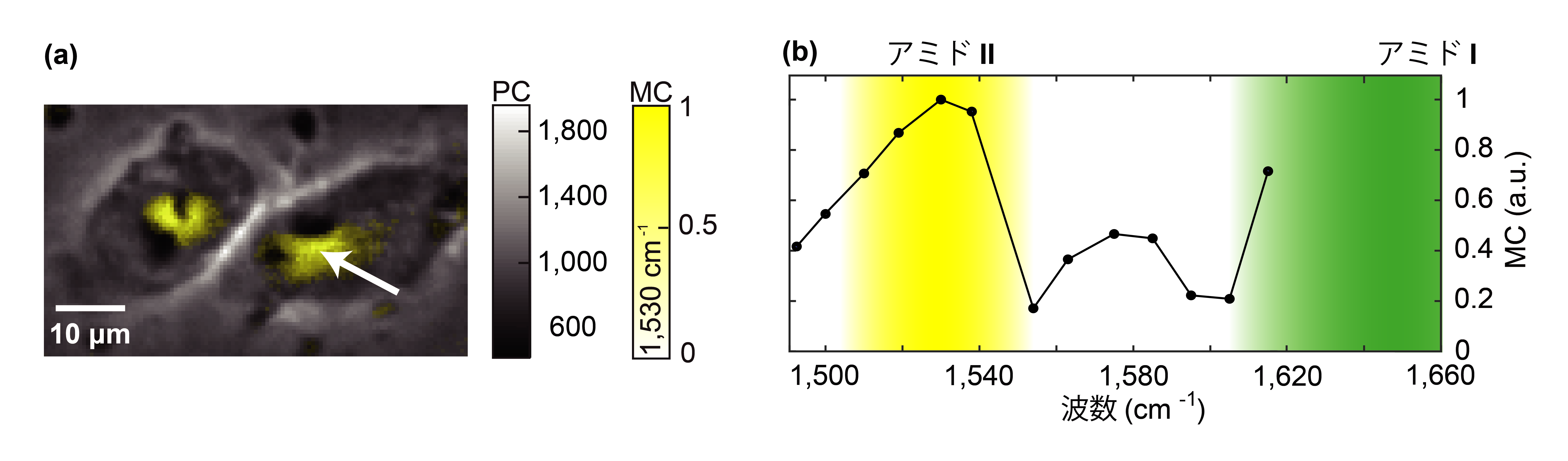
図2.赤外フォトサーマル位相差顕微鏡で計測したHeLa細胞内のスペクトラルイメージング結果
(a)通常の位相差顕微鏡で得られる画像(Phase-contrast、PC画像)の上に、波数1530 cm-1 (タンパク質分子に含まれるペプチド結合の分子振動に共鳴する波長) の赤外光を用いた時に得られた分子分布画像(Molecular-contrast、MC画像)を重ねたもの。核周辺に存在するタンパク質の分布が可視化されている。(b)(a)に示した白い矢印の位置における赤外スペクトル。スペクトル中に示す黄色と緑色の領域は、ペプチド結合に由来する分子振動の異なる固有振動を表し、それぞれ、アミドIIとアミドIと呼ばれる振動帯域を指す。
赤外吸収スペクトルを解析することで、混合化合物中の化学組成を同定することが可能となります。本実験では、細胞内で約1度の温度変化を誘起し、それに伴う位相変化を検出しています。
赤外フォトサーマル位相差顕微鏡は、波長が長くエネルギーの低い赤外光と、通常の顕微鏡の可視光照明条件で実装できるため、試料へのダメージを最小限に抑えることができる手法です。そのため、特に、生物学や医学で観察対象となる生体試料の観察に利点を持つ手法です。また、市販の顕微鏡に赤外光のユニットを追加するのみで実装出来るため、簡便である点も特徴の一つです。また、従来の計測画像と同時に計測できることも利点の一つです。従来の顕微画像との比較を容易に行うことができるため、過去の知見との対応を付けやすい手法です。
社会的意義
本技術は汎用的な顕微鏡技術であるため、利用が想定される分野は多岐にわたります。特に、フォトダメージが問題となる細胞や組織などの観察の場面において強みを発揮することが期待されます。非染色、低侵襲で生体試料中の生体分子の分布を定量することは、再生医療や病理診断において有用であると想定しています。また、熱を利用した手法であることから、細胞内における熱拡散現象の定量評価ツールとしての利用も期待されます。
*本研究は、東京大学医学部附属病院神経内科の長島優助教、大阪大学大学院情報科学研究科情報数理学専攻の堀﨑遼一助教と共同で行われました。
発表雑誌
- 雑誌名
Scientific Reports論文タイトル
Molecular contrast on phase-contrast microscope著者
Keiichiro Toda, Miu Tamamitsu, Yu Nagashima, Ryoichi Horisaki and Takuro Ideguchi*DOI番号
10.1038 / s41598-019-46383-6
用語解説
注1 顕微分光
異なる波長の光に対する物質の応答特性を計測することを分光といい、分光と顕微鏡を組み合わせたものを顕微分光という。
―東京大学大学院理学系研究科・理学部 広報室―