生きた細胞の表面を「見る」革新的技術
2018/07/18 京都大学 東北大学 日本医療研究開発機構
概要
京都大学大学院生命科学研究科 吉村成弘准教授、吉田藍子同博士課程学生(研究当時、現:北海道大学博士研究員)、東北大学学際科学フロンティア研究所 鈴木勇輝助教、オリンパス株式会社らの研究グループは、細胞が外界の物質を取り込む際の直径数100nmの陥入構造を生きた細胞で可視化し、その分子機構に関して新しい知見を手に入れることに成功しました。細胞膜の陥入(エンドサイトーシス)は、細胞が外界の物質やシグナル分子を取り込む一般的なしくみとして古くから知られていましたが、膜の形態変化を誘導する分子機構に関しては、不明な点が多く残されていました。当研究グループは、生きた細胞の細胞膜を可視化する特殊な顕微鏡を独自に開発し、今回、エンドサイトーシスに伴う細胞膜の微小構造変化を捉えることに成功しました。そして、その詳細な解析により、細胞内部で膜を支えるタンパク質骨格が重要なはたらきをしていることを証明しました。この技術は、細胞表層で進行する様々な生命現象、例えばウイルス・細菌感染、神経伝達、がん、免疫反応など、の理解・解明に資する大きな技術革新です。
本研究は、2018年5月3日に国際学術誌「PLOS Biology」にオンライン掲載されました。
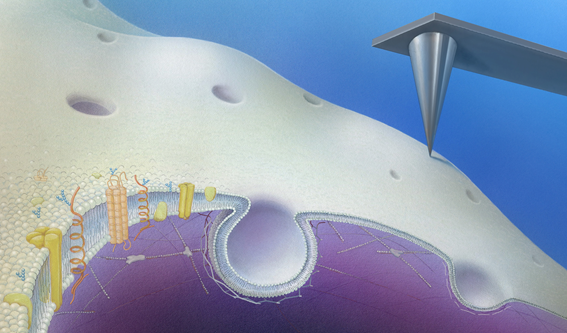
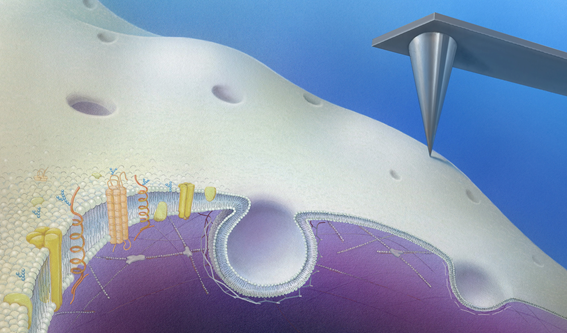
図:細胞表面では、様々な膜タンパク質が細胞外のシグナルを細胞内へと伝達すると共に、膜の陥入(エンドサイトーシス)が細胞外の物質を細胞内に取り込んでいる。この膜の陥入プロセスを生きた細胞で観察する為に、先端の鋭利(先端径数ナノメートル)な探針(右上)で細胞表面を高速でなぞる(走査する)顕微鏡を開発し、その可視化に成功した。
背景
細胞膜は細胞内部と外界とを隔てる障壁であると同時に、細胞が外界と情報をやりとりするための重要な中継地点です。特に、細胞が外界の物質を細胞内に取り込む仕組みは、細胞の環境応答、神経伝達などにおいて重要であり、細胞活動に必要不可欠です。これには、細胞膜に埋め込まれたチャンネルや受容体などが外界の分子(シグナル)を内部に輸送(伝達)する経路の他に、細胞膜の陥入により外の物質を内部に取り込む仕組み(以下、エンドサイトーシス)が中心的役割を果たしています。これまで、エンドサイトーシスに関与するタンパク質が多く同定されてきましたが、実際にどのような形状変化を経て膜陥入が進行するかに関しては、電子顕微鏡写真を並べて推測するに留まっていました。そこで、当研究グループは、この仕組みを解明すべく、「生きた細胞の細胞膜を可視化する顕微鏡」の開発に取り組み、今回その実用化に成功しました。
研究手法・成果
今回用いた顕微鏡は「走査型プローブ顕微鏡」と呼ばれる特殊な顕微鏡です。先端径が数ナノメートルの鋭利なプローブで試料表面を「なぞる」ことでその形状を可視化します。しかし、細胞膜は「脂」でできた平面膜なのでとても柔らかく、従来の同型顕微鏡では可視化は不可能でした。そこで本研究グループは、オリンパス株式会社と共同で「生きた細胞の細胞膜を可視化するための高速走査型プローブ顕微鏡」の開発に取り組み、細胞に与える力を大幅に弱くすることで、細胞膜の形状を数ナノメートル(1ミリの100万分の1)の分解能で可視化する事に成功しました。さらに、高分解能の蛍光顕微鏡と組み合わせることで、タンパク質の局在を同時に可視化する技術を確立し、エンドサイトーシスに伴う膜形状変化のメカニズムを分子レベルで解明することに成功しました。特に、膜の陥入が最終的に細胞膜から切り離されて小胞を形成する際には、周辺に細胞内骨格が一過的に集合し、細胞膜に大きな力を及ぼすことが分かりました。このことは、エンドサイトーシスと細胞骨格との関係を示す重要な結果です。
本研究成果は、従来の顕微鏡では不可能であった細胞表層のダイナミックな動きを「目で見て」理解することを可能にした大きな技術革新です。顕微鏡技術の発展とともに進歩してきた生物学の歴史を考えると、新たな生物学的展開の可能性を十分に秘めた成果であり、エンドサイトーシスのみに留まらず、様々な生命現象に応用できると考えられます。
波及効果、今後の予定
今回の成果である「エンドサイトーシス過程の可視化」は、「高速走査型プローブ顕微鏡」技術のはじめの一歩に過ぎません。細胞膜は、様々な分子が行き交う情報中継地点であり、その構造や機能のダイナミクスの解明は、細胞活動の基本原理の理解に必要不可欠です。タンパク質の局在に加え、細胞膜の形状変化を可視化できる当技術は、細胞膜近傍で進行する様々な現象の理解に大きく貢献すると考えています。たとえば、これまで電子顕微鏡でしか捉えられなかったウイルス(直径100 nm前後)の侵入や出芽がリアルタイムで観察することができ、その感染機構の解明にこれまでにない新たな知見をもたらすことができます。また、がんや神経疾患、細胞死の中には、細胞表層の構造変化を伴うものがあるとされてきましたが、これまでその動的な姿を捉えることはできませんでした。本技術の応用により、様々な疾患の原理解明に資する新しい知見が得られることが期待できます。
研究プロジェクトについて
本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「低侵襲細胞表層イメージングによる細胞の内因性力発生・維持システムの動作原理の解明」(研究開発代表者:吉村成弘)、および日本学術振興会科学研究費助成事業(挑戦的萌芽研究)の支援を受けて行われました。
参考図

図. 高速走査型プローブ顕微鏡で観察した動物細胞表面におけるエンドサイトーシス過程。開口径約200nmの穴が生じて消滅するまでの膜形状変化を可視化することに成功した。
参考動画
- 動画タイトル:Hybrid time-lapse imaging of COS-7 cells expressing EGFP-CLCa
- URL:https://doi.org/10.1371/journal.pbio.2004786.s017
*動画は上記URLからダウンロードして閲覧することができます(MOV形式;約4.21メガバイト)
論文タイトルと著者
- タイトル:Morphological changes of plasma membrane and protein assembly during clathrin-mediated endocytosis(日本語訳:クラスリン依存的エンドサイトーシスにおける細胞膜形状変化とタンパク質局在の同時イメージング解析)
- 著者:A. Yoshida, N. Sakai, Y. Uekusa, Y. Imaoka, Y. Itagaki, Y. Suzuki, S.H. Yoshimura
- 掲載誌:PLOS Biology
- DOI:org/10.1371/journal.pbio.2004786
お問い合わせ先
吉村 成弘(よしむら しげひろ)
京都大学大学院生命科学研究科 准教授
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課