バイオマス変換や酵素科学に貢献
2019-02-14 京都大学
徳永有希 農学研究科博士課程学生、渡辺隆司 生存圏研究所教授の研究グループは、永田崇 エネルギー理工学研究所准教授、片平正人 同教授らのと共同で、植物バイオマス由来のリグニンとセルラーゼの結合を分子レベルで包括的に解析することに、はじめて成功しました。
木材や草本などの非可食バイオマスを酵素糖化・発酵によりバイオ燃料や有用化学品原料に変換する際には、セルロースの分解酵素であるセルラーゼの投入量をいかに減らすかが、プロセス実現のボトルネックとなっていました。分解物に共存するリグニンは、セルラーゼに吸着して、酵素活性を強く阻害しますが、これまで、リグニンとセルラーゼの相互作用の分子レベルでの知見は限られていました。
本研究成果は、セルラーゼの構成要素である糖質結合モジュール (CBM)とリグニンの結合に関与するアミノ酸を包括的にNMR(核磁気共鳴)で解析したはじめての研究であり、リグニンにより阻害を受けにくい酵素の開発、バイオマス前処理法の開発につながる成果です。
本研究成果は、2019年2月13日に、国際学術誌「Scientific Reports」のオンライン版に掲載されました。

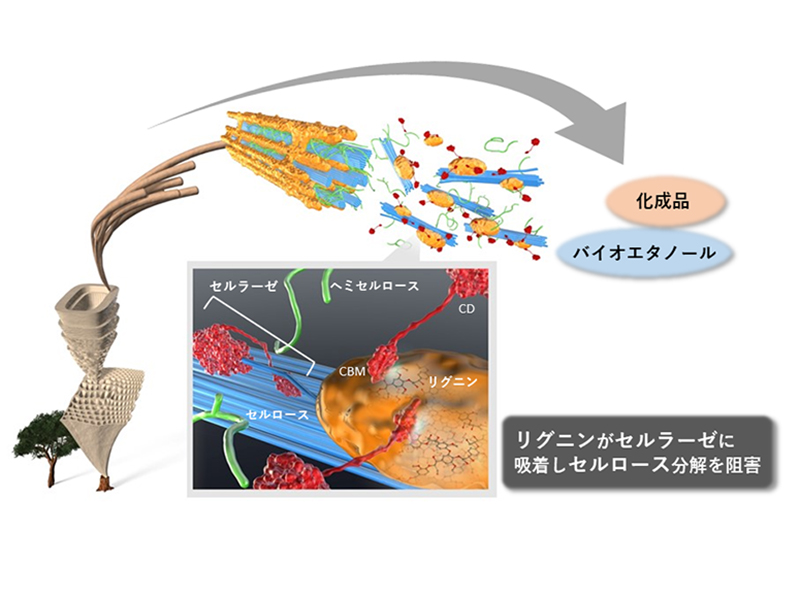
図:研究の概要図
書誌情報
【DOI】https://doi.org/10.1038/s41598-018-38410-9
【KURENAIアクセスURL】http://hdl.handle.net/2433/236471
Yuki Tokunaga, Takashi Nagata, Takashi Suetomi, Satoshi Oshiro, Keiko Kondo, Masato Katahira & Takashi Watanabe (2019). NMR Analysis on Molecular Interaction of Lignin with Amino Acid Residues of Carbohydrate-Binding Module from Trichoderma reesei Cel7A. Scientific Reports, 9:1977.
詳しい研究内容について
―バイオマス変換や酵素科学に貢献―概要京都大学大学院農学研究科 徳永有希 博士課程学生と京都大学生存圏研究所 渡辺隆司 同教授は、京都大学 エネルギー理工学研究所 永田崇 准教授、片平正人 同教授らと共同で、植物バイオマス由来のリグニンとセ ルラーゼの結合を分子レベルで包括的に解析することに、はじめて成功しました。木材や草本などの非可食バイオマスを酵素糖化発酵によりバイオ燃料や有用化学品原料に変換する際には、セルロースの分解酵素であ るセルラーゼの投入量をいかに減らすかが、プロセス実現のボトルネックとなっていました。分解物に共存す るリグニンは、セルラーゼに吸着して、酵素活性を強く阻害しますが、これまで、リグニンとセルラーゼの相互作用の分子レベルでの知見は限られていました。本研究は、セルラーゼの構成要素である糖質結合モジュー ル (CBM)とリグニンの結合に関与するアミノ酸を包括的に NMR (核磁気共鳴)で解析したはじめての研究で あり、リグニンにより阻害を受けにくい酵素の開発、バイオマス前処理法の開発につながる成果です。
本研究成果は、2019 年 2 月 13 日に国際学術誌「Scientific Reports」のオンライン版に掲載されました。
 1.背景
1.背景有限な化石資源に代わって、木材や草本などの再生可能な非可食バイオマスからバイオ燃料や化学品原料を 製造するプロセスの実現が求められています。非可食バイオマスの変換では、多糖分解酵素であるセルラーゼ を用いてセルロースをグルコースまで分解した後、生成したグルコースを発酵菌でエタノールなどの有用物質 に変換する方法が重要です。しかし、このプロセスにおいて、セルラーゼがセルロースだけでなく共存するリ グニンにも吸着し阻害されることが大きな問題となっています。特にセルラーゼを構成するタンパク質ユニッ 2 トである CBM がリグニンへの吸着に大きく影響することが知られていますが、その詳細な結合メカニズムは 十分に解明されていません。CBM-リグニン間の相互作用を解明する取り組みは数多くなされているものの、 セルラーゼの活性 吸着試験に基づいた間接的な解析に留まり、CBM の直接的な解析や分子レベルでの結合 部位の特定は困難でした。2.研究手法・成果
本研究ではセルラーゼ生産菌として工業的に最も重要な糸状菌 Trichoderma reesei が分泌するセルラーゼ (Cel7A)の CBM1 に着目し、大腸菌を用いて正常フォールディングした状態で CBM1 を発現 精製しました。 得られた CBM1 にスギまたはユーカリから抽出したリグニンを加えて 2 次元 NMR で相互作用解析を行い、 リグニンと相互作用している部位をアミノ酸残基レベルで包括的に解明することに初めて成功しました。本研 究結果は CBM1 の単独取得により直接的な解析を可能にしていることに加え、リグニンとの結合を分子レベ ルで理解するうえで不可欠な知見を与えるという点で方法論としても重要です。
3.波及効果、今後の予定
非可食バイオマスの酵素糖化分解を効率的に達成するために、リグニンへの吸着を抑制したセルラーゼの開 発が有効です。そして、それら有用酵素のエンジニアリングには、本研究の提示するリグニン-CBM1 間吸着 の理解が役立ちます。現在、CBM1 とリグニンの相互作用をより詳細に行うとともに、リグニン側の相互作用 部位の解析を進めており、CBM1 側とリグニン側の双方から吸着メカニズムの理解を目指しています。
4.研究プロジェクトについて
本研究は、京都大学生存圏研究所とエネルギー理工学研究所の共同研究であり、科学研究費補助金、生存圏 科学の共同利用 共同研究拠点、ゼロエミッションエネルギー研究拠点のサポートを受けて実施されました。
<研究者のコメント>
リグニンという高分子は植物種や生育環境によって全く異なる構造を有し、物理化学的な処理によってもそ の構造を複雑化させます。従って酵素と多様な結合をするため、その吸着メカニズムは長年にわたって難解と されてきました。本研究をもとに複雑雑多なリグニン構造と酵素との吸着を説明する法則を見出し、バイオマ ス変換の課題が克服できることを願っています。
<用語解説>
リグニン:セルロースに次いで豊富に存在する有機資源。芳香族ポリマーであり植物細胞壁全般に存在する。 バイオマス変換においてリグニンは酵素に吸着して、酵素活性を阻害するが、その吸着部位や吸着メカニ ズムは十分解明されておらず、阻害を受けにくい酵素開発の戦略も立てられていない。
セルラーゼ:地球上で再生産量をほこるセルロースの加水分解酵素。カビのセルラーゼの多くは、触媒ドメイ ンと糖質結合モジュール(CBM)がリンカーでつながった構造をとっている。CBM は、リグニンに吸着す るものが多い。
NMR 法:核磁気共鳴分光法。物質の分子構造解析、相互作用解析などに用いられる。
<論文タイトルと著者>
タイトル:NMR Analysis on Molecular Interaction of Lignin with Amino Acid Residues of CarbohydrateBinding Module from Trichoderma reesei Cel7A
著 者:Yuki Tokunaga, Takashi Nagata, Takashi Suetomi, Satoshi Oshiro, Keiko Kondo, Masato Katahira & Takashi Watanabe
掲 載 誌:Scientific Reports DOI:10.1038/s41598-018-38410-9



