2019-03-14 東京大学大学院薬学系研究科,次世代天然物化学技術研究組合,日本医療研究開発機構
がんは、遺伝子に変異が生じてタンパク質の機能が異常になり発症する疾患であり、抗がん剤の開発にはタンパク質の機能メカニズムを原子レベルで理解することが重要です。細胞増殖や細胞骨格の形成を担うRac1 (Ras-related C3 botulinum toxin substrate 1) は、種々のがん細胞で変異が見出される強力ながん遺伝子であり、抗がん剤の有効な標的分子であると考えられています。しかしながら、Rac1活性化の分子機構や、薬剤が作用しうる部位についての知見が不足しているため、Rac1を標的とする抗がん剤の合理的設計は極めて困難でした。
次世代天然物化学技術研究組合及び東京大学大学院薬学系研究科 嶋田一夫教授の研究グループは、タンパク質の構造多型を解析可能な核磁気共鳴(Nuclear magnetic resonance, NMR)法を用いてRac1発がん性タンパク質の恒常活性化が構造多型の変化により生じていることを明らかにしました。さらに、既知のRac1立体構造において見出されていなかった隠れた薬剤結合部位を発見することに成功しました。これにより、Rac1を標的とした抗がん剤の合理的設計が可能になることが期待されます。また本研究の戦略に基づき、薬剤の設計が困難であった創薬標的タンパク質においても、薬剤結合部位を新たに見出すことにより薬剤設計が可能になり、医薬品開発が大きく加速することが期待されます。
本研究成果は、米国科学雑誌『Science Advances』のオンライン速報版に、3月13日(水)14時(米国東部標準時)付で掲載されます(日本時間3月14日(木)午前4時)。
研究開発のポイント
- Rac1にはグアニンヌクレオチドやマグネシウムイオンに対する親和性が異なる複数の構造間の多型が存在すること、そして発がん性変異体では構造多型が変化し、ヌクレオチドとマグネシウムイオンの解離が促進し活性化状態に移行しやすい「開構造」の割合が増大していることで、恒常的な活性化が生じていることを明らかにした。
- 本研究で明らかとしたRac1の開構造において、既知のRac1立体構造では見出されていない、隠れた薬剤結合部位が存在することを明らかにした。
- 隠された薬剤結合部位の探索により、薬剤設計が困難だった分子標的についても創薬アプローチが可能になり、新たな医薬品開発が加速することが期待される。
研究概要
低分子量グアニンヌクレオチド結合タンパク質(Gタンパク質)の一種であるRac1 (Ras-related C3 botulinum toxin substrate 1) は細胞増殖や細胞骨格の形成を担うタンパク質です。これまでに悪性黒色腫、乳がん、および慢性骨髄性白血病などの細胞群を対象とした遺伝子解析において、Rac1の遺伝子変異が見出されており、Rac1は強力ながん化能を有する発がん性遺伝子であることが明らかにされています。正常なRac1タンパク質は、適切な刺激を受容することで活性化状態に移行し、細胞増殖などの生理応答を引き起こします。一方、がん遺伝子産物である発がん性変異体では、刺激を受容していないときにも活性化し続けることで細胞増殖を過剰に亢進し、がん化を引き起こします。これまでに、立体構造の観点から発がん性変異体で恒常的な活性化が生じる機構が調べられてきましたが、発がん性変異体の立体構造に基づく知見は不足しており、詳細な機構は明らかになっていませんでした。また、Rac1を始めとする低分子量Gタンパク質群は一般的に、分子表面に薬剤が結合しうるポケットが存在しないことが知られており、薬剤の設計が困難(undruggable)な創薬標的であると考えられています。これらの問題のために、Rac1は有効な抗がん剤の標的タンパク質でありながらも、それを標的とする抗がん剤の開発は極めて困難でした。
本研究では、発がん性変異体における恒常的な活性化は、Rac1の静的な立体構造の違いでは説明できず、その動的性質の違いが深く関係しているのではないかと考えました。そこで、タンパク質の動的構造を、生理条件下である溶液環境中で解析可能な核磁気共鳴(Nuclear magnetic resonance, NMR)法を用いて、Rac1の正常タンパク質と発がん性タンパク質を詳細に比較しました。
その結果、Rac1にはグアニンヌクレオチド、ならびに補因子であるマグネシウムイオンの結合部位を形成する、スイッチ1と呼ばれる領域に、およそマイクロ秒の時定数で遷移する構造多型が存在することを明らかにしました。さらに、Rac1の活性化を阻害する阻害タンパク質結合状態、ならびに活性化が減弱する変異体とのNMRスペクトルの比較から、Rac1に内在する構造多型は、X線結晶構造解析から得られた既知の立体構造に対応し、ヌクレオチドとマグネシウム結合部位がスイッチ1により覆われた「閉構造」と、ヌクレオチドならびにマグネシウムイオンの解離が促進することで活性化状態に移行しやすい「開構造」との2種類の構造で説明可能であることを示しました。そして、発がん性変異体では開構造を形成する割合が大きく増大していることが示され、このことによって恒常的な活性化が生じていることを明らかにしました。さらに、タンパク質への部位特異的なラジカル修飾反応と、それに伴って生じるNMRシグナルの減弱を利用した原子間距離測定を多数行うことで、開構造のモデル構造を構築することに成功しました(図1)。得られたモデル構造に基づき、開構造ではスイッチ1領域が大きく開き、ヌクレオチドとマグネシウムイオンが解離しやすい構造であること、そして既知の閉構造には見出されない隠れた薬剤結合部位が存在することを明らかにしました(図2)。
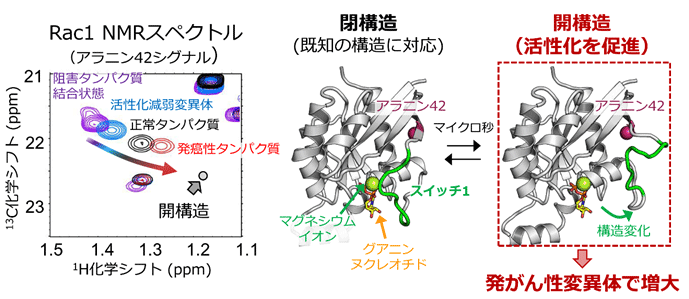
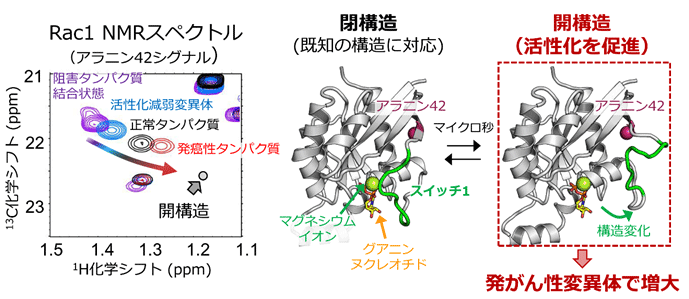
図1.(左) 活性化能が異なる条件で観測したRac1のアラニン42シグナルのNMRスペクトルの比較
発がん性変異体タンパク質では、開構造の化学シフト値に近い値を示し、開構造の存在割合が増大していることが示された。(右)既に明らかとされているRac1の構造に対応する閉構造と、本研究で明らかとなった開構造との比較。
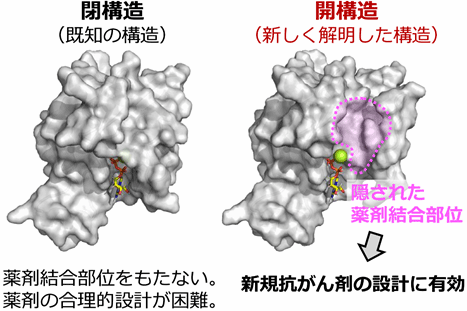
図2. Rac1閉構造と、本研究で明らかとなった開構造を分子表面プロットで比較した
既知の閉構造は薬剤の結合部位をもたない一方、開構造では隠された薬剤結合部位が存在することが明らかとなった。
以上の結果は、Rac1に内在する構造多型がその機能と密接に関連していること、そして構造多型の変化が、細胞のがん化を引き起こす分子機構であることを示しています。また本研究で明らかとした開構造において、既知のRac1立体構造では見出されていなかった薬剤結合部位が新たに形成されていることを明らかにしました。この新たに見出された薬剤結合部位に適合する化合物を設計することにより、Rac1を標的とする抗がん剤の開発が可能になることが期待されます。
本成果は、NMR法により見出されるタンパク質の構造多型が、タンパク質の機能を理解するうえで重要であることを示すのみならず、構造多型を解析することによって既知の立体構造には存在しない隠された薬剤結合部位を新たに発見可能であることを立証するものです。本研究で示された研究戦略を応用することによって、他の創薬標的タンパク質、特に薬剤結合部位が未知のタンパク質を対象とした創薬研究が可能になり、医薬品開発が大きく加速することが期待されます。
注釈
- 1)Gタンパク質
- グアニンヌクレオチド結合タンパク質(Gタンパク質)は、グアノシン2リン酸が結合した不活性型状態と、グアノシン3リン酸が結合した活性化状態とを遷移することで、細胞内のシグナル伝達を担うタンパク質である。生命活動に必須な多様な生理応答を担っており、その遺伝子変異ががん化を引き起こす例が数多く知られている(Gタンパク質αサブユニット、低分子量Gタンパク質Rasなど)。
- 2)核磁気共鳴(Nuclear Magnetic Resonance, NMR)法
- NMR法は、タンパク質を構成する水素、炭素、窒素原子の核スピンとラジオ波との相互作用を利用することで、タンパク質の立体構造ならびに構造多型を解析する手法である。他のタンパク質立体構造解析法であるX線結晶構造解析法やクライオ電子顕微鏡法と比較して、タンパク質が活性を発揮する溶液条件下において、その機能と関連するタンパク質の運動性や構造多型の情報を得られることを特徴とする。
特記事項
※本研究成果は、米国科学雑誌『Science Advances』に掲載されます。
※この研究は、日本医療研究開発機構(AMED)次世代治療・診断実現のための創薬基盤技術開発事業「中分子シミュレーション技術の開発」、経済産業省の支援によって行われました。
論文情報
- DOI:
- 10.1126/sciadv.aav8945
お問い合わせ先
本資料の内容に関するお問い合わせ先
東京大学 大学院薬学系研究科
教授 嶋田 一夫(シマダ イチオ)
取材対応窓口、資料請求など
東京大学 大学院薬学系研究科
教授 嶋田 一夫(シマダ イチオ)
次世代天然物化学技術研究組合
事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 医薬品研究課
次世代治療・診断実現のための創薬基盤技術開発事業担当