2021-06-10 理化学研究所
理化学研究所(理研)環境資源科学研究センター触媒・融合研究グループの江澤哲也特別研究員(研究当時)、五月女宜裕専任研究員(開拓研究本部袖岡有機合成化学研究室専任研究員)、袖岡幹子グループディレクター(開拓研究本部袖岡有機合成化学研究室主任研究員)らの研究グループは、ニッケル錯体触媒[1]を用いて、基質の異性化[2]を活用したα-ケトエステルエノラート[3]とニトロン[4]とのジアステレオ収束的[5]な(3+2)環化付加型反応[6]の開発に成功しました。
本研究成果は、医薬や農薬の開発する際のビルディングブロック[7]として重要な連続不斉点を持つ複雑なキラル分子(不斉分子)の選択的供給に貢献すると期待できます。
今回、研究グループは、酵素の誘導適合[8]と呼ばれるコンフォメーション変化から発想を得て、触媒/基質の配位平衡、基質の異性化を伴う複雑な反応系における触媒的不斉反応[9]の開発を目指しました。開発したジアステレオ収束的な(3+2)環化付加型反応には、異性化が関与する複数の遷移状態[10]が考えられますが、さまざまな基質の組み合わせに対して有用であり、三つの連続する不斉炭素を持つ複素環化合物[11]を選択的に合成できます。また、実験化学と計算化学を組み合わせることで、複雑系において、ニッケル錯体触媒がどのように主生成物を選択的に与えるのかその仕組みを明らかにしました。
本研究は、科学雑誌『Journal of the American Chemical Society』の掲載に先立ち、オンライン版(6月9日付)に掲載されました。
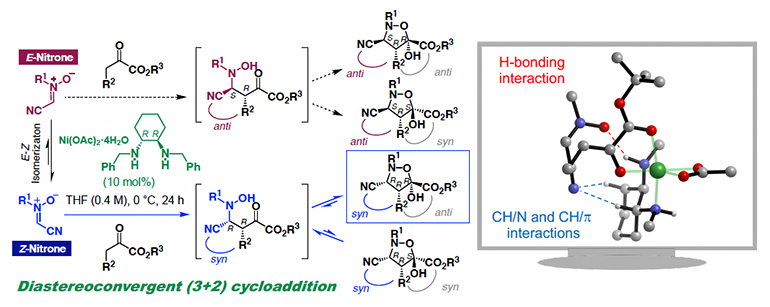
ジアステレオ収束的な(3+2)環化付加型反応
背景
右手と左手の関係のように、実像と鏡像が重ならない分子を「キラル分子(不斉分子)」といい、実像と鏡像に相当する分子同士を鏡像異性体(エナンチオマー)と呼びます。生体に存在する核酸(DNA、RNA)はD体[12]の糖で構成され、タンパク質は主にL体[12]のアミノ酸で構成されます。そのため、これらの生体高分子と選択的に相互作用するキラル分子は、医薬や農薬の開発する際のビルディングブロックとして欠かせません。
微量の分子触媒[13]を用いて有用なキラル分子の供給する触媒的不斉反応は、持続可能なモノづくりを実現するために、最も理想的な方法の一つです。基質と分子触媒は、基質と酵素との関係のように、鍵と鍵穴の関係に例えられてきました。また、副反応が生じる反応経路の数を減少させるために、構造変化の少ない分子触媒と基質の組み合わせに焦点が向けられ、実験的に得られた立体選択性は、立体反発(立体障害)と呼ばれる近接して存在する原子間による反発力により主に説明されてきました。
今回、研究グループは、酵素と基質とが複合体を形成する過程におけるコンフォメーション変化(誘導適合)から発想を得て、基質の異性化を伴うより複雑な反応系における触媒的不斉反応の開発を目指しました。
研究手法と成果
2017年、袖岡幹子主任研究員らはニッケル錯体触媒を用い、α-ケトエステル[3]と環状(E)-ニトロンとの(3+2)環化付加型反応の開発を報告していました注1)。
電子求引基で共役したニトロンは炭素-窒素二重結合が容易に異性化し、(E)-ニトロンと(Z)-ニトロンの幾何異性体[14]の混合物として存在することが知られています。しかし、これらの異性体を識別することは困難であるため、触媒的不斉(3+2)環化付加型反応では、異性化可能なニトロンを用いた場合、複数のジアステレオマー[15]と呼ばれる立体異性体が生成物として得られることが問題でした。研究グループは、ニッケル錯体触媒/エノラート/ニトロンの三成分複合体において、(E)-ニトロンが反応する遷移状態と(Z)-ニトロンが反応する遷移状態との間のエネルギー差が大きければ、一方の異性体から反応が優先的に進行し、所望のジアステレオマーを選択的に得られるはずだと考えました。
まず、酢酸ニッケルとジアミン配位子から調整したニッケル錯体触媒を用いて、(3+2)環化付加型反応におけるニトロンの置換基(R)を検討した結果、C-CNニトロンを用いた場合に、これまで報告例のないsyn,anti体のジアステレオマーが高い選択性で得られることを見いだしました(図1)。この結果は、ニッケル錯体触媒を用いてsyn,anti体を選択的に合成するためには、ニトロンのニトリル基(-CN)が重要であることを示しています。
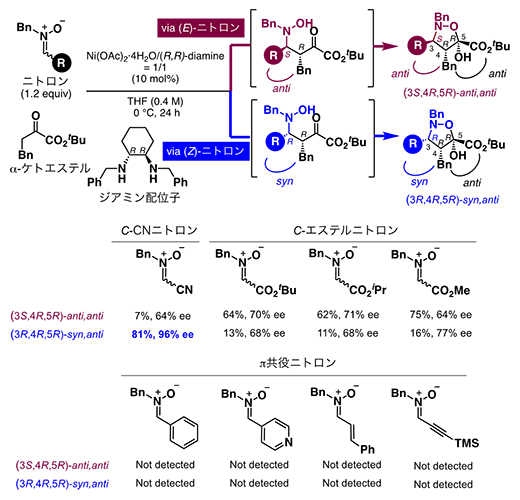
図1 (3+2)環化付加型反応におけるニトロンの置換基(R)の検討
C-CNニトロンおよびC-エステルニトロンは、二重結合が容易に異性化し(E)-ニトロンと(Z)-ニトロンの混合物として存在する(波線は異性体の混合物であることを意味する)。一方、その他のπ共役ニトロンは、(Z)-体を単離できる。C-CNニトロンの(3+2)環化付加型反応では、syn,anti体が主生成物として得られC-エステルニトロンではanti,anti体が主生成物として得られる。その他のπ共役ニトロンを用いた場合には、(3+2)環化付加型反応は進行しない。これらの結果は、ニッケル錯体触媒を用いてsyn,anti体を選択的に合成するためには、ニトロンのニトリル基(-CN)が重要であることを示している。
注1)2017年4月6日プレスリリース「ニッケル錯体触媒の電子構造を可視化」
次に、さまざまな置換基を持つC-CNニトロンとα-ケトエステルについて、30種類以上の組み合わせを検証した結果、いずれにおいても、反応条件を精査することなく、高い選択性で所望のsyn,anti体の複素環化合物を選択的に合成することができました(図2-i)。
さらには、キラル置換基(黄色)を持つC-CNニトロンを用いる触媒制御での多様性反応を実現しました。従来、キラル基質を用いる触媒的不斉反応では、キラル触媒とキラル基質の間にmatch/mismatchの関係が生じる(鍵と鍵穴がはまらない)ことが問題となります。そのため、鏡像の関係にある二つの異なる分子触媒から、それぞれ二つのジアステレオマー[(3R, 4R, 5R)体と(3S, 4S, 5S)体]を選択的に合成することは困難であると考えられてきました。しかし、本触媒系では、キラルなニトロンに対して(R,R)-ジアミン配位子を用いた場合には(3R, 4R, 5R)体が得られ、一方(S,S)-ジアミン配位子を用いた場合には(3S, 4S, 5S)体が高い選択性で得られることが示されました(図2-ii)。
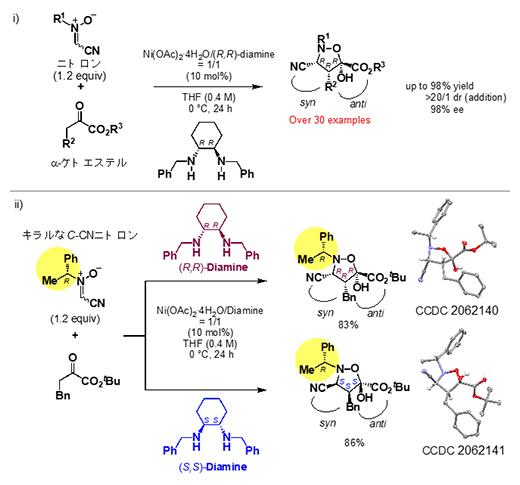
図2 さまざまな基質を用いたジアステレオ収束的な(3+2)環化付加型反応
i)通常の触媒的不斉反応では、置換基に応じて反応条件を最適化する必要がある。これに対し、開発した反応では、30種以上の組み合わせに対して、反応条件を精査することなく、高いエナンチオおよびジアステレオ選択性で所望のsyn,anti体を選択的に合成できた。
ii)本触媒系では、キラル置換基(黄色)を持つニトロンを基質とすることも可能である。(R,R)-ジアミン配位子を用いた場合には(3R, 4R, 5R)体を与え、一方(S,S)-ジアミン配位子を用いた場合には(3S, 4S, 5S)体を与える。
次に、基質の異性化を伴う複雑な反応条件下、ニッケル錯体触媒が立体選択的に反応を進行させる仕組みを理解するために、密度汎関数計算[16]による解析を行いました。開発した(3+2)環化付加型反応では、i)α-ケトエステルの脱プロトン化、ii)ニトロンへの付加、iii)環化が連続的に進行することで、生成物を与えると考えられます。
まず、α-ケトエステルの脱プロトン化について検討しました。研究グループは、X線結晶構造解析により、ニッケル錯体触媒の構造を明らかにしていました(図3-i)。Ni-O4(Niとアセテート配位子の酸素O4)の結合距離が著しく長いため、解離しやすいのが特徴です。解離により生じるアセテートアニオン(アニオンは陰イオンの意味)がプロトン(H+)を引き抜く塩基として働き、α-ケトエステルの脱プロトン化(β位の炭素と水素の結合の切断)を促進することで、ニッケル-エノラートが生じると考えられます。
そこで、ニッケル/α-ケトエステルの配位様式(モードA:エステルカルボニル(ピンク)が紙面の垂直方向に配位、モードB:エステルカルボニル(ピンク)が紙面の水平方向に配位)と、エノラートの幾何異性体(EとZ)の組み合わせを考慮し、四つのエノラート(A-E、A-Z、B-E、B-Z)の生成過程を検討しました(図3-ii)。その結果、いずれにおいても、原系よりも生成系のエネルギーが高い(ΔG > 0)吸熱的反応であり、四つのエノラートは平衡関係にあることが示唆されました。
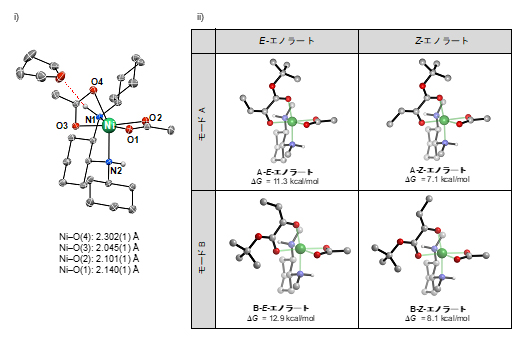
図3 ニッケル錯体触媒と想定されるニッケル-エノラートの構造
i)X線結晶構造解析により既に報告しているニッケル錯体の構造(CCDC 1482739)。Ni-O4の結合距離(黄線)が著しく長いため解離しやすい。配位子上のN(1)-Hは、溶媒のテトラヒドロフランの酸素(O)と水素結合している(赤破線)。
ii)想定されるニッケル-エノラートの構造。モードA: エステルカルボニル(ピンク)が紙面の垂直方向に配位。モードB:エステルカルボニル(ピンク)が紙面の水平方向に配位。
次に、ニトロンへの付加/環化反応について検討しました。ニッケル錯体のX線結晶構造では配位子上のN(1)-Hは溶媒のテトラヒドロフランの酸素(O)と水素結合していることから(図3-i)、(3+2)環化付加型反応では、テトラヒドロフランがニトロンと入れ替わり反応が進行すると考えられます。これらの知見に基づき、得られたエノラート4種(図3-ii)とニトロンの異性体2種の組み合わせについて、計8種の反応経路を検討しました。その結果、A-Zエノラートと(Z)-ニトロンが反応する経路、A-Z/Zの遷移状態(TS-A-Z/Z)の活性化エネルギー(14.4kcal/mol)が最も低く、これにより付加/環化が連続的に進行し、syn,anti体が優先して生成することが示されました(図4)。これらの計算結果は、実験結果を再現しています。
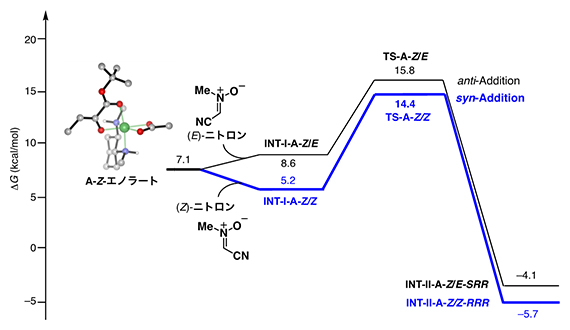
図4 密度汎関数計算による反応機構解析
密度汎関数計算により、ニッケル錯体触媒がどのようにsyn,anti体を選択的に与えるのか反応機構を解析した。想定される8種の経路のうち、図では、最も活性化エネルギーが小さな二つの経路を示している。syn,anti体を与えるA-Z/Zの遷移状態(TS-A-Z/Z)の活性化エネルギー(青線)が最も小さく、syn,anti体が選択的に生成されると考えられる。
最後に、なぜTS-A-Z/Zの活性化エネルギーが最も小さくなるのか、得られた遷移構造から考察しました(図5)。TS-A-Z/Zでは、ニトリル基は配位子の二つのHとの原子間距離が短いことが分かります。一方、TS-A-Z/Eでは、ニトリル基は配位子と離れて位置しています。TS-A-Z/Zについて、NBO (Natural Bond Orbital: 自然結合軌道) 解析[17]を行った結果、ニトロンのニトリル基は配位子の二つのC-Hと、CH/N、CH/π相互作用により、3.9kcal/mol安定化されることが明らかになりました。
これまで多くの場合、実験的に得られた立体選択性は、立体反発により説明されてきました。しかし、これらの結果は、配位平衡や二重結合の異性化を伴う複雑系においても、分子触媒と反応基質との弱い相互作用の協調により、遷移状態での配向性や構造を精密に制御できることを示しています。
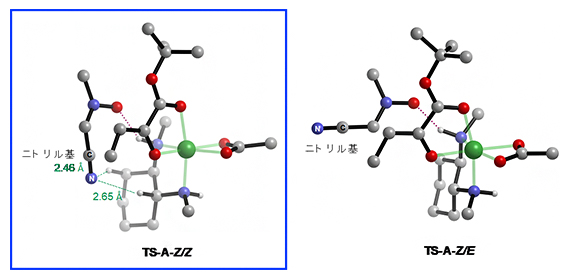
図5 TS-A-Z/EとTS-A-Z/Zの遷移構造の違い
左)ニトロンのニトリル基(黄色)は、配位子の二つのHの近くに位置する。NBO解析を行い、電子のドナー・アクセプター相互作用を算出した結果、CH/N 相互作用(アクセプター: 配位子のC-Hの反結合性軌道、ドナー: ニトリルの窒素の孤立電子対)、CH/π相互作用(アクセプター:配位子のC-Hの反結合性軌道、ドナー: ニトリルの三重結合のπ電子)により、計3.9kcal/mol安定化されることが分かった。
右)ニトロンのニトリル基(黄色)は配位子と離れて位置している。
今後の期待
今回研究グループは、ニッケル錯体触媒を用い、二重結合が異性化可能なエノラートとニトロンとのジアステレオ収束的な(3+2)環化付加型反応の開発に成功しました。得られる生成物はさまざまなキラルビルディングブロックに変換できることから、連続不斉点を持つ複雑なキラル分子の選択的供給に貢献すると期待できます。また、どのように触媒活性種が異性体を識別するかについての知見は、複雑系において触媒的不斉反応を開発するための有用な設計指針になることが期待できます。
今回の研究は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[18]」のうち「7.エネルギーをみんなにそしてクリーンに」と「12. つくる責任つかう責任」に大きく貢献する成果です。
補足説明
1.ニッケル錯体触媒
触媒は一般に金属錯体触媒と非金属(有機)触媒とに分類される。本研究で用いているニッケル錯体触媒は中心のNi(Ⅱ)に対して六つの配位子が配位した八面体構造を持つ(図3参照)。
2.異性化
組成が変化することなく、原子の配列や配向性が変化することの総称。異性化により生じる異なる分子のことを異性体と呼ぶ。
3.α-ケトエステル、α-ケトエステルエノラート
α-ケトエステルは、エステルの(-CO2R)のα位にケトン基(=CO)を持つ化合物の総称。α-ケトエステルエノラートは、β位の炭素と水素の結合の切断により生じる、炭素?炭素二重結合上の炭素に酸素アニオン(アニオンは陰イオンの意味)が結合した活性種の総称。置換基が酸素アニオンと逆の方向に配置された異性体が(E)-エノラートであり、置換基が酸素アニオンと同じ方向に配置された異性体は(Z)-エノラートである。
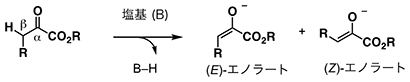
4.ニトロン
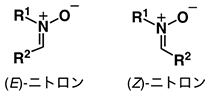
1位に求核性の酸素アニオン(アニオンは陰イオンのこと)、3位に求電子性の炭素を持つ1,3-双極子の一つ。以下に示す構造を含む化合物群の総称。炭素上の置換基(R2)が酸素アニオンと逆の方向に配置された異性体が(E)-ニトロンであり、炭素上の置換基(R2)が酸素アニオンと同じ方向に配置された異性体は(Z)-ニトロンである。
5.ジアステレオ収束的
異性体が複数含まれる原料を用いる反応では、それぞれの異性体から反応が進行し、複数のジアステレオ異性体(ジアステレオマー)を生成物として与える場合が多い。本研究で用いる基質の組み合わせでは、原理的に計4種のジアステレオマー、それらの鏡像異性体(エナンチオマー)を合わせて計8種の立体異性体が生じる。原料の異性体の構造を一つに収束させ、一つのジアステレオマーを生成物として得る反応をジアステレオ収束的な反応と呼ぶ。
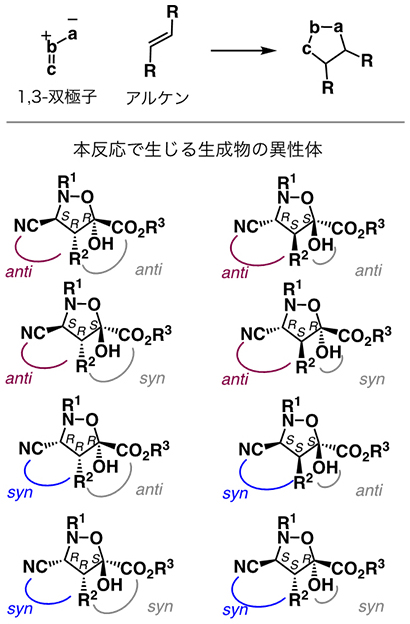
6.(3+2)環化付加型反応
1,3-双極子(3原子)とアルケン(2原子)との環化反応の総称。5員環を持つ生成物が得られる。用いる1,3-双極子とアルケンの置換基によって生じる生成物のジアステレオマーの数は異なる。
7.ビルディングブロック
医薬や農薬の多くは複雑な構造の化合物である。これらは、レゴやプラモデルのようにいくつかの部品から組み立てられることが多いため、この部品に相当する化学変換しやすい小分子をビルディングブロックと呼ぶ。
8.誘導適合
酵素と基質などの二つの分子が複合体を形成する際、それらのコンフォメーションが変化すること。
9.触媒的不斉反応
少量のキラル分子を触媒として用いることで、大量のキラル分子を合成する反応の総称。
10.遷移状態
反応が進行する際に最もエネルギーが高い状態のこと。遷移状態は、寿命が極めて短いため実験的には観測できない。計算化学により、その構造を可視化できる。
11.複素環化合物
環の中に少なくとも2種類の異なる元素を含む環式化合物の総称。医薬や農薬の多くに含まれる。
12.D体、L体
DL表記法は、アミノ酸や糖の右手と左手の関係の分子(鏡像異性体、エナンチオマー)を区別するために用いられる。
13.分子触媒
触媒機能を持つ低分子の総称。一般に金属錯体触媒と非金属(有機)触媒とに分類される。
14.幾何異性体
異性体の一つ。二重結合を持つ化合物では、二つの置換基(R1とR2)が逆の方向に配置された異性体がtrans体であり、二つの置換基(R1とR2)が同じ方向に配置された異性体はcis体である。α-ケトエステルエノラートやニトロンについては、E/Zで表記する場合が多い(補足説明[3]および[4]参照)。Eはドイツ語のentgegen(逆に)、Zはzusammen(いっしょに)に由来する。

15.ジアステレオマー
異性体の一つ。立体異性体のうち、鏡像異性体(エナンチオマー)でないものの総称。補足説明[5]参照では、鏡像異性体の対を右と左に示している。
16.密度汎関数計算
原子や分子などの物性を明らかにする量子化学計算手法の一つ。基底状態と遷移状態のエネルギー差が活性化エネルギーであり、これが最も小さな経路で反応は進行すると考えられる。
17.NBO(Natural bond orbital: 自然結合軌道)解析
自然結合軌道とは、電子密度が最大となるように計算された結合性軌道である。電子のドナー・アクセプター相互作用により得られる安定化エネルギーを定量できる。
18.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。(外務省ホームページから一部改変して転載)
研究グループ
理化学研究所
環境資源科学研究センター
触媒・融合研究グループ
特別研究員(研究当時) 江澤 哲也(えざわ てつや)
専任研究員 五月女 宜裕(そうとめ よしひろ)
(開拓研究本部 袖岡有機合成化学研究室 専任研究員)
グループディレクター 袖岡 幹子(そでおか みきこ)
(開拓研究本部 袖岡有機合成化学研究室 主任研究員)
分子構造解析ユニット
ユニットリーダー 越野 広雪(こしの ひろゆき)
(開拓研究本部 袖岡有機合成化学研究室 副主任研究員)
創発物性科学研究センター 物質評価支援チーム
チームリーダー 橋爪 大輔(はしづめ だいすけ)
開拓研究本部 袖岡有機合成化学研究室
研修生(研究当時) 足立 雅弥(あだち まさや)
テクニカルスタッフⅠ 赤壁 麻依(あかかべ まい)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「金属中心キラリティー内包型錯体が構築する多点不斉反応場の理解と制御(研究代表者:五月女宜裕)」、同挑戦的研究(萌芽)「触媒反応を駆使した生物活性シード創出への挑戦 (研究代表者:五月女宜裕)」、同基盤研究(B)「有機合成化学が切り拓くケミカルメチロームの新展開(研究代表者:五月女宜裕)」による支援を受けて行われました。
原論文情報
Tetsuya Ezawa, Yoshihiro Sohtome, Daisuke Hashizume, Masaya Adachi, Mai Akakabe, Hiroyuki Koshino, Mikiko Sodeoka, “Dynamics in Catalytic Asymmetric Diastereoconvergent (3 + 2) Cycloadditions with Isomerizable Nitrones and α-Keto Ester Enolates”, Journal of the American Chemical Society, 10.1021/jacs.1c02833
発表者
理化学研究所
環境資源科学研究センター 触媒・融合研究グループ
特別研究員(研究当時) 江澤 哲也(えざわてつや)
専任研究員 五月女 宜裕(そうとめ よしひろ)
(開拓研究本部 袖岡有機合成化学研究室 専任研究員)
グループディレクター 袖岡 幹子(そでおか みきこ)
(開拓研究本部 袖岡有機合成化学研究室 主任研究員)
報道担当
理化学研究所 広報室 報道担当