創薬候補物質の探索や早期疾患診断などに期待
2018/08/10 科学技術振興機構(JST),東京大学,日本医療研究開発機構(AMED)
ポイント
- デジタルバイオ計測は次世代のバイオ分析を牽引する革新的な技術基盤だが、計測のスループットに技術的な問題点を内在していた。
- マイクロチップの新技術により、デジタルバイオ計測の超並列化に成功した。
- 創薬候補物質の探索や早期疾患診断などの技術基盤としての応用展開が期待できる。
JST 戦略的創造研究推進事業において、東京大学 大学院工学系研究科の渡邉力也講師、同 大学院薬学系研究科の小松徹特任助教の研究グループは、標的物質の濃度勾配を形成するための機構を実装したマイクロ流路を内蔵するチップを新規に開発し、デジタルバイオ計測注1)の超並列化を実現することに成功しました。
デジタルバイオ計測は、数万個以上の微小な試験管を集積したマイクロチップを利用して、単一の生体分子から機能や物性を計測する手法であり、高い感度と高い定量性を実現しています。近年では、遺伝子診断や血液検査のための分析装置の技術基盤として活用されており、創薬・医療分野での産業応用への道筋が開拓されつつあります。しかし、計測のハイスループット化において技術的に大きな問題があり、現状では、デジタルバイオ計測に利用するマイクロチップは試験管が集積化していますが、試験管を並列利用することができず、計測のスループットを向上させることが極めて困難でした。
本研究グループは、デジタルバイオ計測の並列化を実現するため、標的物質の濃度勾配を形成する機構をマイクロチップへ実装し、チップ上の各試験管に対して、異なる組成の溶液を数秒間で封入する技術を確立しました。現在までに、1枚のチップを用いて、異なる溶液環境下でのデジタルバイオ計測を実現し、従来不可能であった試験管の並列利用による「デジタルバイオ計測のハイスループット化」に成功しました。
今回開発されたマイクロチップ技術は、従来のデジタルバイオ計測の汎用性を大きく拡張するものであり、創薬候補物質の探索や早期疾患診断などに向けた実用化への道筋を拓くものと期待されます。
本研究成果は、2018年8月9日(英国時間)に英国科学雑誌「Lab on a Chip」のオンライン版で公開されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
JST 戦略的創造研究推進事業 チーム型研究(さきがけネットワーク)
研究領域:「ライフサイエンス」(研究総括:菅野 純夫)
研究課題名:1分子機能カウンティングから紐解く高次生命科学
研究者:渡邉 力也(東京大学 大学院工学系研究科応用化学専攻 講師)
研究期間:平成29年12月~平成31年3月
<研究の背景と経緯>
半導体製造技術により、生体分子と親和性の高いマイクロチップが開発され、それらを基盤とした革新的なバイオ分析技術が実現しています。その中でも、デジタルバイオ計測は、マイクロチップを利用して、1個の生体分子から機能や物性を高感度かつ定量的に計測できる手法であり、Digital PCR注2)やDigital ELISA注3)に代表される先進生体分析装置の基盤技術として、創薬・医療分野でのさらなる応用発展が期待されています。
現在、デジタルバイオ計測における最大の課題は計測のスループットを改善することにあります。計測に利用するマイクロチップは数万個以上の試験管を集積化していますが、サイズが小さいためにそれらを並列利用することは技術的に難しく、従来のプレートリーダー法注4)に代表されるスループットの高い分析を実現することは困難でした。そのため、試験管の並列利用の実現によるデジタルバイオ計測の「ハイスループット化」は急務とされてきました。
<研究の内容>
本研究グループは、デジタルバイオ計測の超並列化を実現するため、マイクロチップ上の各試験管に異なる組成の溶液を封入する新規技術の開発とこれを用いたデジタルバイオ計測法の確立を目指しました。具体的には、標的物質の濃度勾配を形成する機構をマイクロチップへ実装し、チップ上の各試験管に異なる組成の溶液を封入する技術を開発しました。そして、酵素や膜たんぱく質を対象とし、超並列デジタルバイオ計測を実現することに成功しました。
1.物質濃度勾配の形成技術の新規開発
物質の濃度勾配を形成するため、これまでのデジタルバイオ計測に利用されてきたマイクロチップ(大きさ:24ミリメートル×32ミリメートル)の上に、シンプルな直線の流路(幅:2ミリメートル、高さ:0.3ミリメートル)を設置しました(図1)。マイクロチップには、容積が数フェムトリットル(フェムトは1000兆分の1)程度の均一な微小試験管を約10万個集積しています。
物質の濃度勾配は以下の手順で形成されます(図2)。まず、標的物質を含んだ水溶液で流路を満たした後、電動ピペットを用いて、任意の容量の希釈液を一定の流速で導入します。流路内の標的物質は移流拡散プロセス注5)により希釈され、流れ方向に沿って一直線に濃度勾配が流路の底面に形成されます。デジタルバイオ計測に利用する微小試験管は流路の底面に呈示されているため、流路内の濃度勾配に沿って、各試験管に含まれる標的物質の濃度も定量的に変化させることができます。最後に、各試験管に含まれる標的物質を封入するため、濃度勾配を形成した後ただちに脂質溶液を流路へ導入し、各試験管の開口部に人工生体膜注6)でふたをします。流路に導入する希釈液の容量や流速を制御することで、チップ上の各試験管に封入される標的物質の濃度を10倍から1000倍程度の範囲で連続的に変化させることができます。
従来のプレートリーダー法では、物質の濃度勾配を形成するには、溶液分注装置や複雑な構造を持つ流路を利用して各試験管に異なる組成の水溶液を個別に導入する必要があるため、計測の準備に数分から数時間を要していました。しかし、本技術では、1種類の希釈液を数秒間導入するだけで、異なる組成の水溶液を試験管に封入することができるため、計測の準備時間の大幅な短縮の実現につながりました。さらに、1本の流路と電動ピペットがあれば実験ができるため、分析装置への実装の際、コスト削減に貢献できるものと期待されます。
2.超並列デジタルバイオ計測の実現
新たに開発したマイクロチップを用いて、各試験管に異なる組成の溶液を封入し、デジタルバイオ計測の超並列化を実現しました(図3)。まず、上述の濃度勾配の形成機構を利用して、マイクロチップ上の各試験管に1分子の標的生体分子(例えば、酵素)と任意の濃度の基質を封入します。封入後、生体分子による基質の分解反応に伴い、試験管の中に反応生成物が蓄積し、濃縮されます。生体分子の反応に伴い蛍光を発する基質を利用すると、蛍光強度の増加速度から生体分子の反応速度を定量的に測定することができます。従来のバイオセンサーに汎用されてきた酵素(ALP注7))に対して、1枚のマイクロチップから、さまざまな基質濃度における反応速度を並列測定することに成功し、基質の結合速度定数などの性能を評価するために必要不可欠な基礎データを、簡便に取得できるようになりました。また、生体膜を各試験管に実装しているため、酵素だけでなく、市販薬の主な標的である「膜たんぱく質」におけるデジタルバイオ計測の超並列化にも応用できることを実証しています。本技術により、さまざまな生体分子を標的とした機能評価に関して、超並列計測の実現によるデジタルバイオ計測のハイスループット化の第一歩を確立しました。
<今後の展開>
従来、デジタルバイオ計測は高感度かつ定量的なバイオ分析基盤でしたが、今回のハイスループット化の実現により、基礎・応用研究における汎用性が大幅に拡張されました。今後、薬剤標的の探索、薬効の評価、早期疾患診断、およびバイオセンサーの評価などへのデジタルバイオ計測技術の実用化が強く期待されます。本成果は特許出願済みであり(特願2018-84809)、今後は渡邉講師が近年開発したマイクロリアクターチップ技術群(特許第6281834号、WO2016/199741、特願2017-040664、特願2017-131882)と共に実用化を希望する企業との研究開発を進めていく予定です。
<参考図>
![]()
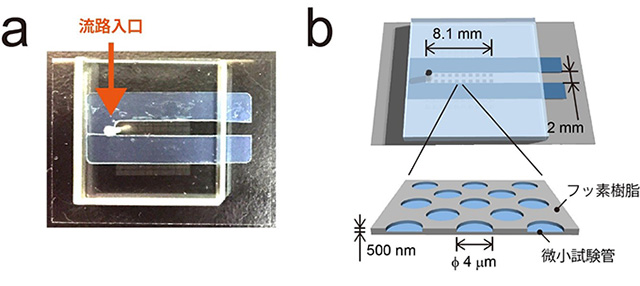
図1 直線流路を実装したマイクロリアクターチップ
(a)マイクロチップの外観。
(b)模式図。フッ素樹脂の薄膜の中に約10万個の微小試験管を集積している。試験管の大きさは、直径4マイクロメートル、高さ500ナノメートル。また、微小試験管アレイの左端から直線の流路を設置している(aの赤矢印:流路の入口)。流路の大きさは、幅2ミリメートル、高さ0.3ミリメートル。
![]()
図2 マイクロチップ上での標的物質の濃度勾配の形成
(a)流路の入口からの距離と微小試験管に封入された標的物質(緑色蛍光色素:Alexa488)の蛍光画像。
(b)流路の入口からの距離と試験管に封入される標的物質の希釈率の関係。導入する希釈液の容量および流速によって、標的物質の希釈率を制御することができる。
![]()
図3 ALPを標的とした超並列バイオ計測
異なる濃度の蛍光基質と1分子のALPを各試験管に閉じ込め、ALPによる加水分解反応を超並列デジタル計測した。本計測系では、蛍光基質自身は加水分解されないと蛍光を発しないため、ALPの加水分解に伴い試験管の蛍光強度が増加する。そして、蛍光の増加速度の解析からALPの活性を計測することができる。
(a)ALPを標的とした超並列バイオ計測の模式図。流路の入口からの距離に応じて、各試験管に封入される蛍光基質の濃度が異なる。
(b、c)計測開始から15分後の試験管の蛍光画像(緑色(真ん中の丸い部分))と蛍光強度の経時変化。流路入口からの距離、すなわち、試験管に封入した蛍光基質の濃度が高いほど分解された基質の量は多く、蛍光強度が高いことが分かる。
(d)封入した基質濃度とALPの加水分解速度の相関計測結果。加水分解速度と基質濃度は比例関係にあり、相関解析から基質の結合速度定数などの酵素の基礎情報を簡便に取得することができる。
<付記>
本研究の一部は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山 信治)における研究開発課題名「脂質輸送タンパク質の高感度機能解析にむけた生体膜マイクロチップの開発と創薬への応用」(研究代表者:渡邉 力也)の一環としても行われました。
<用語解説>
- 注1)デジタルバイオ計測
- 微小な試験管を集積化したマイクロチップを利用して、1個の生体分子から機能や物性を高感度かつ定量的に計測する手法。
- 注2)Digital PCR
- 微小な試験管内でPCR反応を行い、試料中の核酸の初期量などを分析する手法。
- 注3)Digital ELISA
- 抗体抗原反応を利用して1分子単位で抗原を検出する分析手法。
- 注4)プレートリーダー法
- 6個から1536個までの試験管を集積したプレートを利用し、各試験管を並列利用して生体反応の計測の処理能力を行う手法。プレートの大きさは、85.5ミリメートル×127.3ミリメートル。
- 注5)移流拡散プロセス
- 物質が流れ場の中を拡散していくこと。
- 注6)人工生体膜
- リン脂質を利用して人工的に形成される脂質2重膜の総称。
- 注7)ALP
- アルカリ性条件下でリン酸エステル化合物を加水分解する酵素(アルカリフォスファターゼ)の略である。ELISAによる抗原の検出の際、汎用される酵素の1つである。
<論文タイトル>
“High-throughput single-molecule bioassay using micro-reactor arrays with a concentration gradient of target molecules”
(標的物質の濃度勾配を実装したマイクロチップの開発と、それを用いた超並列デジタルバイオ計測技術の実現)
DOI:10.1039/C8LC00535D
<お問い合わせ先>
<研究に関すること>
渡邉 力也(ワタナベ リキヤ)
東京大学 大学院工学系研究科 応用化学専攻 講師
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
<AMEDの事業に関すること>
日本医療研究開発機構(AMED) 基盤研究事業部 研究企画課
<報道担当>
科学技術振興機構 広報課
東京大学 大学院工学系研究科 広報室
日本医療研究開発機構 経営企画部 企画・広報グループ