超高感度プロテオーム解析の実現に向けて
2018/07/31 理化学研究所,ストラスブール大学
理化学研究所(理研)生命機能科学研究センター細胞システム制御学研究ユニットのシモン・レクラーク研修生(研究当時)と谷口雄一ユニットリーダー、ストラスブール大学国立衛生医学研究所のユーリ・アーンツ助教授の国際共同研究チーム※は、細胞の中にあるほぼ全ての種類のタンパク質を蛍光色素でラベル化する手法とその評価法を開発しました。
本研究成果は、蛍光イメージングによる超高感度の「プロテオーム解析[1]」を実現し、タンパク質の異常を伴う疾患の超早期診断や未知のバイオマーカー[2]の発見に貢献すると期待できます。
生体内で起こる疾病や、細胞の分化状態などを精密に探る方法の一つにプロテオーム解析があります。プロテオーム解析では、生体内に存在する数千から数万種類のタンパク質を網羅的に測定した大規模データを用いて、多角的な観点から生体状態の分析・診断を行います。しかし、この解析に一般的に用いられている測定法(二次元電気泳動法[3]、質量分析法[4])は、分析や装置のコストが高く、解析にも時間を要し、感度も限られているという課題がありました。
今回、国際共同研究チームは、超高感度(単一分子感度)・低コストでのプロテオーム解析を目指し、ほぼ全ての種類のタンパク質を蛍光色素でラベル化する標識法と、「1分子蛍光イメージング法[5]」を応用したラベル化率の評価法を開発しました。本法をヒト培養細胞に適用したところ、さまざまな大きさのタンパク質を50~90%の高効率で蛍光ラベルできることを確認しました。
本研究は、米国の科学雑誌『Bioconjugate Chemistry』の掲載に先立ち、オンライン版(7月5日付け)に掲載されました。
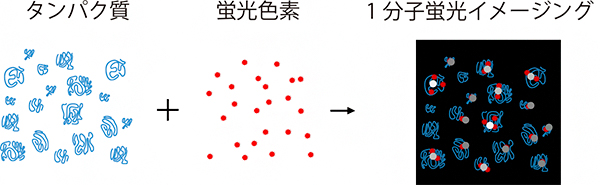
図 細胞から抽出したタンパク質のほぼ全てを蛍光色素でラベルし、1分子レベルで検出する
※国際共同研究チーム
理化学研究所 細胞システム制御学研究ユニット
ユニットリーダー 谷口 雄一(たにぐち ゆういち)
(科学技術振興機構(JST)さきがけ兼任研究者)
研修生(研究当時) シモン・レクラーク(Simon Leclerc)
仏国 ストラスブール大学 国立衛生医学研究所
助教授 ユーリ・アーンツ(Youri Arntz)
※研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ「統合1細胞解析のための革新的技術基盤(研究総括:浜地格)」による支援を受けて行われました。
背景
細胞の中には、その生物種に特徴的なゲノムDNAが存在し、その情報をもとに、生命機能を担う数千から数万種類にわたるタンパク質が生み出されます。近年、こうしたタンパク質の発現を網羅的に調べることで、細胞や個体がどのような状態にあるかを明らかにする「プロテオーム解析」と呼ばれる分析手法が注目を集めています。例えば、細胞がウイルスに感染したり、がん化したりする際には、細胞はそれに反応してさまざまなタンパク質の発現を変化させます。プロテオーム解析を行えば、ウイルス感染やがんの診断がより確実・効率的に行えるようになり、またどのタンパク質が発症に中心的な役割を果たしているかを明らかにできます。このため、プロテオーム解析は次世代医療の診断技術として、実用化が期待されています。
現在、プロテオーム解析を行うために、主に用いられている測定法は「質量分析法」と「二次元電気泳動法」です。質量分析法では、高電圧をかけた真空中で細胞内のタンパク質分子をイオン化し、このイオンを電気・磁気的に分離することで得られるシグナルからさまざまなタンパク質を検出します。しかし、装置が高価であり、多数の試料の測定には向かず、また検出感度も限られていることから、研究や診断への幅広い応用は進んでいません。
一方、二次元電気泳動法では、タンパク質を蛍光ラベル化した後に、電気泳動により分離を行って、タンパク質の種類によって異なる分離距離からさまざまなタンパク質を検出します。装置が安価であり、比較的手軽に解析が行えるというメリットがあります。しかし、現在の蛍光検出の方法では感度が十分ではなく、少数個しか細胞内に存在しない制御タンパク質などは検出できないことから、応用の範囲が限定されていました。
そこで、国際共同研究チームは、「1分子蛍光イメージング法」と呼ばれる顕微鏡技術に着目しました。この技術は、レーザーによる蛍光励起と、単一フォトン検出カメラによる蛍光検出を組み合わせることで、生体試料内に存在する蛍光分子の局在を1分子レベルで捉える超高感度のものです。一般的には細胞や組織の観察に用いられますが、二次元電気泳動の蛍光検出に用いることでタンパク質の超高感度検出が可能になると考えました。この技術でプロテオーム解析を行うには、細胞から抽出した全てのタンパク質を1分子レベルで蛍光標識する必要があります。しかし、タンパク質に蛍光色素を結合させる標準的な手法で、細胞内のさまざまな種類のタンパク質がどのくらいの割合で蛍光ラベル化されるのかについての明確なデータはこれまでありませんでした。
研究手法と成果
国際共同研究チームは、試料内に存在するタンパク質の蛍光ラベル化率を評価する方法の開発を行いました。まず、顕微鏡観察に用いるカバーガラスの表面上に、タンパク質を結合させるための基質を一定密度で塗ります。次に、蛍光ラベル化したタンパク質をこのカバーグラスに固着化させ、1分子蛍光イメージング顕微鏡を用いて撮影し、カバーガラス上の蛍光スポットの数をカウントします。一方、100%ラベル化率のポジティブコントロールとして、基質と結合する性質のある蛍光分子を十分量反応させたカバーグラスを作製します。また、0%蛍光ラベル化率のネガティブコントロールには、未処理のカバーガラスに試料を反応させたものを用います。そして、これらの蛍光スポット数から蛍光ラベル化率を決定します(図1)。
この評価法を用い、生体内タンパク質の標準試料であるBSA(ウシ血清アルブミン)[6]をモデルタンパク質として、より高い蛍光ラベル化率を達成するための試料作製方法を開発しました。蛍光色素との結合反応溶液のpHや還元剤、界面活性剤の濃度などの条件検討により、最も高い蛍光ラベル化率の条件を探した結果、82%という高いラベル率を達成することに成功しました(図2)。
さらにこの条件検討の過程で、タンパク質と蛍光色素との結合は単純なランダム(タンパク質に結合する色素数が0〜数個の間にゆるやかに分布)ではなく、反応条件により不均一(タンパク質に結合する色素数の分布が0か数個かに二極化)、もしくは均一(ラベル化率が高く、色素の結合数もほぼ一定)に制御できることが分かりました(図3)。
最後に、今回明らかになった最も効率の良い反応条件(BSAに対して82%のラベル化率)で、ヒト培養細胞内のタンパク質の蛍光ラベル化を行いました。ヒト培養細胞内には、大きさが10kDa(キロダルトン)[7]程度から250kDa程度までさまざまなタンパク質がありますが、それぞれの大きさのタンパク質に対して蛍光ラベル化率を測定したところ、いずれも50~90%の間に分布し、平均で71%という高率で蛍光ラベル化できることを確認しました。また、この反応条件では、各タンパク質に結合する蛍光色素の数は、蛍光色素の結合標的であるタンパク質内のアミノ基の数に依存していることが明確に確認できました(図4)。1分子蛍光イメージング法における、蛍光の強さとタンパク質の構造上の特徴の間に、一定の関係性を見いだせたことは、プロテオーム解析において重要な情報となります。
今後の期待
今回、1分子蛍光イメージング法を用いることで、細胞内の全種類のタンパク質をほぼ全分子レベルで検出することが原理的に可能なことを実証したことは、超高感度のプロテオーム解析の実現に大きくつながる成果です。特に1細胞レベルでのプロテオーム解析は、多数の細胞集団内にごく少数存在する病原性細胞を再現性よく発見・解析できることから、がんなどの病気の超早期発見や、極微量検体による診断などへの応用が期待できます。
今後、装置や解析の低コスト化、測定時間の短縮・並列化が進めば、臨床現場における高精度プロテオーム解析の普及が加速すると考えられます。質の高いプロテオームデータが蓄積することで、新たな疾患バイオマーカーの発見や、将来的には、大規模なタンパク質発現情報を学習した人工知能(AI)が病気の診断を行うことも、実現可能になるかもしれません。
原論文情報
Simon Leclerc, Youri Arntz, Yuichi Taniguchi, “Extending Single Molecule Imaging to Proteome Analysis by Quantitation of Fluorescent Labeling Homogeneity in Complex Protein Samples”, Bioconjugate Chemistry, 10.1021/acs.bioconjchem.8b00226
発表者
理化学研究所
生命機能科学研究センター 細胞システム制御学研究ユニット
ユニットリーダー 谷口 雄一(たにぐち ゆういち)
研修生(研究当時) シモン・レクラーク(Simon Leclerc)
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- プロテオーム解析
- 特定の状態にある細胞や組織、個体に着目し、それらで発現しているタンパク質の全て(プロテオーム)を明らかにする研究手法。
-
- バイオマーカー
- 生体の状態を客観的に評価するために利用できる分子の総称。臨床分野では、特定の疾患に特徴的な分子や遺伝子発現を指すことが多い。
-
- 二次元電気泳動法
- タンパク質や核酸などの生体分子が電場中で移動する性質を利用し、調べたい試料中にどのような種類の分子が存在するかを分離する方法を電気泳動法という。2段階の電気泳動によりタンパク質などを分離する手法が二次元電気泳動法である。一般的なタンパク質の分離では、1回目(1次元目)で等電点電気泳動、2回目(2次元目)一般的に行なわれ、数千のスポットとしてタンパク質を分離できる。
-
- 質量分析法
- 物質をイオン化し、そのイオンを検出することにより、原子や分子の質量を推定する分析法。
-
- 1分子蛍光イメージング法
- 蛍光分子1個が出す光を顕微鏡観察することができる高感度蛍光観察技術。一般的に全反射蛍光顕微鏡とイメージング用超高感度カメラから構成される。
-
- BSA
- ウシ血清アルブミン。ウシの血清から精製されたタンパク質で、天然由来のタンパク質試料として生化学実験などで頻繁に利用される。BSAは、Bovine Serum Albuminの略。
-
- Da(ダルトン)
- 原子や分子の質量を表す単位。炭素12(12C)の質量の12分の1が1ダルトン(1Da)と定義される。
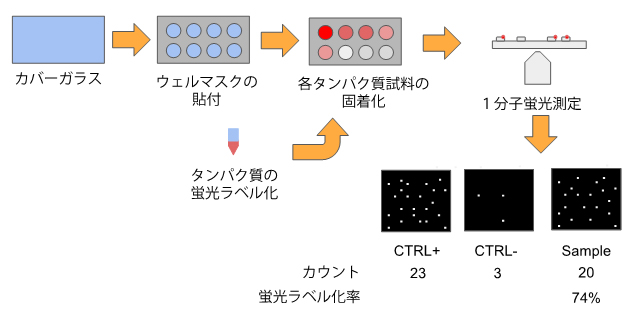
図1 1分子蛍光ラベル化率の評価法
カバーガラスを一定密度の基質(ビオチン結合性タンパク質アビジン)でコートし、蛍光ラベル化およびビオチン化したタンパク質を固着化させて、1分子蛍光測定を行う。100%蛍光ラベル化率のポジティブコントロール(CTRL+)にはビオチン化蛍光分子を用い、0%蛍光ラベル化率のネガティブコントロール(CTRL-)には、未処理のカバーガラスに試料を反応させたものを用いた。これらの蛍光スポットの数から蛍光ラベル化率を決定する。図の例では、(20-3)/23X100≒74%となる。

図2 タンパク質1分子による蛍光スポットの可視化
BSA(ウシ血清アルブミン)に対して、反応性色素Cy5-NHSを反応させて蛍光ラベル化を行った試料を1分子蛍光イメージングした際の画像。一つの蛍光スポットがタンパク質1分子に相当し、蛍光スポットの数から蛍光ラベル化率を決定できる。今回開発した化学反応の条件検討により、82%という高いラベル化率を達成した。また、タンパク質と蛍光ラベルとの化学反応は均一的(タンパク質分子あたりの色素の結合数はほぼ一定)であり、スポットごとの蛍光の強さは比較的一定している。スケールバーは10マイクロメートル(μm、1μmは1,000分の1mm)。
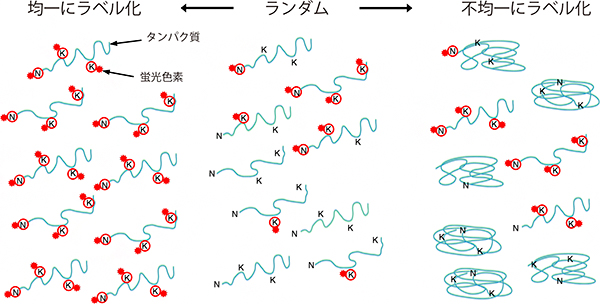
図3 タンパク質と蛍光ラベルとの結合様式の模式図
今回の蛍光ラベル化では、タンパク質を構成するアミノ酸のアミノ基に蛍光色素を結合させている。アミノ基はタンパク質のアミノ末端(N)とリジン残基(K)に存在する。ラベル化がランダムに生じるのであれば、タンパク質ごとにどれだけの数のアミノ基に色素が結合するかはまちまちになると考えられるが、実際にはタンパク質と蛍光色素との結合反応は「全か無か」の不均一な条件で起きる場合も多いことが示唆された。一方ラベル化率の高い反応条件では、タンパク質1分子当たりの色素の数は一定となる傾向がある。
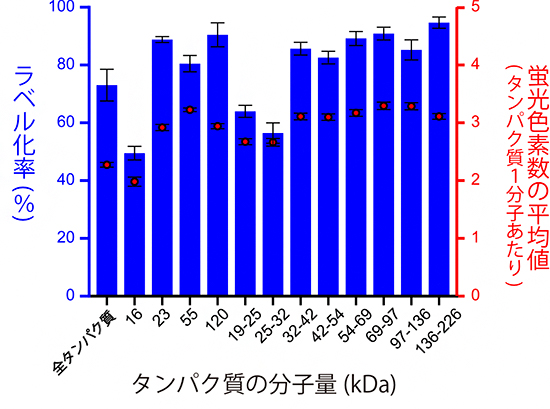
図4 ヒト培養細胞の全タンパク質の蛍光ラベル化率
ヒトの子宮頸がん由来細胞株であるHeLa細胞からタンパク質を抽出し、電気泳動法により大きさごとに分画したタンパク質試料をそれぞれ蛍光ラベル化し、1分子蛍光イメージングにより蛍光ラベル化率を測定した。横軸はタンパク質の大きさを表し、16、23、55,120はそれぞれの分子量(kDa)を持つタンパク質を、19-25、25-32、32-42、42-54、54-69、69-97、97-136、136-226はそれぞれの範囲の分子量(kDa)に含まれるタンパク質を示す。青の棒グラフは左縦軸の蛍光ラベル化率(%)を示し、分子量が大きいほどラベル化率が高くなる傾向があった(例:16kDaの50%から120kDaの90%)。赤丸は、右縦軸に示したスポット当たりの蛍光強度から推定したタンパク質1分子に結合した蛍光色素分子数の平均値で、分子量16kDaで最小の2となり、32kDa以上ではほぼ3で一定する。