2020-02-17 東京大学大学院薬学系研究科,次世代天然物化学技術研究組合,日本医療研究開発機構
Gタンパク質共役型受容体(GPCR)は、7回膜貫通型の膜タンパク質であり、細胞外側への作動薬の結合によって活性化すると、細胞内側でGタンパク質1)やアレスチンといった種々のエフェクターと相互作用することによって、細胞内にシグナルを伝達します。GPCRは創薬の重要な標的となる分子であり、現在アメリカ食品医薬品局(FDA)に認可されている医薬品のうち、30%以上がGPCRと相互作用することでその薬効を発揮することが知られています。これまでに、X線結晶構造解析やクライオ電子顕微鏡解析などによって、さまざまなGPCRの立体構造が解かれてきました。しかしながら、作動薬が結合して活性化した状態のGPCRの構造は、さまざまなエフェクターと相互作用する、GPCRの機能にとって本質的に重要な状態であるにもかかわらず、これまで完全には理解できていませんでした。
東京大学大学院・薬学系研究科および次世代天然物化学技術研究組合の嶋田一夫教授のグループは、核磁気共鳴法(NMR法2))を用いることによって、平滑筋の弛緩に関わるGPCRであるβ2アドレナリン受容体(β2AR)について、作動薬が結合した状態の溶液構造を、活性を保持したままの状態で可視化することに、初めて成功しました。この構造は、これまでに得られていたGPCRの立体構造とは異なる新規構造でした。この成果から、GPCRが作動薬によって活性化されると、どのように細胞内のエフェクターを認識するようになるのかが明らかになりました。また、この状態においては膜貫通領域のエフェクターが結合する部位の周辺に顕著な運動性があることも分かり、この運動性がこの状態をそのままの形でX線結晶構造解析やクライオ電子顕微鏡解析に供する際の妨げとなっていることが示唆されました。このような運動性は、GPCRの熱安定性を上昇させる変異の導入によって抑制されますが、このような変異は多くの場合に、GPCRのシグナル伝達の活性を失わせることが分かっています。本研究では、このような安定化を施すことなく、タンパク質が運動性を持って活性を発揮している状態をそのまま観測することができる、溶液NMR法の特徴が活かされました。
更に、本研究で得られた作動薬が結合した状態におけるGPCRの構造を参考にして、エフェクター結合部位に、選択的に作用する化合物を作るならば、副作用を抑制するなど下流の細胞内シグナルを質的に変化させる薬剤を、合理的に設計できる可能性も示唆されました。この新たな作用点を選択的かつ強固に認識するためには、広い構造空間と結合する面積を有する中分子が必要であると予想され、これにより、作動薬の主作用を保ったままで副作用のみを抑制するような、新たな中分子薬剤の開発が加速することが期待されます。
研究開発のポイント
- GPCRの作動薬が結合した状態の溶液構造を、活性を保持したままの状態で、初めて可視化した。
- 得られた構造は、これまでに得られたGPCRの立体構造とは異なるものであった。
- 本研究は、GPCRに作用して細胞内シグナルを質的に変化させる、中分子の創製のための指針を与えるものである。
研究概要
GPCRは細胞の外側に作動薬が結合すると活性化し、細胞の内側でGタンパク質やアレスチンなどのエフェクターと相互作用することによって、複雑な細胞内シグナルを惹起します。したがって、作動薬が結合した状態のGPCRは、その機能を発揮する上で本質的に最も重要な状態ですが、これまでその構造は完全には理解されていませんでした。
東京大学大学院・薬学系研究科および次世代天然物化学技術研究組合の嶋田一夫教授のグループは、溶液NMR法における常磁性緩和促進効果(PRE効果3))を定量することによって、GPCRの一種であるβ2ARについて、作動薬が結合した状態の溶液構造を、活性を保持した状態で可視化しました(図1中央)。この際、シグナル伝達の活性を変化させないE122Wのみを熱安定性への変異として導入したβ2ARを調製し、得られたサンプルが活性を保持していることを確認した上で、溶液中における状態をそのまま観測しました。その結果、得られた作動薬が結合した状態のβ2ARの構造は、これまでに報告されているどのGPCRの立体構造とも異なるものでした。シグナル伝達の活性を抑制する逆作動薬が結合した状態の立体構造(図1左)と比較すると、6番目の膜貫通ヘリックス(TM6)が細胞の内側から見て時計回りに約90°回転していました。また、Gタンパク質が結合した状態の立体構造(図1右)と比較すると、TM6の細胞の内側が閉じていました。以上の結果は、作動薬のみが結合した状態では、β2ARのTM6の細胞の内側は、逆作動薬が結合した状態と比較して回転しているものの、エフェクターが結合した時のように開いてはいないこと、すなわち作動薬によるGPCR活性化の構造機構が、TM6の回転にあることを示しています。TM5とTM6上に存在するGタンパク質と相互作用する残基は、逆作動薬が結合した状態では離れて存在しているのに対して、作動薬が結合した状態では1つのクラスターを形成しており、このことが作動薬が結合した状態のβ2ARがGタンパク質と相互作用できる構造的な要因であることも分かりました。
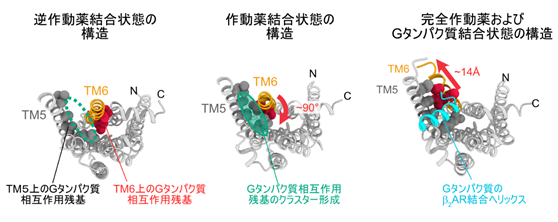
図1:細胞の内側から見たβ2ARの構造逆作動薬が結合した状態の結晶構造(左、PDB ID:2RH1)では、球で表示したTM5とTM6上のGタンパク質と相互作用する残基が離れているのに対して、作動薬が結合した状態の構造(中央、本研究の成果)では、TM6が時計回りに90°回転してこれらの残基がクラスター(緑枠)を形成している。完全作動薬とGタンパク質が結合した状態の結晶構造(右、PDB ID:3SN6)では、Gタンパク質がβ2ARと相互作用するヘリックス(水色)がこのクラスターに結合し、TM6が14Å程度開いている。
更に、溶液NMR解析におけるLeu主鎖アミドシグナルの広幅化から、作動薬が結合した状態においては、β2ARの膜貫通領域のエフェクターが結合する部位を含む領域に、顕著な運動性や構造多型が存在することが示されました。9箇所の熱安定性への変異の導入により活性を失ったGPCRを用いた先行報告では、このような運動性や構造多型は確認されていないことから、この領域が運動性を有することが、GPCRの活性に直結する本質的な性質であることが示唆されました。作動薬が結合した状態におけるこれまでのGPCRの立体構造は、活性を失わせるような熱安定性への変異を導入したり、エフェクターが結合する部位に融合タンパク質を挿入したり、エフェクターや抗体を結合させたりすることによってその動的性質を抑制した上で、更に結晶化または凍結したサンプルを用いて解析されてきました。本研究で観測された、作動薬が結合し活性を発揮している状態におけるGPCRの動的性質が、その構造をX線結晶構造解析やクライオ電子顕微鏡解析にて決定することが困難な要因である可能性があります。これに対して溶液NMR法では、生理的な条件下にあるタンパク質をそのままの状態で観測できるため、これまで構造が不明であった作動薬が結合した状態のGPCRの構造を、機能に相関した運動性を抑制することなく、可視化することができました。
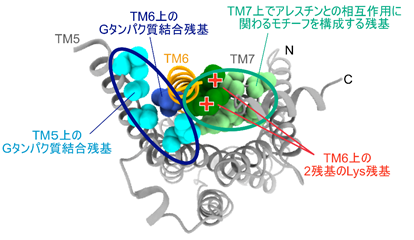
本研究により新たに得られた構造の細胞の内側には、これまでのβ2ARの立体構造では明らかにされていなかった特徴的な広い面が存在しました(図2)。この面を選択的に認識する化合物は、作動薬あるいは内在性リガンドによって活性化したβ2ARに更に相互作用してエフェクターとの相互作用を変調する、アロステリックリガンド4)になる可能性があります。このような化合物は、特定のエフェクターとの相互作用を選択的に阻害することによって、作動薬が及ぼす副作用を軽減するような新たな薬剤になると期待されます。
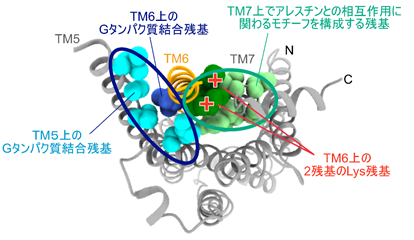
図2:本研究で明らかになったβ2ARの構造と新たな薬剤の作用面の候補作動薬が結合した状態におけるβ2ARの構造を細胞の内側から見た図。水色でTM5上の、青でTM6上のGタンパク質と相互作用する残基を球で表示した。また、薄い緑でTM7上に存在するアレスチンとの相互作用に重要とされるモチーフ(NPxxYモチーフ)を構成する残基を、濃い緑でTM6上に存在する2つのLys残基を示した。楕円で囲ったクラスターの表面積は、いずれもおよそ1600Å2と広い。2つのLys残基がNPxxYモチーフの方を向いていることがこの構造の特徴の一つであり、これらの残基の正電荷とNPxxYモチーフを同時に認識するような中分子は、β2ARによるアレスチン経由の細胞内シグナルに特異的な変調を及ぼす可能性がある。
本研究の成果は、GPCRの機能を制御する新たな薬剤を、立体構造を基にして合理的に設計し、その効果を実証するための指針を与えるものです。このような広い面を選択的かつ強固に認識する新しいクラスの薬を創り出すにあたっては、広い構造空間と可塑性を有する中分子の適用が必要であると予想されます。
なお、本研究の詳細は、2020年1月21日(英国時間1月20日)に英国の科学誌Nature Chemical Biology誌オンライン版に掲載されました。
用語解説
- 1)Gタンパク質
- Gタンパク質は、グアニンヌクレオチド結合タンパク質の略称であり、GTPまたはGDPを結合して活性のON/OFFを行うことにより、細胞内情報伝達に関与する。
- 2)核磁気共鳴(NMR)法
- 水溶液に溶けたタンパク質などを、強力な磁場の中におくことで生じる「原子の共鳴現象」を観測することで、溶液中のタンパク質などの分子の構造や運動性の性質を原子レベルで調べることができる分光法。タンパク質試料を水溶液のままで解析できるため、製薬だけでなく、食品、材料、化学などさまざまな分野で活用されている。
- 3)常磁性緩和促進(PRE)効果
- 孤立電子の電子スピンなどが有する常磁性と呼ばれる性質によって、核スピンの緩和速度が増大する効果のこと。ここでは、MTSLと呼ばれる常磁性タグをタンパク質に部位特異的に導入することによって、タンパク質中のNMRシグナルが、常磁性タグからの距離の6乗に反比例して広幅化することを指す。
- 4)アロステリックリガンド
- 受容体本来のリガンドが結合する部位とは異なる場所へ結合することにより受容体機能が影響を与える種類のリガンド。
特記事項
※この研究は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」(革新的中分子創薬技術の開発)の支援によって行われました。
論文情報
- 雑誌名
- Nature Chemical Biology
(2020年1月21日オンライン版)
- 論文タイトル
- Structural equilibrium underlying ligand-dependent activation of β2-adrenoreceptor
- 著者
- Shunsuke Imai, Tomoki Yokomizo, Yutaka Kofuku, Yutaro Shiraishi, Takumi Ueda, and Ichio Shimada
- DOI番号
- 10.1038/s41589-019-0457-5
お問い合わせ先
内容に関するお問い合わせ
国立大学法人東京大学大学院薬学系研究科 薬科学専攻
教授 嶋田 一夫(しまだ いちお)
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
創薬戦略部 医薬品研究課
次世代治療・診断実現のための創薬基盤技術開発事業担当