顕微鏡操作、細胞認識、1分子観察を人工知能で完全に自動化
2018-09-26 理化学研究所,大阪大学,日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター細胞シグナル動態研究チームの安井真人研究員、廣島通夫上級研究員、上田昌宏チームリーダー(大阪大学大学院生命機能研究科教授)、開拓研究本部佐甲細胞情報研究室の佐甲靖志主任研究員らの研究チーム※は、人工知能(AI)を組み込み、「細胞内1分子イメージング[1]」を完全自動化した革新的な顕微鏡システム「AiSIS」を開発しました。
細胞の分子動態の計測・解析効率の飛躍的な向上をもたらす本システムは、生命科学のさまざまな分野での研究を加速させるほか、1分子動態の変化を指標とした新たな薬剤スクリーニング[2]などへの応用が期待できます。
1分子イメージングは、分子を蛍光によって光らせることで可視化し、細胞で働く個々の分子動態を直接観察する手法です。この手法は高倍率の光学顕微鏡での焦点合わせや、観察に最適な細胞の探索など、経験を積んだ研究者の手作業に頼る過程が多く、大量のデータ取得が求められる研究への利用には向いていませんでした。今回、研究チームは、深層学習[3]などの人工知能技術とロボット技術を利用し、顕微鏡の操作から薬剤添加、細胞観察、画像解析に至る一連の計測・解析過程を自動化した細胞計測システム「AiSIS」を開発しました。AiSIS は、1日あたり1,600個の細胞から1分子解像度の画像データを取得し、分子動態を解析できます。また、膨大なデータ解析により統計精度が向上したことで、タンパク質の動き方を指標とした薬剤の評価も可能になりました。
本研究成果は、英国のオンライン科学誌『Nature Communications』(8月3日号)に掲載されました。
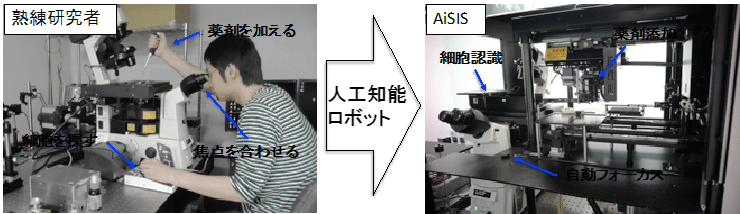
図 熟練研究者(左)の10倍以上の効率で1分子イメージング解析が可能に
※研究チーム
- 理化学研究所
- 生命機能科学研究センター 細胞シグナル動態研究チーム
- チームリーダー 上田 昌宏(うえだ まさひろ)
(大阪大学大学院生命機能研究科 教授) - 上級研究員 廣島 通夫(ひろしま みちお)
- 研究員 小塚 淳(こづか じゅん)
- 研究員 安井 真人(やすい まさと)
- 開拓研究本部 佐甲細胞情報研究室
- 主任研究員 佐甲 靖志(さこう やすし)
※研究支援
本研究は、日本医療研究開発機構(AMED)医療分野研究成果展開事業(先端計測分析技術・機器開発プログラム)「細胞内1分子スクリーニングシステムの開発」、AMED革新的先端研究開発支援事業(AMED-CREST)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明(研究開発総括:横山信治)」の研究課題「1分子・質量イメージング顕微鏡の開発と細胞膜機能解析」の一環として行われました。なお、先端計測分析技術・機器開発プログラムは、平成27年4月の日本医療研究開発機構の発足に伴い、科学技術振興機構(JST)より移管されています。
1.背景
細胞は環境からの刺激に対して応答します。このとき、外からの刺激が細胞膜上の受容体分子などを介して細胞内へと伝達され、細胞の応答が引き起こされます。この一連の反応は「シグナル伝達」と呼ばれ、シグナル伝達に関わる分子の働きに異常が生じると、細胞の正常な応答が妨げられ、がんなどの疾病の原因となることが知られています。そのため、細胞内での分子の振る舞い(分子動態)を理解することは、基礎生物学から医科学、薬理学までの幅広い分野において重要な研究課題となっています。
細胞内の分子動態を研究する有力な手法として、蛍光色素で標識した分子一つ一つを観察する「蛍光1分子イメージング」があります。研究チームの佐甲主任研究員らは、2000年に世界に先駆けて生きた細胞での1分子イメージングを実現しました注1)。以来、分子を細胞内で直接見ることができる特長を生かし、細胞内の分子の運動、会合状態、細胞内分布、反応速度論などについて数多くの知見が得られてきました。
今後、さらにシグナル伝達の仕組みの理解を深めていくためには、より高速で網羅的な解析手法が求められます。しかし、これまでの1分子イメージングは、光学顕微鏡による観察や顕微鏡画像の解析に、熟練した研究者の手作業や経験に依存する過程が多く含まれています。このため、計測手法の習熟にかなりの時間がかかるなど、大量のデータの取得が必要な計測には適していないという問題がありました。
注1)Sako, Y., Minoghchi, S. & Yanagida, T. Single-molecule imaging of EGFR signalling on the surface of living cells. Nat. Cell Biol. 2, 168–172 (2000).
2.研究手法と成果
研究チームは、高速・網羅的な細胞内1分子イメージング解析を実現するため、画像取得から解析までの1分子イメージング計測の全行程を自動化した顕微鏡システム「AiSIS」(Automated in-cell Single-molecule Imaging System)を開発しました。
AiSISは、温度・湿度・二酸化炭素(CO2)濃度の制御が可能な細胞培養器の中に設置され、イメージング用超高感度カメラ、1分子観察用の全反射照明光学顕微鏡[4]、溶液添加ロボット部から構成されます(図1(a))。また、コンピュータにより、1)自動フォーカス、2)自動細胞選択、3)対物レンズ自動オイル供給、4)細胞試料自動搬送、5)自動溶液添加などの一括制御が可能となっています。すなわち、AiSISは自動で細胞を認識し、自動で細胞に焦点を合わせ、1分子画像を自動記録し、得られる1分子解像度の細胞動画像から個々の分子の位置情報と蛍光強度のデータを自動で取得できます。さらに、顕微鏡への細胞サンプルの搬送や溶液添加もロボットが行います。
完成した自動計測システムによって、一日あたり1,600細胞(含まれる分子は約1,000万個)の1分子イメージング解析が可能となりました(図1(b),(c))。これは、熟練研究者と比較しても10倍以上の効率に相当します。
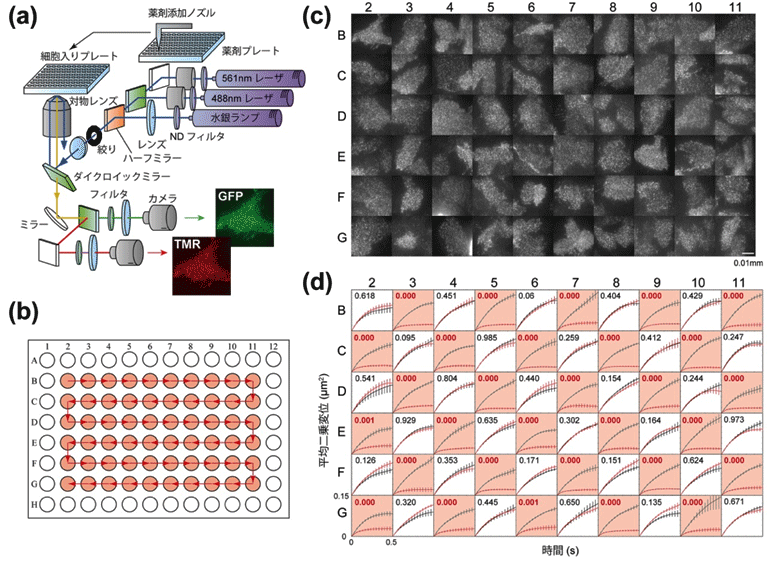
図1 自動化による大規模1分子イメージング
(a)自動計測装置に組み込まれた全反射照明光学顕微鏡の光学系。薬剤プレートから細胞入りプレートへの溶液添加は、ロボット制御による薬剤添加ノズルで行われる。
(b)細胞入りプレートを上から見た図。マルチプレートの96ウェルのうち60ウェルに細胞を培養する。赤矢印の順にウェルごとに細胞を自動で探し、自動で焦点を合わせ、細胞の1分子画像を記録する。溶液添加も自動でできる。
(c)60ウェル全てで1分子画像を取得した例。蛍光プローブとして緑色蛍光タンパク質(GFP)を上皮成長因子受容体(EGFR)に融合させたEGFR-GFPを培養細胞(CHO細胞)で発現させている。スケールバーは10μm(0.01mm)。
(d)上皮成長因子(EGF)添加によるEGFRの拡散変化の自動検出。EGFR-GFPを発現する培養細胞に、EGF入りの緩衝液を添加したウェル(橙)と、ただの緩衝液を添加したウェル(白)での、EGFR分子の運動量の変化を示した。縦軸の平均二乗変位は運動の大きさを表す指標で、66ミリ秒間に観察された分子の位置の始点と終点の距離(μm)の二乗を示す。値が大きいほど、運動量が多い。黒線は緩衝液添加前、赤線は緩衝液添加後。EGF入りの緩衝液を添加したウェル(橙)では、平均二乗変位が減少する(拡散範囲は狭くなる)。数値はt検定でのp値を表し、赤文字は有意差あり、黒文字は有意差なしを示す(p<0.05)。
研究者の経験、技量が特に必要とされる顕微鏡観察の自動化の鍵となったのは、深層学習を用いた人工知能(AI)の導入です。例えば、高倍率での焦点合わせにおいては、浅い焦点深度のもと、正確に蛍光輝点に焦点を合わせなければなりません(対物レンズの位置にして±200ナノメートル[nm、1nmは10億分の1メートル]程度の位置精度、髪の毛の太さの400分の1に相当)。また、1分子イメージングでは、細胞上の蛍光分子一つ一つを区別して観察するため、蛍光分子がまばらに分布している細胞を探し出して観察する必要があります(密度にして1μm2[1μmは100万分の1メートル]あたり1~3個)。
そこで、自動計測システムにはあらかじめ、正解、不正解それぞれの状況を反映した画像を学習させました。焦点合わせでは、観察面に像を結ばせた視野絞りの輪郭を焦点位置の目印として学習に用いました(図2(a))。
細胞認識では、蛍光分子の密度が適切で1分子イメージングに適した細胞の蛍光像をあらかじめ取得し、教師データ[3]として学習に用いました。実証実験の際には、学習した正解に最も近い像が得られる対物レンズの位置と、観察すべき細胞を、計測システム自身が探し出します(図2(b))。焦点合わせの場合、さらに画像解析を組み合わせることで、±181nmの位置精度を達成しました。
また、細胞探索の場合には、人が探すと探索時間が細胞ごとにまちまちになり、蛍光プローブの退色の影響により定量性が低くなる場合があります。これに対し、自動計測システムは一枚のスナップショット(露光時間33ミリ秒)から観察に適した細胞を瞬時に判断できるため、蛍光退色の影響を最小限にとどめ、定量性を確保できました。
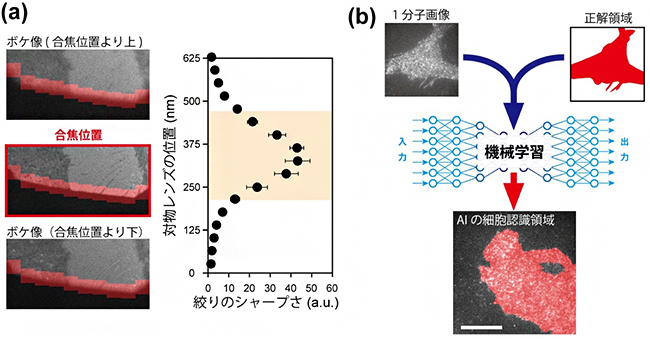
図2 人工知能(AI)を組み入れた顕微鏡操作
(a)焦点合わせ。視野絞り像(左)の合焦位置を、深層学習と画像解析を併用して探し出す。画像解析では、視野絞り辺縁の赤く示した領域について評価値を計算し(右)、最も値が大きくなる位置に対物レンズを移動する。橙色の範囲は、目で見て焦点が合っていると判断された対物レンズ位置を示す。
(b)細胞の選択。1分子画像(上左)から、蛍光プローブ分子の密度が最適な領域(上右、赤い部分)をシステムに教えた結果、システムが観察に適すると判断した細胞領域を下図に赤で示す。スケールバーは10μm。
このように、これまでの1分子イメージング法の弱点であった人手に依存した計測プロセスを克服した結果、大量かつ網羅的なデータの取得を必要とする研究課題にも対処できるようになりました。そこで、細胞内の分子に対する薬剤の効果を1分子動態から評価できるか、その可能性を探りました。
上皮成長因子(EGF)[5]は、細胞の増殖と成長の調節に重要な役割を持つ分泌タンパク質です。EGFは細胞膜上のEGF受容体(EGFR)[5]と結合し、EGFRどうしの安定な二量体あるいは多量体の形成を促進させます。これを引き金に、EGFRの細胞内ドメイン(細胞質側に存在する部分)などシグナル伝達に関わるタンパク質のリン酸化が連鎖反応のように生じ、細胞内の分子回路へとシグナルが伝達されます。この過程では、細胞膜上のEGFRの側方拡散運動や多量体形成に変化が生じることが知られています。AiSISにより蛍光標識したEGFRを観察したところ、EGF添加後にEGFRの拡散の速さを表わす拡散係数の低下(0.051 ± 0.008 μm2/秒)や、拡散距離の制限(264 nm)に伴う拡散範囲の縮小、多量体形成を反映する輝点強度の増加が観察されました。そこで、EGFRの拡散の変化を指標に、細胞に添加した液体がEGFなのか、それともただの緩衝液かをAiSISが判別できるかを試したところ、自動で完全に見分けることができました(図1(d))。
さらに、より複雑な薬剤添加試験のモデルとして、EGFとEGFRのリン酸化阻害剤を同時に加える実験を行いました。EGFRのリン酸化阻害剤は、EGFとEGFRの結合は阻害しませんが、EGFRの細胞内ドメインのリン酸化を阻害し、シグナル伝達を阻害します。EGFとEGFRのリン酸化阻害剤をさまざまな濃度の組み合わせで添加したところ、これらが拮抗的に作用してEGFRの拡散を変化させる様子が捉えられました(図3)。得られたデータから計算したEGFの50%効果濃度(EC50)[6]とEGFRリン酸化阻害剤の50%阻害濃度(IC50)[6]は、従来報告されている値とほぼ等しく、分子の動きの変化から薬剤の効果を定量的に評価できることが示されました。
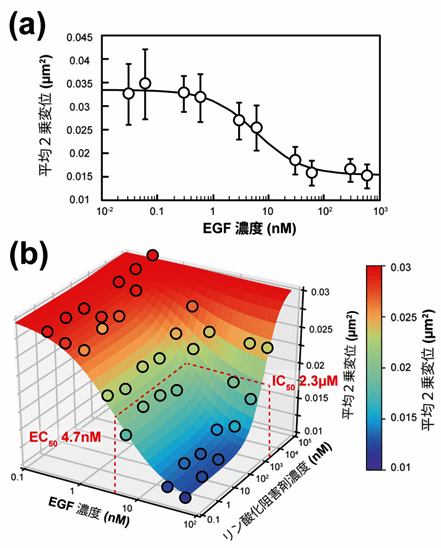
図3 上皮成長因子(EGF)とリン酸化阻害剤(AG1478)の拮抗作用マッピング
(a)EGFを添加したときのEGFRの拡散の変化。添加濃度が高くなると、EGFRの平均二乗変位(運動量)が減少する。
(b)EGFとリン酸化阻害剤を、それぞれ濃度を変えて添加した。EGFRの平均二乗変位は、EGFでは添加した濃度の増加に伴い小さくなるが、阻害剤濃度の増加では大きくなり、互いの拮抗作用を反映している。丸はAiSISで測定した36通りの条件での解析値を表す。この値から、非競合阻害を仮定したモデルによりフィッティング(曲面グラフの描画)を行うことで、EGFの50%効果濃度(EC50)=4.7nM、AG1478の50%阻害濃度(IC50)=2.3μM(2,300nM)を得た。
1分子イメージングでは、2種類の蛍光プローブを用いて、分子どうしの相互作用を直接見ることができます。本研究では、EGFRと、EGFRの細胞内ドメインに結合するアダプタータンパク質Grb2[5]の同時観察を行いました(図4(a))。その結果、EGF刺激後、EGFRの運動状態の変化や多量体形成と同時期に、Grb2がEGFRの細胞内ドメインに結合したことを反映する、Grb2の細胞膜への局在時間が増加したことが明らかになりました(図4(b), (c))。このようにAiSISを用いることで、複数の分子が関与する細胞内シグナル伝達が、どのようなメカニズムで起きているかを調べられることが示されました。
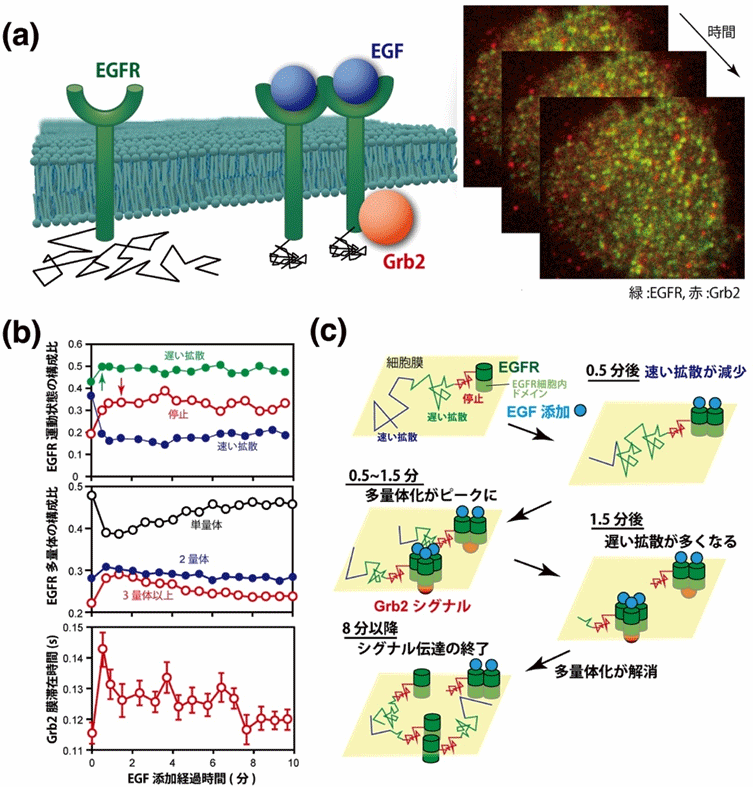
図4 EGF受容体(EGFR)とアダプタータンパク質Grb2の2色1分子イメージング
(a)細胞膜付近でのEGF、EGFR、Grb2の模式図(左)と、AiSISが捉えた1分子イメージグ像(右)。EGFR単量体は細胞膜上の拡散運動量が多いが、EGFが結合して二量体、多量体となると拡散運動が減少し、Grb2が結合する。
(b)EGF添加後のEGFRとGrb2の変化。上段は、EGFRの三つの運動状態(静止状態:赤、遅い拡散:緑、速い拡散:赤)を示し、EGF添加後にその比率が変化した。添加直後は遅い拡散状態が増え(緑矢印)、速い拡散状態が減少する。続いて静止状態が増加(赤矢印)する。中段は、EGFRの会合状態の変化。単量体や多量体の構成比率については、添加直後は単量体が減少して二量体が増加する。引き続き、三量体以上の多量体が増加した。しかし、時間が経つとともに当初の比率に戻っていく。下段は Grb2の細胞膜滞在時間。添加直後に増加し、その後徐々に減少した。
(c)計測されたEGFRとGrb2の振る舞いのまとめ。多量体化したEGFRに、Grb2が結合してシグナルを伝達することが示された。
3.今後の期待
本研究で開発した自動化1分子イメージングシステム(AiSIS)によって、大規模かつ網羅的な1分子イメージングが可能となり、莫大な数の細胞シグナル関連分子の分子動態や相互作用を、より効率的に、そして正確に解析できるようになりました。今後、細胞内シグナル伝達の分子メカニズムを探求する研究の進展に大きく寄与すると考えられます。
また、AiSISを用いると、さまざまな薬剤処理や遺伝子変異に対して網羅的に分子動態を解析できるため、1分子の振る舞いを見て薬剤や遺伝子を探索する新しい原理のスクリーニング手法が開発される可能性があります。これらの用途を通じ、今回開発した計測システムは、今後、基礎生物学だけでなく、医科学や薬理学など幅広い分野において役立つと期待できます。
さらに、AiSISに組み込まれた顕微鏡計測の自動化技術は、1分子イメージング用顕微鏡だけでなく、他の先端的光学顕微鏡にも適用可能です。例えば、計測装置に改良を加えることで、細胞膜上の受容体だけでなく、細胞核内での転写因子の1分子イメージングや細胞骨格タンパク質の1分子イメージングにも利用できる可能性があります。人工知能やロボット技術を利用して自動化された最先端の顕微鏡を用いることで、生命科学の新しい領域が拓かれていく可能性があります。
4.論文情報
- タイトル:Automated single-molecule imaging in living cells
- 著者名:Masato Yasui#, Michio Hiroshima#, Jun Kozuka, Yasushi Sako, and Masahiro Ueda
(#equal contribution) - 雑誌:Nature Communications
- DOI:10.1038/s41467-018-05524-7
5.補足説明
- [1]1分子イメージング
- 蛍光分子1個が出す光を顕微鏡観察することで、分子の挙動を1分子レベルで追跡するイメージング技術。
- [2]スクリーニング
- スクリーニングとは、例えば、ゲノム中の膨大な遺伝子群から特定の生命現象に関与する遺伝子群を探索する技術、あるいは、微生物が産生するさまざまな物質の中から目的とする物質(タンパク質や抗生物など)を探索する技術である。こうしたスクリーニングにより、オートファジーに関与する遺伝子群の同定(大隅良典博士:2016年ノーベル生理学・医学賞)やイベルメクチンの開発(大村智博士:2015年ノーベル生理学・医学賞)が可能になった。特に、大隅博士の発見においては、光学顕微鏡を用いてオートファジーに異常を示す遺伝子変異体を目で見てスクリーニングしたことがブレイクスルーとなっている。新しいスクリーニング技術は、新しい生命科学を拓くといえる。
- [3]深層学習、教師データ
- 深層学習は機械学習手法の一つ。入力データとそれに対応する解答(教師データ)を用意し学習させることで、入力データから解答を自動で得ることができる。数理モデル化された神経細胞モデルを層状に並べた構造が、深層学習の特徴である。層が多くなると精度は良くなるが、解答を出す速度や学習速度が遅くなる。近年の計算機の速度向上・並列化により、この問題が払拭され注目を浴びるようになった。
- [4]全反射照明光学顕微鏡
- 蛍光プローブ分子一つ一つを可視化する顕微鏡法。わずかなシグナルを捉えるため、超高感度カメラと、分子近傍のみ照らせる薄層の照明光を用いる。照明光には、エバネッセント光と呼ばれる、光を全反射させると逆側に浸み出す200nmほどの厚さの光が用いられることが多い。酵素反応や生きた細胞での1分子イメージングは、日本人研究者が初めて成功するなど、日本が研究の最先端を担っている分野でもある。
- [5]上皮成長因子(EGF)、EGF受容体(EGFR)、Grb2
- EGFは細胞が分泌する生理活性物質(サイトカイン)で、細胞膜上のEGFRと結合して細胞の主要なシグナル伝達経路を活性化させ、細胞の分裂や分化、運動、細胞死など、さまざまな細胞応答を引き起こす。EGFRはEGFと結合すると細胞膜上を移動し、二量体や多量体を形成し、自身のリン酸化酵素活性により細胞内ドメインがリン酸化される。Grb2はこのリン酸化を標的にEGFR細胞内ドメインに結合し、他のシグナル分子をEGFRに引き寄せるアダプタータンパク質である。がん細胞ではEGFRの過剰発現や遺伝子変異が高頻度で見られることから、抗がん剤の主要な標的分子となっている。
- [6]50%効果濃度(EC50)、50%阻害濃度(IC50)
- 分子や細胞、個体に作用させた薬剤の量と反応の関係を表す指標。ある薬剤について、最大効果の半分(50%)の反応(薬効や阻害)を引きおこす用量を50%効果濃度、50%阻害濃度と呼ぶ。
6.発表者・機関窓口
発表者
理化学研究所 生命機能科学研究センター 細胞シグナル動態研究チーム
研究員 安井 真人(やすい まさと)
上級研究員 廣島 通夫(ひろしま みちお)
研究員 小塚 淳 (こづか じゅん)
チームリーダー 上田 昌宏(うえだ まさひろ)
(大阪大学大学院生命機能研究科 教授)
理化学研究所 開拓研究本部 佐甲細胞情報研究室
主任研究員 佐甲 靖志(さこう やすし)
機関窓口
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
理化学研究所 広報室 報道担当
大阪大学 生命機能研究科庶務係
AMED 事業に関するお問い合わせ先
医療分野研究成果展開事業(先端計測分析技術・機器開発プログラム)
日本医療研究開発機構(AMED)産学連携部 医療機器研究課
革新的先端研究開発支援事業(AMED-CREST)
日本医療研究開発機構(AMED)基盤研究事業部 研究企画課