タンパク質結晶の合理設計に前進
2018/07/30 理化学研究所 近畿大学
理化学研究所(理研)放射光科学研究センター理研RSC-リガク連携センターの国島直樹客員研究員らの共同研究グループ※は、タンパク質を生化学的手法で分析することにより、結晶化を妨げている部位を実験的に特定する新技術を開発しました。
本研究成果は、タンパク質の結晶を合理的に設計することを可能とし、創薬応用を含む構造生物学[1]の発展に貢献すると期待できます。
構造生物学研究のためには、タンパク質を結晶化して構造解析する手法が一般的ですが、タンパク質の結晶化は容易ではありません。タンパク質の分子表面に存在するリジン[2]というアミノ酸残基は結晶化を妨げることが知られています。分子表面リジン残基を実験的に検出する方法があれば、それを他のアミノ酸に置換することで、タンパク質結晶を得る確率を高めることができます。
今回、共同研究グループは、分子表面リジン残基を市販の試薬で化学修飾[3]し、一般的な質量分析法[4]で特定する方法を提案し、その有効性をモデルタンパク質で確かめました。これにより、タンパク質結晶の合理設計の実現が一歩前進したといえます。
本研究は、国際科学雑誌『Analytical Biochemistry』オンライン版(7月17日付け)に掲載されました。
※共同研究グループ
理化学研究所 放射光科学研究センター
パートタイマー(研究当時) 村岡 愛一郎(むらおか あいいちろう)
XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
リサーチアソシエイト 松浦 祥悟(まつうら よしのり)
利用技術開拓研究部門 生体機構研究グループ
先任研究員 内藤 久志(ないとう ひさし)
理研RSC-リガク連携センター
客員研究員 国島 直樹(くにしま なおき)
近畿大学 農学部
准教授 伊原 誠(いはら まこと)
※研究支援
本研究は、日本医療研究開発機構(AMED)創薬等支援技術基盤プラットフォーム事業「SPring-8におけるワンストップタンパク質試料生産支援および高分解能結晶取得技術の高度化(研究代表者:国島直樹)」による支援を受けて行われました。
背景
タンパク質の立体構造は構造生物学研究の基盤情報で、目的タンパク質を結晶化し構造解析して得ることが一般的です。しかし、これまでタンパク質の結晶化は非効率な試行錯誤により行われてきました。例えば、日本の構造ゲノム科学[5]プロジェクトでは、ある耐熱性バクテリアの全タンパク質の構造決定を目指して網羅的に結晶構造解析が行われましたが、構造決定に成功したタンパク質は全体の約2割に過ぎませんでした。つまり、一つの生物において8割のタンパク質の結晶構造が解析できない状況は現在も続いています。
細胞中でのタンパク質の結晶化は生命活動を阻害する可能性があるため、天然タンパク質は結晶化しにくい方向に進化したと考えられています。したがって、天然タンパク質に手を加えてより結晶化しにくくすることは難しいですが、逆に結晶化するように人為的に改変することは難しくないと考えられます。そこで、タンパク質分子を部位特異的変異導入[6]により改変することで、結晶を得る確率を高める手法「タンパク質結晶の合理設計」の開発が望まれています。
国島直樹客員研究員らは2008年に、この概念に沿ってモデルタンパク質の結晶品質を改善することに成功しました注1)。タンパク質は20種類のアミノ酸から成り立っており、タンパク質の分子表面に存在するリジン残基は結晶化を妨げることが知られています。国島客員研究員らはこれを発展させ、多数のタンパク質結晶構造データの統計解析により20種類のアミノ酸それぞれについて結晶化への適合度を決定し、それに基づく分子表面への変異導入により結晶化率が改善することをモデルタンパク質で実証しました注2)。つまり、分子表面に存在するリジン残基を他のアミノ酸に置換することでタンパク質の結晶化率を高めることを実証したわけです。
しかし、この方法は目的タンパク質の立体構造がある程度の精度であらかじめ分かっていないと適用できないという大きな欠点がありました。もし、分子表面リジン残基を実験的に検出する方法があればこの欠点は解消され、構造生物学のボトルネックとなっている構造未知タンパク質の結晶化を効果的に支援できます。ただし、アミノ酸置換による構造変化を避けるため、タンパク質の他の残基と分子内相互作用をしない分子表面リジン残基を選ぶ必要があります(図1)。
注1)2008年9月29日プレスリリース「タンパク質分子に変異導入し、結晶の品質が改善 PDF(742KB)」
注2)Yamada et al. (2017) “Designing better diffracting crystals of biotin carboxyl carrier protein from Pyrococcus horikoshii by a mutation based on the crystal-packing propensity of amino acids” Acta Cryst. D73, 757-766
研究手法と成果
今回、共同研究グループは、分子表面リジン残基をNHS-ビオチン[7]という市販の試薬で化学修飾し、修飾を受けたリジン残基を一般的な質量分析法であるMALDI-TOF MS[8]で特定する方法を提案しました(図2)。タンパク質分子の他の残基と相互作用しているリジン残基は、この修飾を受けにくいと考えられます。この方法自体は特に新しいものではありませんが、タンパク質結晶化を目的としている点に新奇性があります。実験手順は非常に簡便で、結晶化に使う程度の量の精製タンパク質試料とタンパク質化学の一般的な研究設備があれば、2日で行うことができます。
その有効性を検証するため、以前に国島客員研究員らが結晶構造を決定したPH1033というタンパク質に本技術を適用しました。PH1033は144残基のアミノ酸から成る小型のタンパク質ながら、統計解析に充分な22個のリジン残基を持ち、検証モデルとして適しています。PH1033の結晶化率はリジンの多さを反映して低く、研究グループで最も高品質な結晶は、鉱物の一種を結晶化の足場として使う特殊な方法により得られました注3)。
注3)Sugahara et al. (2008) “Nucleant-mediated protein crystallization with the application of microporous synthetic zeolite” Acta Cryst. D64, 686-695
タンパク質と標識試薬のモル比1:1で行ったNHS-ビオチンによる化学修飾実験の結果、PH1033のリジン22残基のうち7残基が修飾されました(図3)。この結果を考察するため、PH1033の結晶構造を初期モデルとして実験条件を想定する分子動力学(MD)シミュレーション[9]を行いました。結晶構造は水溶液中でとりうる多数の異なる立体構造のうち1構造のスナップショットに過ぎませんが、MDでは水溶液中のタンパク質構造の揺らぎを考慮するため、より現実的な考察ができます。
得られたMD構造を統計的に分析した結果、PH1033の各リジン残基の修飾の有無は、当該残基の分子内相互作用に関する4種類の因子と有意な相関を示しました。また、タンパク質分子の荷電状態に依存して分析結果に違いが認められました。例えば、修飾を受ける七つの分子表面リジン残基の中には、溶液中で常に遊離しているわけではなく、条件によってタンパク質の他の残基と相互作用するもの(条件依存的修飾)が少なくとも二つ含まれることが分かりました。さらに、分子内相互作用が少ないのに修飾されないリジン残基も一つ見つかりました。これは複数のリジン残基が近接している場合に起きる現象(近接効果)で、より感受性の高いリジン残基が優先的に修飾されるためと考えられます。
以上の結果から、大局的には本技術によりタンパク質結晶の合理設計のターゲットとなるリジン残基を、全リジン残基の3割程度に絞り込めることが分かりました。この3割をターゲットに合理設計技術を適用すれば効率的に結晶を得ることができると考えられます
今後の期待
一つの生物において8割のタンパク質の結晶構造が解析できない状況は現在も続いています。タンパク質結晶化の問題は今後の構造生物学の発展のためにも解決が望まれます。
2050年に65歳以上の高齢者が4割近くを占めると予測される日本において、医療問題は避けて通ることのできない課題です。構造に基づく創薬では、疾病関連タンパク質の立体構造やそのタンパク質と創薬候補化合物との複合体の立体構造をもとに薬剤設計を行いますが、現状では解析可能なタンパク質結晶を得ることが難しい状況です。
本研究成果により、タンパク質結晶の合理設計が大幅に現実的になりました。条件依存的修飾や近接効果の検討は課題として残っています。今後、本技術を広く適用することで解析可能なタンパク質が増加し、創薬応用を含む構造生物学の発展と将来の医療問題の解決につながると期待できます。
原論文情報
Aiichiro Muraoka, Yoshinori Matsuura, Hisashi Naitow, Makoto Ihara, and Naoki Kunishima, “Availability of NHS-biotin labeling to identify free protein lysine revealed by experiment and MD simulation”, Analytical Biochemistry, 10.1016/j.ab.2018.07.009
発表者
理化学研究所
放射光科学研究センター 理研RSC-リガク連携センター
客員研究員 国島 直樹(くにしま なおき)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 構造生物学
- 生物を構成する生体高分子、特にタンパク質や核酸の分子機能を、その立体構造から理解することを目指す生物学の一分野。X線結晶構造解析、核磁気共鳴、電子顕微鏡などの技術を用いる。
-
- リジン
- タンパク質を構成する20種類のアミノ酸の一つで、4-アミノブチル基を側鎖として持ち、塩基性アミノ酸および必須アミノ酸に分類される。側鎖の先端に存在する一級アミノ基がさまざまな化学修飾を受ける。
-
- 化学修飾
- タンパク質などの生体高分子に含まれる特定の官能基を化学的に改変すること。当該生体高分子の活性や反応性などの分子機能を変化させることを目的に行うことが多い。
-
- 質量分析法
- 分析対象分子をイオン化し、その相対分子量を電荷数で割った値(m/z)を測定する分析手法。
-
- 構造ゲノム科学
- 生体内のタンパク質の立体構造を機能未知なものも含めて網羅的に決定し、タンパク質の立体構造と機能の関係を総合的に研究することによって、生命現象を理解しようとする学問分野。
-
- 部位特異的変異導入
- 目的タンパク質の遺伝子に組換えなどを利用して変異を導入し、当該タンパク質分子の任意の位置に任意のアミノ酸配列を導入する分子生物学の手法。例えば、タンパク質の機能を人為的に改変するために用いられる。
-
- NHS-ビオチン
- 市販されている化学修飾用試薬であるN-hydroxysuccinimide-biotinの略で、タンパク質分子に存在する一級アミノ基(ほとんどの場合リジン残基側鎖のアミノ基)にビオチンを化学的に付加する。
-
- MALDI-TOF MS
- マトリックス支援レーザー脱離イオン化飛行時間型質量分析法(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry)の略で、タンパク質やペプチドの分析に最も一般的に使われる質量分析法の一つ。分析対象分子を含む試料をマトリックスと呼ばれる基剤と混合したものに、レーザー光を照射することで対象分子をイオン化し、電場で加速した当該イオンが検出器に到達するまでの時間を計測する。
-
- 分子動力学(MD)シミュレーション
- タンパク質などの水溶液中での揺らぎ、動的環境を調べるために用いられる。経験的な力場を用いて、古典力学におけるニュートン方程式を数値解析により解き、各原子の位置と速度の時間展開を得ることで、その系の動的過程を解析する。MDは、molecular dynamicsの略。

図1 リジン残基の置換によるタンパク質結晶化率の改善
青い楕円はタンパク質分子を表し、左の天然型分子にはa~cの三つのリジン残基がある。これらのリジン残基のうち、aのように分子表面で遊離しているものを右のように他のアミノ酸残基(この例ではイソロイシン)に置換するとタンパク質の結晶化率を高めることができる。bは分子内部に埋もれておりcは分子内の他の残基と相互作用しているため、どちらも置換には適さない。
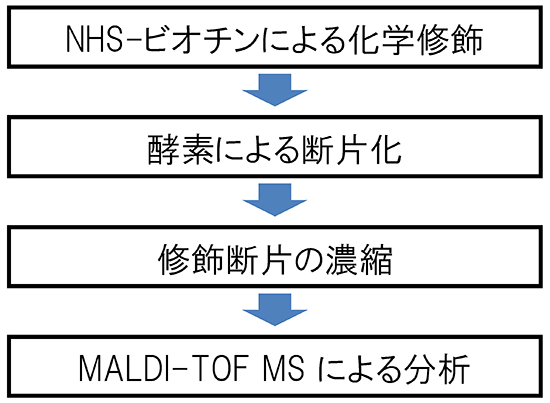
図2 化学修飾と質量分析によるタンパク質分子表面リジン残基の特定手順

図3 PH1033の分子表面リジン残基特定実験
タンパク質をリボンモデルで、リジン22残基を青い棒状モデルで描いた。NHS-ビオチン処理で化学修飾される七つのリジン残基に星印を付けた。そのうち、MDシミュレーションにより条件依存的修飾が示唆された2残基を赤色で区別した。また、近接効果(意味は本文参照)により、分子表面で遊離しているにもかかわらず修飾されなかったリジン1残基に丸印を付けた。



