2020-01-08 東京大学
1.発表者:
畠山 哲央(東京大学大学院総合文化研究科広域科学専攻 助教)
金子 邦彦(東京大学大学院総合文化研究科広域科学専攻 教授)
2.発表のポイント:
◆一般的に生体内の化学反応は 1 秒以下の時間スケールで進み、そこには生物が生きている時間スケールとは大きな隔たりがあるが、その溝がどのように埋められているかは未知であった。
◆古典的な生体内タンパク質のモデルにおいて、酵素反応を介在させることで、それぞれの反応が速くても、全体としての速度が数十万倍以上も遅くなりうることを理論的に初めて示した。
◆本研究結果は、体内時計や睡眠、記憶などのさまざまな生命現象の時間スケールがどのように決まっているかを理解し、それを制御する上での大きな基礎となる。
3.発表概要:
生体内の生化学反応は一般的に 1 秒以下の時間スケールで進みます。そこには、我々生物が生きている時間スケールとは大きな隔たりがあり、生物の中でその溝がどのようにして埋められているのかは、基礎的な問題であるにもかかわらずほとんど分かっていませんでした。この溝を埋めているメカニズムを理解することは、概日時計や睡眠、記憶など、時間が関わるさまざまな生命現象を理解し、制御するためには必須です。そこで、東京大学大学院総合文化研究科の畠山哲央助教、金子邦彦教授は、50 年以上前から知られている生体内タンパク質のアロステリック制御のモデルである Monod-Wyman-Changeux モデルを、酵素反応を含むモデルへと拡張し、計算機シミュレーションを用いて解析することで、酵素反応のそれぞれの反応がどんなに速くても、全体としての速度が数十万倍以上も遅くなりうることを示しました。さらに、その遅い生命現象の時間スケールを支配する仕組みが、ガラスを支配すると考えられている仕組みの一つと非常に近いことがわかりました。将来的には、一見して大きく異なる生物とガラスの間の共通点を利用して、時間が関わるさまざまな生命現象に対する理解をより深め、また生命現象を支配する時間スケールをコントロールすることが可能になると期待できます。
4.発表内容:
生体内の生化学反応の速度は一般的に 1 秒以下の時間スケールで進みます。一方の、我々生物が生きて行動する時間スケールは、それよりも遥かに長いものです。例えば体内時計であれば、その時間スケールは大体十万秒ほどになります。つまり、生化学反応を支配する時間スケールと、我々が生きている時間スケールの間には、とても大きな隔たりがあります。多くの生化学反応が集まって構成されているに過ぎない我々生物が、どのようにしてその時間スケールのギャップを埋めているかは、非常に基礎的で重要な問題ですが、ほとんど何もわかっていませんでした。
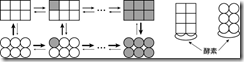
畠山と金子は、この溝を埋めているメカニズムの一つを理論的に明らかにしました。畠山らは、 Monod-Wyman-Chnageux モデルという 50 年以上前から知られている生体内タンパク質のアロステリック制御(注1)のモデルを、実際に生体内のさまざまな反応でおこなわれているように、酵素反応を含む形へと拡張しました(図 1)。そして、計算機シミュレーションを用いて拡張したモデルを解析することによって、酵素反応のそれぞれの反応がどんなに速くても、全体としての速度が数十万倍以上も遅くなりうることを示しました。この時間スケールを遅くするメカニズムは、反応が進めば進むほど、酵素と結合しやすい状態の分子が増えていく一方で、それらの分子が酵素を独占するような状態になってしまうために、残りの分子が酵素とほとんど結合できずに全体として反応が遅くなるというものでした。Monod-Wyman-Changeux モデルは、非常に古くから知られよく研究されているにも関わらず、このようなメカニズムは今まで知られていませんでした。
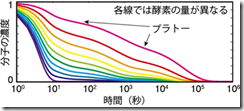
さらに、このゆっくりと進む生化学反応において、各分子の数がどのように変化していくかを調べたところ、非常に興味深いことがわかりました(図 2 参照)。各分子の数は、最終的に一定の割合に落ち着くまでに多数のプラトー(図 2 において時間的にほとんど変化しない部分)を示しながら、時間に対して対数的に変化しました。この時系列は、統計物理学においてよく知られている、ガラス中の分子の運動に非常に近いものでした。そこで、この生化学反応のモデルをさらに深く調べたところ、その中にガラスを支配していると考えられている仕組みの一つである動的拘束模型と非常によく似た構造が潜んでいることがわかりました。動的拘束模型とは、エネルギー的に安定な状態はシンプルであるものの、そこに至るまでの状態の遷移できる状態に制限があるために、結果として安定な状態に至るまでの速度が遅くなるようなモデルのことです。生化学反応においては、酵素が結合しないと反応速度がほぼゼロになるという制限がかかるために、動的拘束模型のような仕組みが実現されます。
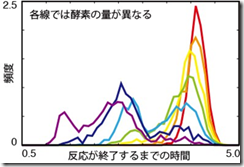
また、ガラスではさまざまな環境が変化した時に、液体とガラスでの転移が起こることが知られています。そこで、酵素の量などを変化させたところ、反応が進んで最終的に行き着く状態は酵素の量を変えても変化しないにも関わらず、その状態に至るまでにどのような反応経路を通るかは酵素の量に大きく依存しました。さらに、反応が全て終わるまでにかかる時間は、酵素の量と温度を変えた際に、それぞれ統計力学における一次転移と二次転移に近い振る舞いを示すことがわかりました(図 3 参照)。この転移の存在は、反応のわずかな揺らぎにより各細胞に流れる時間が大きく変化し、細胞ごとの多種多様な応答を示しうることを意味します。つまり、細胞の個性の基盤となりうるものです。さらに、このような反応経路の転移をさらに詳しく調べることは、生物学のみならず物理学の発展に対しても大きな寄与をもたらすことが期待できます。
本研究は、ミクロな生化学反応とマクロな生命現象の間を生命がどのように埋めているかを明らかにすることで、生命現象を支配する時間スケールがどのように決まっているかを理解しようという他にほとんど類を見ないものです。時間スケールが重要な意味を持つ生命現象は、前述のように、体内時計や睡眠、記憶など多岐に渡ります。本研究は、これらの生命現象を支配する時間がどのように決まっているのかを理解するための、大きな礎となると考えられます。また、本研究で得られた生化学反応とガラスの間のアナロジーをより発展させることにより、将来的には、さまざまな生命現象に流れる時間をコントロールすることが可能になると期待できます。
5.発表雑誌:
雑誌名:Physical Review Research Rapid Communications(1 月 7 日オンライン掲載)
論文タイトル:Transition in relaxation paths in allosteric molecules: Enzymatic kinetically constrained model
著者:Tetsuhiro S. Hatakeyama*, Kunihiko Kaneko
Abstract URL:
DOI: https://doi.org/10.1103/PhysRevResearch.2.012005
6.問い合わせ先:
東京大学 大学院総合文化研究科 広域科学専攻
助教 畠山 哲央(はたけやま てつひろ)
7.用語解説:
(注 1)アロステリック制御:
タンパク質に化合物が結合することにより、タンパク質全体の構造が変化し、その活性が変化すること。また、同様に、タンパク質の一部が化学的に修飾されることによって引き起こされる構造の変化と活性の変化に関しても、同様にアロステリック制御と呼ばれることも多い。
Monod-Wyman-Changeux モデルは、アロステリック制御を記述するための最もよく知られたモデルの一つである。このモデルでは、同一の部品が複数集まって作られたタンパク質を考え、化合物と結合した(あるいは化学的に修飾された)部品が増えると、一気にタンパク質全体の構造と活性が変化するというのが特徴である。
8.添付資料:
図1 Monod-Wyman-Changeux モデル
図2 反応の時系列
図3 反応が終了するまでの時系列