2019-06-29 神戸大学,新潟大学,理化学研究所
神戸大学大学院農学研究科の西田菜美子 (博士前期課程2年) と新潟大学大学院自然科学研究科のシェイ ダニエル (研究支援者) らは、ハクサイにおいて一定期間の低温処理によって発現が誘導されるRNAのうち、長鎖非コードRNA (lncRNA)※1を網羅的に同定することに成功しました。同定したlncRNAの中には、同じアブラナ科のシロイヌナズナ (モデル植物) の開花制御を担うlncRNAと類似性がなく、ハクサイの春化※2メカニズムには独自の分子メカニズムが存在する可能性が示されました。今後、アブラナ科野菜の品種育成への貢献が期待されます。
本研究は、神戸大学大学院農学研究科の藤本龍准教授ら、新潟大学大学院自然科学研究科の岡崎桂一教授ら、理化学研究所環境資源科学研究センター関原明チームリーダーら、農研機構野菜花き研究部門、オーストラリア連邦科学産業研究機構 (CSIRO) らの研究グループにより行われました。
この研究成果は、2019年6月26日午前10時 (イギリス時間) に、Scientific Reportsにオンライン掲載されました。
ポイント
- ハクサイの長鎖非コードRNA (lncRNA) を網羅的に探索し、4週間の低温処理 (春化処理) により発現が変動するlncRNAを同定。
- ハクサイの春化の鍵遺伝子として知られているFLOWERING LOCUS C (FLC) の発現が抑制される際に、lncRNAの関与は見られず、ハクサイが従来のモデル植物で提唱されているメカニズムとは異なる制御を受けている可能性が示された。
- ハクサイ等のアブラナ科葉菜類は、花芽をつけると商品価値が損なわれることから、栽培時に低温にさらされても花成誘導されにくい品種 (晩抽性品種) への需要が高く、本研究成果によるハクサイの品種育成への貢献が期待される。
研究の背景
植物の形質の多くは、タンパク質の働きによって決まっています。タンパク質の発現は、遺伝子 (DNA) の塩基配列情報をRNAに転写し、そしてタンパク質に翻訳されることで起こります。タンパク質を作る情報を持つRNAはメッセンジャーRNA (messenger RNA; mRNA) とよばれます。近年、タンパク質を作る情報を持たない非コードRNA(noncoding RNA)の存在が明らかになり、その長さによって、20塩基程度の小分子RNA (small RNA) と200塩基以上の長鎖非コードRNA(long noncoding RNA; lncRNA)に分類されています。植物では多くの種類のlncRNAが発現していることが明らかになっており、モデル植物のシロイヌナズナ (アブラナ科) では数万種類のlncRNAが発現しているとの報告があります。
しかし、lncRNAの多くについて、その役割は明らかになっていません。一方で、lncRNAが標的遺伝子の発現調節に関わることで植物の形質を制御していることを示す事例が幾つか見つかっています。
lncRNAが関わる現象として、春化が知られています。春化とは植物が長期間の低温にさらされることで花成が誘導される現象のことで、多くのアブラナ科野菜に見られ、ハクサイの花成誘導にも必要です。アブラナ科植物は、夏から秋にかけて栄養成長を行い、冬の期間に生殖成長への移行が起こり、春に花を咲かせます (図1)。アブラナ科野菜は栽培中に花芽が形成されると商品価値が損なわれることから、低温にさらされても花が咲きにくい晩抽性品種が育成されています。つまり、アブラナ科野菜の品種育成においては、春化メカニズムの理解が重要となります。
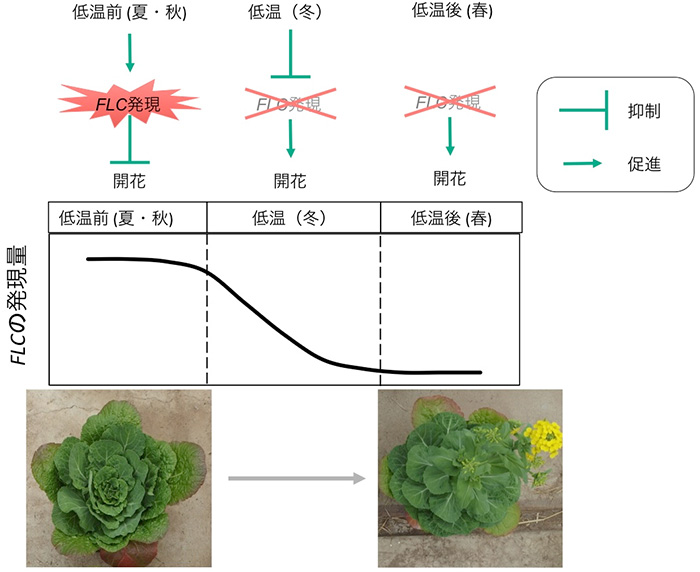
図1. ハクサイの花成誘導 (開花) について
モデル植物のシロイヌナズナでは、この春化メカニズムに関する研究が進んでいます。シロイヌナズナでは、開花抑制遺伝子であるFLOWERING LOCUS C (FLC) が、低温にさらされる前 (夏から秋) では発現しており、花成誘導が抑制されています。そして、長期間の低温 (冬) にさらされることで、FLC遺伝子の発現が抑制されます。一度発現が抑制されたFLCは、その後、温度が上昇しても(春)、抑制された状態を維持し、花成が誘導されます。この低温によるFLCの発現抑制には、低温によって発現が誘導される3つのlncRNA (COOLAIR, COLDAIR, COLDWRAP) が関わっていると考えられており、これらはFLC遺伝子座から転写されます。植物体が低温にさらされると、転写抑制に関わるヒストン化学修飾を引き起こすタンパク質複合体 (PRC2複合体) がFLC遺伝子座に誘導され、転写開始点付近では転写抑制型のヒストン修飾が蓄積します。この一連の反応によりFLC遺伝子の発現が抑制されます (図2中段)。その後、低温から通常温度に戻った時には、このヒストン修飾がFLCの遺伝子全体に広がることで、発現の抑制状態が維持され、開花に至ります (図2下段)。その際、COLDAIRやCOLDWRAPは、転写抑制の修飾を担うPRC2複合体をFLC遺伝子座へ誘導することが示されています。
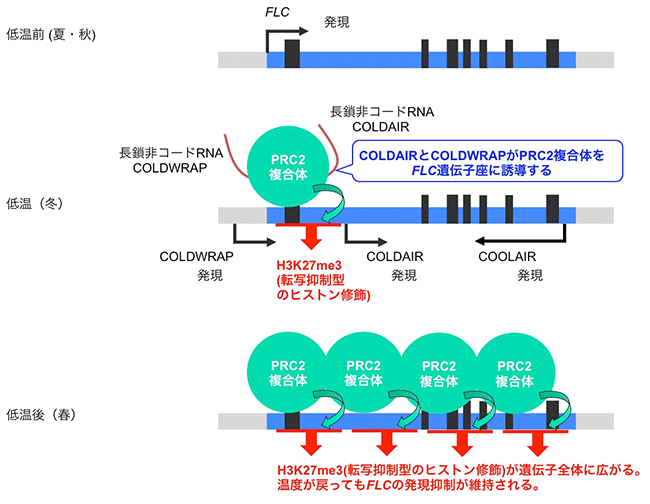
図2. シロイヌナズナの春化メカニズム
アブラナ科野菜の春化応答においても、シロイヌナズナ同様、FLC相同遺伝子が重要な役割を担っていると考えられています。ハクサイでも、低温によりFLC遺伝子の発現量が低下し、FLC遺伝子座には転写抑制型のヒストン修飾が蓄積することが確認されています。ハクサイはシロイヌナズナとの種分化後にゲノムの3倍体化が起こっており、FLC相同遺伝子は4つ存在します。シロイヌナズナとハクサイの間で、FLCのアミノ酸配列には高い相同性が見られますが、シロイヌナズナのCOLDAIRの塩基配列と相同性を示す領域はハクサイの4つのFLC遺伝子座には見られないことから (図3)、ハクサイにおいてもlncRNAが、PRC2複合体をFLC遺伝子座へ誘導するのに必要であるかは明らかにされていませんでした。
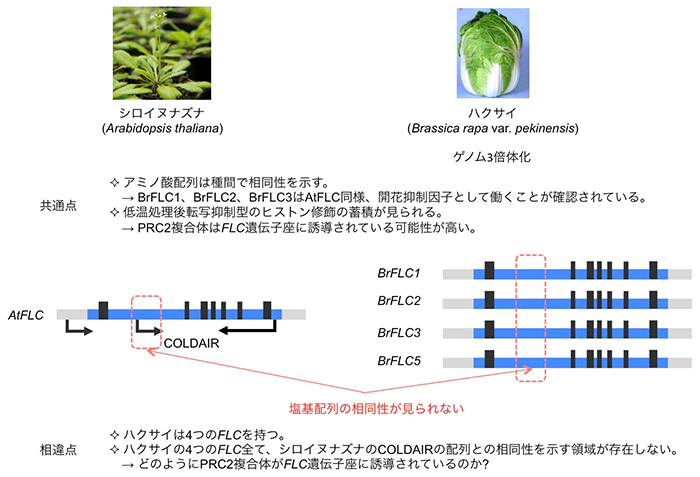
図3. シロイヌナズナとハクサイの春化メカニズムの比較
研究の内容
ハクサイ系統を2週間22℃で生育させた葉と、2週間通常温度で生育させた後4週間の低温処理 (4℃) した葉からトータルRNAを抽出し、RNA-sequencing※3により、転写産物の塩基配列を網羅的に決定しました。そして、この大量の塩基配列情報から、lncRNAを同定し、さらにその中から、低温処理によって発現量が変化したものを見出しました。
lncRNAの中には、遺伝子のイントロン領域から転写されるintronic RNAs (incRNAs) や、遺伝子のmRNAの転写方向と逆向きの方向で転写するnatural antisense transcripts (NATs) があります。incRNAsとNATsは、遺伝子領域においてmRNAsと同時に転写していることになります (図4)。
本研究では、incRNAsやNATsと転写領域が重なるmRNAが、低温処理によってどのような発現パターンを示すか調べたところ、多くの組み合わせで類似の発現パターンを示すものの、強い関連性は見られませんでした (図4)。しかし中には、低温下でのmRNAとNATsの発現量の動態が同じである組み合わせも見られ (図5)、mRNAの発現変動にNATsが関わっている可能性が示唆されました。
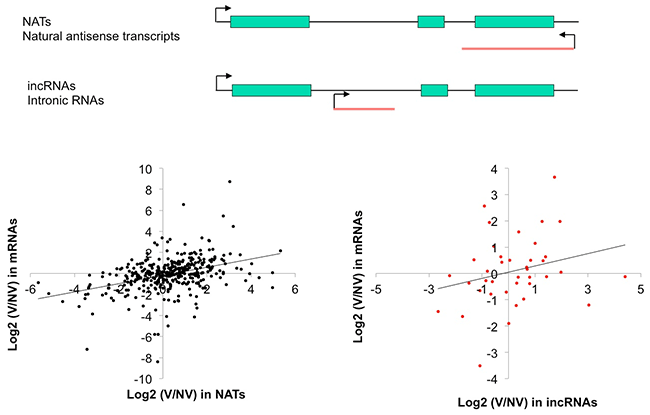
図4. 低温処理によるハクサイのlncRNA
横軸は、lncRNAの発現変化量、縦軸は転写領域が重なるmRNAの発現変化量、Vは4週間の低温処理後を示し、NVは低温処理前を示す。
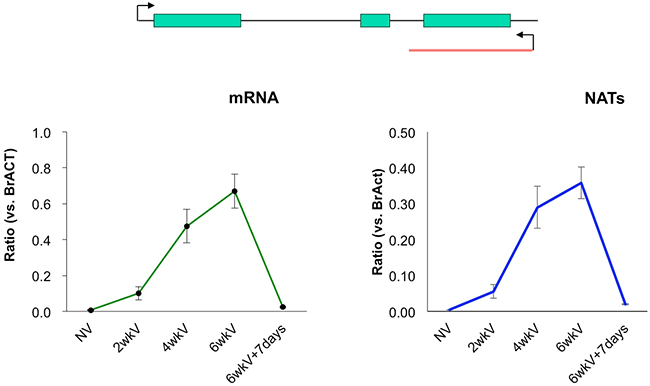
図5. mRNAとlncRNAが低温処理により同じ発現パターンを示す例
2, 4, 6wkVは、それぞれ2, 4, 6週間の低温処理を示す。6wkV+7daysは、6週間の低温処理の後に通常状態で7日間育成させたことを示す。
本研究では、BrFLC遺伝子座に着目して、低温によって発現が誘導されるlncRNAが存在するかを調べました。低温によって発現が誘導されるNATs (BrFLC2as) がBrFLC2のみで確認され、これは塩基配列や発現パターンにおいてCOOLAIRとの類似性が見られましたが、他のBrFLC1、BrFLC3、BrFLC5には見られませんでした (図6)。4つのBrFLC全てにおいて、COLDAIRとCOOLWRAPに類似性が見られるlncRNAは見られませんでした。我々は今までの研究から、4つのBrFLC遺伝子座全てにおいて、低温により転写抑制型のヒストン修飾が起こり、遺伝子の発現が抑制されることを明らかにしています。よって、ハクサイにおいても、低温によって、FLC遺伝子座にPRC2複合体が誘導されていると考えられますが、現時点では、このPRC2複合体の誘導に関わるlncRNAの存在は確認されませんでした。以上の結果から、低温にさらされたハクサイでは、シロイヌナズナとは異なる分子メカニズムによって、PRC2複合体がFLC遺伝子座に誘導されている可能性が示唆されました。
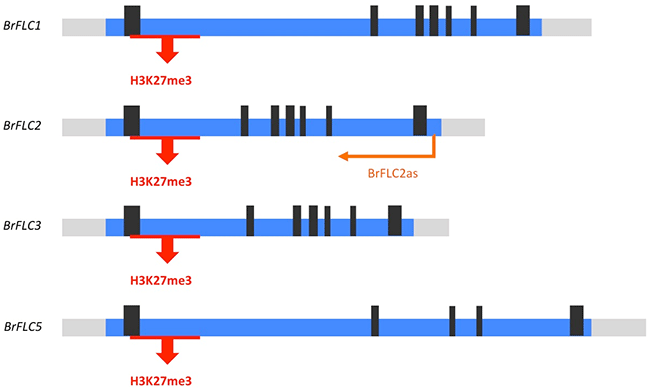
図6. 低温時のハクサイのFLC遺伝子座
BrFLC2においてのみ、NATs (BrFLC2as)が低温によって誘導される。
今後の展開
今回の研究から、ハクサイではFLC遺伝子座からはlncRNAの発現が誘導されていないことが分かり、シロイヌナズナで提唱されているモデルとは異なる分子メカニズムで春化が制御されている可能性が示唆されました。今後は、低温時のFLC遺伝子座にPRC2複合体がどのように誘導されるのかを明らかにしたいと考えています。そして、FLC遺伝子を介した春化メカニズムの全容を明らかにすることで、ハクサイの晩抽性品種育成に貢献できればと考えています。
用語解説
※1 長鎖非コードRNA (lncRNA):
アミノ酸をコードしないRNAのうち、長さが200bp以上のもの。発現量が低く、配列からの機能予測が難しいことから、多くの長鎖非コードRNAの働きは明らかにされていない。しかし、近年、幾つかの長鎖非コードRNAが植物の春化、長日感受性雄性不稔、種子休眠、病害抵抗性等において重要な役割を果たすことが示されている。
※2 春化:
長期間の低温に遭遇することによって花成が誘導されること。
※3 RNA-sequencing:
転写産物の塩基配列を直接決定すること。本法を用いることで転写産物を明らかにでき、さらに転写産物のリード数をカウントすることで、転写量を調べることができる。これにより、全遺伝子の転写産物のプロファイルが可能となり、このプロファイルを系統間あるいは、低温処理前後で比較すれば、サンプル間で発現量等が異なる遺伝子を明らかにすることができる。また、タンパク質をコードするmRNAだけでなく、RNAで機能するNoncoding RNA等の転写産物も同定できる。
謝辞
本研究は、以下の支援を受けて行われました。
日本学術振興会 二国間共同研究事業
日本学術振興会 国際共同研究加速基金
日本学術振興会 科学研究費 基盤研究B (15H04433, 18H02173)
ひょうご科学技術協会 学術研究助成事業
論文情報
- ・タイトル
- “Long noncoding RNAs in Brassica rapa L. following vernalization”
DOI:10.1038/s41598-019-45650-w - ・著者
- Daniel J. Shea+, Namiko Nishida+, Satoko Takada, Etsuko Itabashi, Satoshi Takahashi, Ayasha Akter, Naomi Miyaji, Kenji Osabe, Hasan Mehraj, Motoki Shimizu, Motoaki Seki, Tomohiro Kakizaki, Keiichi Okazaki, Elizabeth S. Dennis, Ryo Fujimoto
+ These authors equally contributed to this work - ・掲載誌
- Scientific Reports