2019-06-17 理化学研究所,株式会社ユーグレナ
理化学研究所(理研)環境資源科学研究センターバイオ生産情報研究チームの野村俊尚研究員、持田恵一チームリーダー、科技ハブ産連本部バトンゾーン研究推進プログラム微細藻類生産制御技術研究チームの鈴木健吾チームリーダー(株式会社ユーグレナ 執行役員研究開発担当/先端技術研究部長)らの研究チームは、ミドリムシの産業利用種Euglena gracilis[1](以下、ミドリムシ)を対象とした高効率のゲノム編集[2]方法の確立に初めて成功しました。
本研究成果は、ミドリムシの基礎研究の推進や、有用株の育種に大きく貢献すると期待できます。
ミドリムシは、食品やバイオ燃料への応用が進められている有用な微細藻類です。しかし、その基礎研究や有用株育種を進める上で重要である効率的なゲノム編集法は、これまで確立されていませんでした。
今回、研究チームは、ミドリムシ細胞にCas9 RNP複合体[3]を直接導入する手法を用いて、最適な条件を見いだすことにより、約80%という非常に高い編集効率で標的遺伝子への欠損・挿入変異導入に成功しました。さらに、2種類のCas9 RNP複合体を用いたDNAの特定領域への長い欠損変異の導入や、一本鎖のドナーDNA分子を用いた正確な外来DNA分子の導入も可能であることを明らかにしました。
本研究は、英国の科学雑誌『Plant Biotechnology Journal』の掲載に先立ち、オンライン版(5月26日付け)に掲載されました。
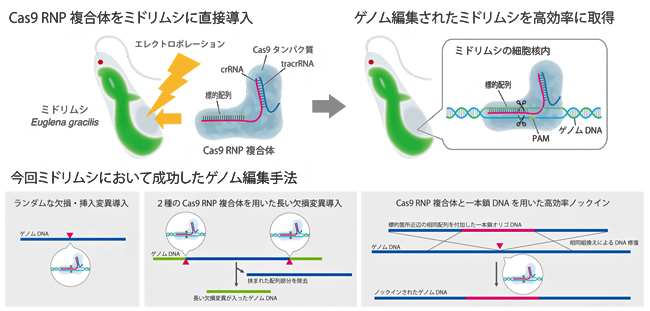
図 今回成功したミドリムシにおけるCas9 RNPを用いたゲノム編集手法の概要
※研究チーム
理化学研究所
環境資源科学研究センター バイオ生産情報研究チーム
研究員 野村 俊尚(のむら としひさ)
(理研科技ハブ産連本部 バトンゾーン研究推進プログラム 微細藻類生産制御技術研究チーム 研究員)
テクニカルスタッフII 井上 小槙(いのうえ こまき)
テクニカルスタッフII 上原(山口) 由紀子(うえはら(やまぐち) ゆきこ)
チームリーダー 持田 恵一(もちだ けいいち)
(理研科技ハブ産連本部 バトンゾーン研究推進プログラム 微細藻類生産制御技術研究チーム 副チームリーダー)
科技ハブ産連本部 バトンゾーン研究推進プログラム 微細藻類生産制御技術研究チーム
客員研究員 山田 康嗣(やまだ こうじ)
(株式会社ユーグレナ 先端技術研究部 先端技術研究課 チームリーダー)
客員主管研究員 岩田 修(いわた おさむ)
(株式会社ユーグレナ 経営戦略部)
チームリーダー 鈴木 健吾(すずき けんご)
(株式会社ユーグレナ 執行役員研究開発担当/先端技術研究部長)
背景
近年、持続可能性と経済活動を両立するバイオエコノミーの実現や、持続可能な開発目標(SDGs)[4]の達成に向けて、微細藻類を用いたバイオ燃料やバイオプラスチックなどの有用物質生産技術の開発が期待されています。
なかでも、屋内外での大量培養法が確立されているミドリムシの産業利用種Euglena gracilis(以下、ミドリムシ)は、好気条件下において、バイオプラスチックの材料や機能性食品となる貯蔵多糖パラミロン[5]を蓄積します(図1)。一方、嫌気条件下では、パラミロンからワックスエステルと呼ばれる油脂を産生します。ワックスエステルはジェット機燃料に適しており、現在、実用化に向けた試験が進められています。また、ミドリムシは栄養価が高く、世界的に需要が拡大しつつある飼餌料としても注目されています。このような背景から、ミドリムシを利活用するための生物学的知識の集積と、有用形質を持った改変株の作出が求められています。
しかし、実用的かつ持続的なミドリムシの遺伝子機能改変法は、まだ確立されておらず、それが基礎研究や効率的な育種を行う上での妨げとなっていました。そこで、研究チームは、将来的な産業利用の可能性も踏まえて、実用途に即したゲノム編集方法の確立を目指して研究を開始しました。
研究手法と成果
研究チームはまず、ミドリムシのパラミロン合成に関わる酵素の遺伝子EgGSL2[6]を標的としたガイドRNA(gRNA)[3]を設計し、標的DNAの切断活性を持ったCas9 RNP複合体を作製しました。次に、パラミロン粒の形態変化やT7E1 assay法[7]を指標とし、エレクトロポレーション法[8]を用いて、ミドリムシ細胞内にCas9 RNP複合体を直接導入するための最適な諸条件を探りました(図2, 図3)。
その結果、アンプリコンシークエンス解析[9]による評価において、Cas9 RNP複合体を導入後72時間で約80 %という、他の微細藻類では類を見ないほどの高効率でのランダムな欠損・挿入変異導入に成功しました。
また、ゲノム上の離れた位置を標的とする2種類のCas9 RNPをミドリムシの細胞内に同時に導入することで、長い欠損変異を誘発できました。さらに、Cas9 RNP複合体と一緒に、標的配列部位上下流と相同な配列を両端部に付加したssODN (一本鎖オリゴデオキシヌクレオチド)[10]を、ドナーDNAとしてミドリムシの細胞内に導入することで、正確な小規模(短い塩基配列)のノックイン[11]にも成功しました。
今後の期待
本研究では、他の微細藻類では類を見ないほどの高い効率で、ミドリムシにおけるDNAフリーゲノム編集手法の確立に成功しました。さらに、上記の高効率なゲノム編集法をベースに、ssODNを用いた効率的なノックイン実験にも成功し、より正確に制御されたミドリムシゲノムの改変も可能となりました。
今後、本技術を駆使することにより、ミドリムシにおける遺伝子機能の解析などの基礎研究の推進に加え、有用物質生産能を向上させた株の分子育種や目的に応じてデザインしたミドリムシの作出が可能となると期待できます。
また本研究は、国際連合が2016年に定めた17項目の「持続可能な開発目標 (SDGs)」のうち「7.エネルギーをみんなにそしてクリーンに」と「13.気候変動に具体的な対策を」への貢献が期待される成果です。
原論文情報
Toshihisa Nomura, Komaki Inoue, Yukiko Uehara-Yamaguchi, Koji Yamada, Osamu Iwata, Kengo Suzuki, Keiichi Mochida, “Highly efficient transgene-free targeted mutagenesis and single-stranded oligodeoxynucleotide-mediated precise knock-in in the industrial microalga Euglena gracilis using Cas9 ribonucleoproteins”, Plant Biotechnology Journal, 10.1111/pbi.13174
発表者
理化学研究所
環境資源科学研究センター バイオ生産情報研究チーム
研究員 野村 俊尚(のむら としひさ)
チームリーダー 持田 恵一(もちだ けいいち)
バトンゾーン研究推進プログラム 微細藻類生産制御技術研究チーム
チームリーダー 鈴木 健吾(すずき けんご)
(株式会社ユーグレナ 執行役員研究開発担当/先端技術研究部長)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- Euglena gracilis
- 田んぼや淡水の湖沼などに生育するユーグレナ属の微細藻類の一種で、古くから生物学実験に使用されている。本種は、大量培養法が確立されていることから、ミドリムシの中で最も産業利用に適しており、さまざまな用途での利活用が展開されている。
-
- ゲノム編集
- 核酸分解酵素(ヌクレアーゼ)などを部位特異的に作用させることで、遺伝情報を改変する技術。
-
- Cas9 RNP複合体、ガイドRNA(gRNA)
- Cas9 RNP複合体は、ゲノム上の標的箇所に基づいて設計したgRNAとCas9タンパク質から構成される安定的なリボ核タンパク質複合体で、gRNAに対応するゲノム上の標的DNAサイトを特異的に切断する。ゲノム編集におけるgRNAは、crRNA(CRISPR RNA)とtracrRNA(trans-activating crRNA)あるいはsingle guide RNAを指す。Cas9 RNPは、Cas9 (CRISPR associated protein 9)/gRNA (guide RNA) Ribonucleoproteinsの略。
-
- 持続可能な開発目標(SDGs)
- 2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず,先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)
-
- パラミロン
- グルコース(ブドウ糖)がβ-1,3結合した、ミドリムシにおける貯蔵多糖類。ミドリムシの細胞内で蓄積すると、粒状の構造体として見られる。また、嫌気条件下では、エネルギー獲得のため、パラミロンをもとに油脂(ワックスエステル)が生産される。
-
- EgGSL2遺伝子
- ミドリムシのパラミロン合成に関与する酵素遺伝子。この遺伝子を機能阻害すると、従属栄養培養条件でのパラミロン蓄積が低下する。EgGSL2はE. gracilis Glucan Synthase-Like 2の略。
-
- T7EI assay
- DNAのミスマッチを認識して切断する酵素であるT7 Endonuclease I (T7EI)を用いて、ゲノム編集などによる欠失・挿入変異の有無を簡易的に検出する手法。
-
- エレクトロポレーション法
- 電気穿孔法とも呼ばれ、電気パルスにより細胞膜に微小な穴を一時的に開け、物質(本研究の場合、Cas9 RNP複合体およびssODN)を直接的に導入する手法。
-
- アンプリコンシークエンス解析
- ゲノム上の特定の箇所(本研究ではEgGSL2遺伝子内の標的サイト)を増幅し、それらの塩基配列情報を、次世代シークエンサーを用いて網羅的に取得する解析手法。
-
- ssODN(一本鎖オリゴデオキシヌクレオチド)
- 一本鎖のDNA。ssODNをドナーDNAとして、RNP複合体などと一緒に細胞内に導入することで、相同性修復機構に基づくゲノムへのノックインや塩基置換が可能となる。
-
- ノックイン
- ゲノム上の標的部位にDNAを挿入する遺伝子工学的な手法。
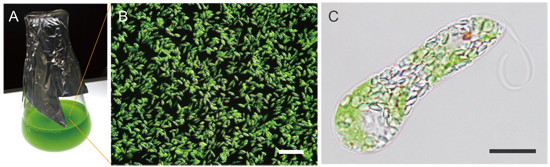
図1 ミドリムシ(Euglena gracilis)の好気条件での培養の様子と顕微鏡写真
(A) 実験室で液体培地を用いて振とう培養したミドリムシ。
(B) 培養液中で増殖しているミドリムシの様子。スケールバーは100マイクロメートル(μm、1,000分の1mm)。
(C) ミドリムシ1個体の顕微鏡像。細胞内に多数みられる小さな粒状のものがパラミロン粒である。スケールバーは10μm。
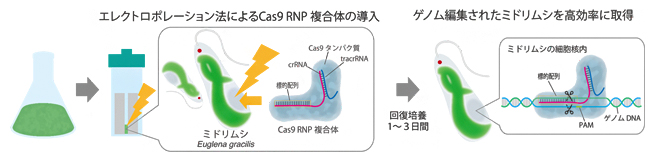
図2 Cas9 RNP複合体を用いたミドリムシ(Euglena gracilis)ゲノム編集手法の流れ
まず、ミドリムシの標的遺伝子EgGSL2に対応するgRNA(crRNAとtracrRNA)を設計し、Cas9 RNP複合体を作製する。これをエレクトロポレーション法にてミドリムシに直接導入する。このとき、最適化させた条件を用いることで、ゲノム編集個体を高効率かつ短時間で取得可能となった。
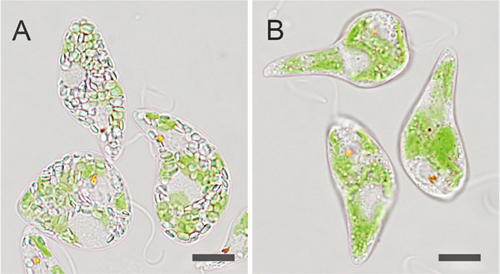
図3 Cas9 RNP複合体を用いたゲノム編集により作出したミドリムシ(Euglena gracilis)の例
(A) ミドリムシの野生株と、(B) パラミロン合成に関わる酵素のEgGSL2遺伝子を標的とするCas9 RNP複合体を導入し、作出したゲノム編集株の一例。Bのミドリムシでは、EgGSL2遺伝子の機能が失われているため、野生株において従属栄養培養下で生じるパラミロン粒の蓄積がほとんど見られない。スケールバーは10μm。



