国産クライオ電子顕微鏡の巻き返しと創薬研究への本格的応用に貢献
2019-05-21 理化学研究所
理化学研究所(理研)放射光科学研究センター生体機構研究グループの米倉功治グループディレクター、浜口祐研究員、内藤久志先任研究員、イメージング開発チームの眞木さおり研究員らの研究チーム※は、新型のクライオ電子顕微鏡[1]システムを構築し、タンパク質やその複合体を高い空間分解能[2]で高精度な構造解析に成功しました。
本研究成果は、海外の一社にほぼ独占されているクライオ電子顕微鏡に対する国産機の巻き返しにつながるとともに、クライオ電子顕微鏡解析の創薬研究への本格的な応用を加速すると期待できます。
クライオ電子顕微鏡を用いた「単粒子解析[3]」では、凍結した溶液中の比較的分子量の大きなタンパク質やその複合体の構造を明らかにできます。これに対して「電子線3次元結晶構造解析」では、タンパク質や低分子の微小で薄い結晶から電子線回折[4]を測定することで、その構造を解析できます。
今回、研究チームは、日本電子株式会社の新しいクライオ電子顕微鏡CRYO ARM 300を基に、干渉性が格段に優れた電子線を発生するなどの特徴を生かし、単粒子解析と電子線3次元結晶構造解析の両方が最適な性能を発揮できるようにシステムを設計しました。その結果、従来装置に比べて、高い空間分解能で、かつ非常に良い信号対雑音比(S/N比)[5]の信号を得ることができました。さらに、効率的な運用を可能にするソフトウェアを開発して、データ測定、構造解析を行ったところ、両手法による解析で世界最高品質のデータの取得に成功しました。
本研究は、米国の科学雑誌『Journal of Structural Biology』のオンライン版(3月27日付けと4月13日付け)に掲載されました。
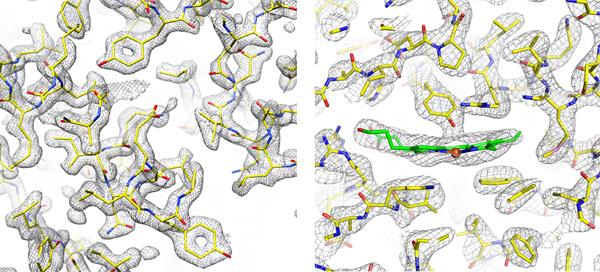
図 単粒子解析(左)と電子線3次元結晶構造解析(右)により得られたタンパク質の構造
※研究チーム
理化学研究所 放射光科学研究センター
利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治(よねくら こうじ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 理研-JEOL連携センター 次世代電子顕微鏡開発連携 ユニット ユニットリーダー)
研究員 浜口 祐(はまぐち たすく)
先任研究員 内藤 久志(ないとう ひさし)
XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
研究員 眞木 さおり(まき さおり)
リサーチアソシエイト(研究当時) 松浦 祥悟(まつうら よしのり)
センター長 石川 哲也(いしかわ てつや)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金挑戦的萌芽研究「電子線結晶構造解析によるクーロンポテンシャルの可視化(研究代表者:米倉功治)」、同基盤研究B「イオン駆動力供給体の電子線とX線による作動機構の解明(研究代表者:米倉功治)」、日本医療研究開発機構(AMED) 医療研究開発革新基盤創成事業 (CiCLE)「タンパク質構造解析のハイスループット化へ向けた装置開発」、科学技術振興機構(JST)先端計測分析技術・機器開発プログラム「電子顕微鏡の高精度制御及び生体高分子結晶構造解析ソフトウェアの開発(研究代表者:米倉功治)」などの支援を受けて行われました。
背景
クライオ電子顕微鏡の「単粒子解析」は、タンパク質溶液を急速凍結した試料を電子顕微鏡で撮影し、得られた2次元の分子像からコンピュータでその立体構造を再構成する技術です。この手法では結晶を必要とせず、生理的な溶液環境下のタンパク質の立体構造を明らかにできますが、これまで高い空間分解能の信号を記録する撮像装置がなく、詳しい構造情報を取得できませんでした。
しかし、最近の急速な技術革新によって空間分解能が格段に改善されたことにより、2017年のノーベル化学賞を受けました。現在では理想的な試料からは、従来のX線結晶構造解析[6]に勝る高い空間分解能で構造決定ができるようになりました。ただし、得られる像はコントラストが悪いため、ある程度大きな分子量を持つタンパク質やその複合体に対して用いることが適しています。
一方、クライオ電子顕微鏡を用いた「電子線3次元結晶構造解析」は、電子線がX線に比べて10万倍も強く試料と相互作用する特性を利用して、X線回折[4]には小さすぎて使用できない微小で薄い結晶から、電子線の回折データを測定し構造解析を行う技術です。微小な結晶しか得られない創薬ターゲットの膜タンパク質[7]や低分子の構造解析にも利用できることから、昨年のScience誌のBreakthrough of the year 2018の一つに選ばれるなど、注目を集めています。米倉グループディレクターは、その技術開発に当初から寄与してきました注1,2)。
このように大きな可能性を持つクライオ電子顕微鏡ですが、その専用装置は高価な上、海外の一社に独占されているのが現状でした。
注1)2015年2月23日プレスリリース「微小で薄いタンパク質結晶の電子線構造解析」
注2)2016年8月25日プレスリリース「生体分子の電荷分布の高精度解析法」
研究手法と成果
今回、研究チームは、日本電子株式会社(JEOL)のCRYO ARM 300をベースとした新型クライオ電子顕微鏡を、高空間分解能の単粒子解析と高精度の電子線3次元結晶構造解析の両方に最適なシステムにデザインし、理研の放射光科学研究センターに導入しました。
この新しい装置は、高い時間的干渉性を示す電子ビームを発生する冷陰極電界放射型電子銃、試料との相互作用でエネルギーを失った電子を除く電子分光装置、液体窒素自動補給機構、12個の試料の移送装置などを備え、自動撮影にも対応するなど最新の機能を持ちます。
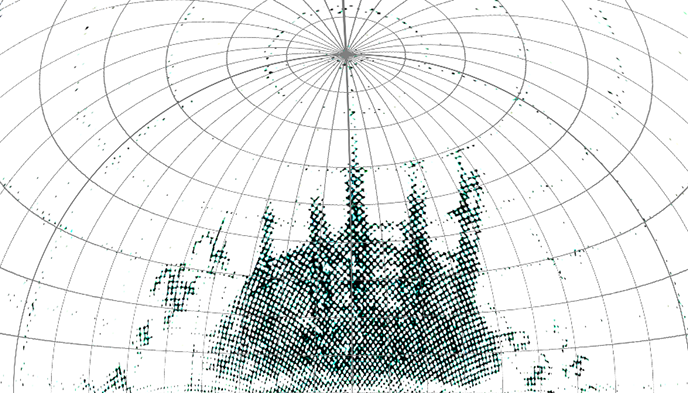
最大の特徴である高干渉性の電子ビームは、実際にタンパク質の像を撮影する条件で、高い空間分解能まで非常に良く情報を保持することが分かりました(図1)。
しかし、この方式の電子銃は時間とともに電子ビームが減衰するという欠点も持ちます。そこで、その特性を詳細に調査し、さらに装置を効率良く運用するためParallEMと名付けたソフトウェアを開発しました。その結果、単粒子解析により、生体内で鉄を貯蔵する役割を持つヒトのアポフェリチンというタンパク質の構造を、1.9オングストローム(Å、1Åは100億分の1メートル)という高い空間分解能で明らかにしました(図2)。この値は、他の装置を使用した解析例に比べて、有意に優れた空間分解能に相当します。得られた構造では、アミノ酸側鎖の芳香環の中央にある穴などが明瞭に解像でき、高い品質で構造解析できていることが分かります(図2右)。
さらに、従来に比べて少ない数の分子像から、構造が未知のウイルスの構造決定にも成功しました。クライオ電子顕微鏡で得られるタンパク質の像は、コントラストが低く信号対雑音比(S/N比)も悪いため、精度の高い構造を得るには非常に多くの分子像を集めて平均することで、信頼性を向上させる必要があります。本研究からこの新型のクライオ電子顕微鏡システムは、比較的少ない数の分子像からでも高い空間分解能で構造解析を可能とする高いポテンシャルを持つことも明らかにしました。
一方、電子線3次元結晶構造解析では、上述のように微小な結晶からでも高い空間分解能の構造情報を抽出できます。超分子複合体であり、有害な過酸化水素を分解する酵素であるカタラーゼの微小結晶から測定した電子線回折パターンを図3に示します。通常の装置では、電子線の試料との相互作用は非常に強いため、高いバックグラウンドのノイズが発生してしまいます(図3左)。しかし、新しい装置の電子分光装置と高い加速電圧(300kV)の電子線を併用することで、図3右のようなバックグラウンドノイズを大幅に減らした高品質な回折パターンを取得できるようになりました。さらに、回折データ測定用に開発したParallEMのGUIプログラムを利用することで、効率良くデータを測定でき、タンパク質の高品質な構造データを得ることに成功しました。
このデータをもとにカタラーゼの原子座標を精密化した結果、測定値との誤差が従来よりも非常に小さい高精度の構造解析が実現できました(図4)。研究チームは、この技術をeEFD (electron energy-filtered diffraction of 3D crystals)と名付けました。
今後の期待
今回、単粒子解析と電子線3次元結晶構造解析において、世界最高品質のデータを取得することに成功しました。薬の作用機構の解明には、より高い空間分解能で高精度に、タンパク質の構造を解析することが必要となるため、これらの結果は重要と考えられます。本成果により創薬応用の本格的な推進と、ほぼ米国のThermo Fisher Scientific社(FEI社)に独占されてきたクライオ電子顕微鏡に対して、国産機普及への巻き返しなどが期待できます。
原論文情報
- Tasuku Hamaguchi, Saori Maki-Yonekura, Hisashi Naitow, Yoshinori Matsuura, Tetsuya Ishikawa, and Koji Yonekura, “A new cryo-EM system for single particle analysis”, Journal of Structural Biology, 10.1016/j.jsb.2019.04.011
- Koji Yonekura, Tetsuya Ishikawa, and Saori Maki-Yonekura, “A new cryo-EM system for electron 3D crystallography by eEFD”, Journal of Structural Biology, 10.1016/j.jsb.2019.03.009
発表者
理化学研究所
放射光科学研究センター 利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治(よねくら こうじ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 理研-JEOL連携センター 次世代電子顕微鏡開発連携ユニット ユニットリーダー)
研究員 浜口 祐(はまぐち たすく)
先任研究員 内藤 久志(ないとう ひさし)
放射光科学研究センター XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
研究員 眞木 さおり(まき さおり)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- クライオ電子顕微鏡
- タンパク質などの生体分子を、水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料は氷中に保持でき、また、冷却することで電子線の照射による損傷を減らせる。Jacques Dubochetは氷包埋の手順を作り、2017年のノーベル化学賞の受賞者の一人に選ばれた。
-
- 空間分解能
- どのくらい細かくものを“見る”ことができるかの目安。空間分解能が小さな値では細かく(分解能が高く)、大きな値では粗く(分解能が低く)なる。空間分解能が高いほど、物体をより精細に観測できる。原子の大きさは、1オングストローム(Å、1Åは100億分の1メートル)程度で、原子モデルの構築には、3.5Å程度の空間分解能が必要になる。
-
- 単粒子解析
- 電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法。結晶を作製しなくても分子の構造が得られるが、特殊な形態の試料を除いて、到達できる空間分解能(細かい構造を可視化できる指標)が高くできないことが問題であった。しかし、この状況はここ数年で大きく進展し、理想的な試料ではX線結晶構造解析に勝る空間分解能で構造が決定できるようになった。この進展は、主として電子線直接検出型の量子検出効率のよい高速カメラの開発と、統計に基づく画像解析アルゴリズムの導入によりもたらされた。2017年のノーベル化学賞の受賞者の一人、Joachim Frankにより単粒子解析法の基礎が作られた。
-
- 電子線回折、X線回折
- 電子線やX線が結晶性の試料に散乱され、干渉して回折を示す現象のこと。分子の並びを反映した規則的な点の並びなどの特徴的なパターンが観測される。
-
- 信号対雑音比 (S/N比)
- 雑音(ノイズ)に対する信号(シグナル)の比。測定の精度を表す指標で、値が大きい程、測定の精度は増す。
-
- X線結晶構造解析
- 生体分子の立体構造を決めるのに使われる一般的な手法。精製したタンパク質試料に塩、添加化合物の種類、濃度、pH、温度などの条件を探索して、分子が規則正しく並んだ結晶を作製する。得られた結晶にSPring-8などの放射光施設の強力なX線を照射し、散乱されて得られた回折パターンの強度情報から、立体構造を計算し、原子モデルを構築する。この手法では、数マイクロメートル~百マイクロメートル(μm、1μmは100万分の1メートル)サイズの良質な結晶を必要とするが、結晶化が非常に難しい試料も多い。
-
- 膜タンパク質
- 細胞膜を構成しているタンパク質で、全ゲノムがコードするタンパク質の3分の1を占める。細胞膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。細胞外のシグナルを捕える受容体、細胞膜を介して物質の出入を担うチャネルやポンプ、細胞同士の結合に関わる接着分子など、生命活動に重要な役割を果たす。疾病に関連しているものも多く創薬の重要なターゲットとされるが、結晶化が難しく構造解析が最も進んでいない。

図1 金属の薄膜のフーリエ変換像
他の電子顕微鏡より高い空間分解能の信号が得られる。数字はプラチナイリジウム由来の反射を示す。タンパク質に用いるのと同じ撮影条件で、1.13Åの高い空間分解能まで情報を保持していることが分かる。同心円状のリングは、電子顕微鏡の情報を伝達する空間周波数特性を示す。
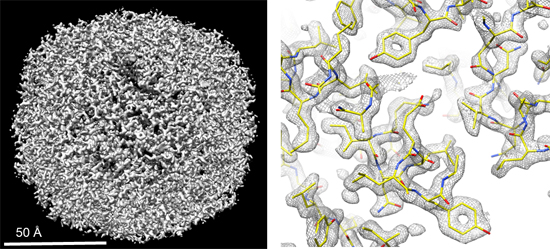
図2 ヒトのアポフェリチンの構造
左の全体構造をズームアップした一部を右に示しており、芳香環の中央に穴が開いているのがきれいに解像できている。黄色、赤、青は、それぞれ炭素、酸素、窒素原子を表す。
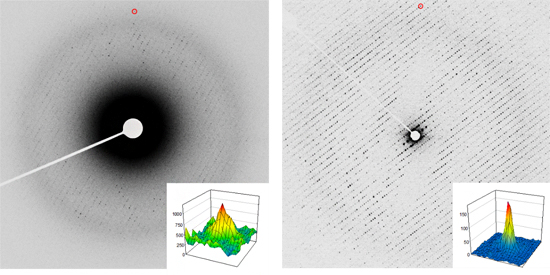
図3 カタラーゼの3次元の微小結晶からの電子線回折パターン
左: 従来の電子顕微鏡を使用。右: 新型電子顕微鏡システムを使用。赤丸(図の上)で囲んだ回折点(約3Å分解能)の形状を右下に表示。右図でバックグラウンドノイズが大幅に下がっているのが分かる。従来の装置では左図の中央のように高いバックグラウンドノイズのため、表示レベルが飽和し黒くなる部分が大きい。個々の回折点のバックグラウンドノイズも高くなってしまう。
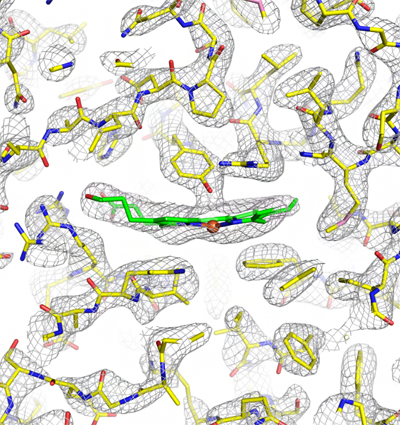
図4 eEFDにより解析したカタラーゼの構造
ヘム結合部位の周辺のズームアップを示す。測定値との誤差が従来よりも非常に小さい高精度の構造解析が実現した。緑はへムの炭素、茶色の球は鉄原子、黄色、赤、青は、タンパク質中のそれぞれ炭素、酸素、窒素原子を表す。