ガンマ線架橋したゼラチン-液体金属ナノ粒子の開発により実現
2021-12-21 量子科学技術研究開発機構
ポイント
- 液体金属に生体分子を吸着させた複合体へのガンマ線照射によりコア-シェル型の構造を持つナノ粒子の作製に成功
- ガンマ線架橋したゼラチン-液体金属ナノ粒子がEPR効果により腫瘍に集積し、マウスに移植したがんの可視化と、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)、先端科学技術研究科 物質化学領域の都 英次郎准教授とセキ ウン大学院生(博士前期課程)は、量子科学技術研究開発機構(理事長・平野 俊夫、千葉県千葉市)、高崎量子応用研究所 先端機能材料研究部(群馬県高崎市)の田口 光正上席研究員(「生体適合性材料研究プロジェクト」プロジェクトリーダー)、木村 敦上席研究員と共同で、量子ビーム(ガンマ線*1)架橋技術を用いて、ガリウム-インジウム合金から成る液体金属*2表面に様々な生体高分子(ゼラチン、DNA、レシチン、牛血清蛋白質)がコートされ、安定な状態を保つことができるコア-シェル型*3のユニークな構造を有すナノ粒子の作製に成功した(図1)。得られたゼラチン-液体金属ナノ粒子は、EPR効果*4によって大腸がんを移植したマウス体内の腫瘍内に集積し、生体透過性の高い近赤外レーザー光*5により、がん患部の可視化と光熱変換による治療が可能であることを実証した。さらに、マウスがん細胞とヒト正常細胞を用いた細胞毒性試験と生体適合性試験を行い、いずれの検査からもゼラチン-液体金属ナノ粒子が生体に与える影響は極めて少ないことがわかった。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待される。
研究背景と内容
ガリウム・インジウム(Ga/In)合金からなる室温で液体の金属(液体金属)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけナノ粒子化した液体金属をバイオメディカル分野に応用する研究に大きな注目が集まっている。研究チームでも、液体金属をがん患部に送り込むことができれば、生体透過性の高い近赤外レーザー光を用いることで、患部の可視化や光熱変換を利用した、新たながんの診断や治療が実現できるのではないかと考え、研究をスタートさせた。
液体金属をナノ粒子化するためには煩雑な合成プロセスが必要であり、ナノ粒子化した液体金属の構造や機能を溶媒中で安定的に保持させることは難しい。そこで、研究チームは、液体金属をがん患部まで送り、がん細胞内に取り込ませるために、液体金属表面に生体高分子(ゼラチン、DNA、レシチン、牛血清蛋白質)を吸着させたコア-シェル型ナノ粒子の作製を試みた。Ga/In液体金属と生体分子の混合物に超音波照射することで、コア-シェル型ナノ粒子を形成できることを見出したが、そのままではナノ粒子の構造を水中で安定的に維持させることはできなかった。
この問題を解決するために、ナノ粒子表面の生体高分子がバラバラにならないよう、量子ビーム(ガンマ線)架橋反応を利用すれば、架橋剤などの細胞毒性を有する薬剤を用いることなく、生体高分子の特性を保持したまま安定化できると考えた。この方法でガンマ線架橋したゼラチン-液体金属ナノ粒子は、30日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し毒性が無いこと、近赤外レーザー光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。
大腸がんを移植して10日後のマウスに、ゼラチン-液体金属ナノ粒子を投与し、4時間後に740~790 nmの近赤外光を当てたところがん患部だけが蛍光を発している画像が得られ、当該ナノ粒子がEPR効果によりがん組織に取り込まれていることが分かった(図2(左))。そこで、当該ナノ粒子が集積した患部に対して808 nmの近赤外レーザー光を照射したところ、光熱変換による効果で26日後には、がんを完全に消失させることに成功した(図2(右))。
さらに、ゼラチン-液体金属ナノ粒子の細胞毒性と生体適合性を評価した。2種類の細胞[マウス大腸がん由来細胞(Colon-26)、ヒト胎児肺由来正常線維芽細胞(MRC5)]を培養する培養液中に、ゼラチン-液体金属ナノ粒子を、添加量を変えて投与・分散させ、24時間後に細胞内小器官であるミトコンドリアの活性を指標として細胞生存率を測定した結果、細胞生存率の低下は見られず、細胞毒性はなかった(図3)。また、ゼラチン-液体金属ナノ粒子をマウスの静脈から投与し、生体適合性を血液検査(1週間調査)と体重測定(約1ヵ月調査)により評価したが、いずれの項目でもゼラチン-液体金属ナノ粒子が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発した生体高分子のナノ粒子コーティング技術が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジー、光学、量子ビーム工学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2021年12月20日に先端材料分野のトップジャーナル「Applied Materials Today」誌(Elsevier発行)のオンライン版に掲載された。なお、本研究は、日本学術振興会科研費(基盤研究A)及び総合科学技術・イノベーション会議 官民研究開発投資拡大プログラム(Public/Private R&D Investment Strategic Expansion PrograM:PRISM)の支援のもと行われたものである。
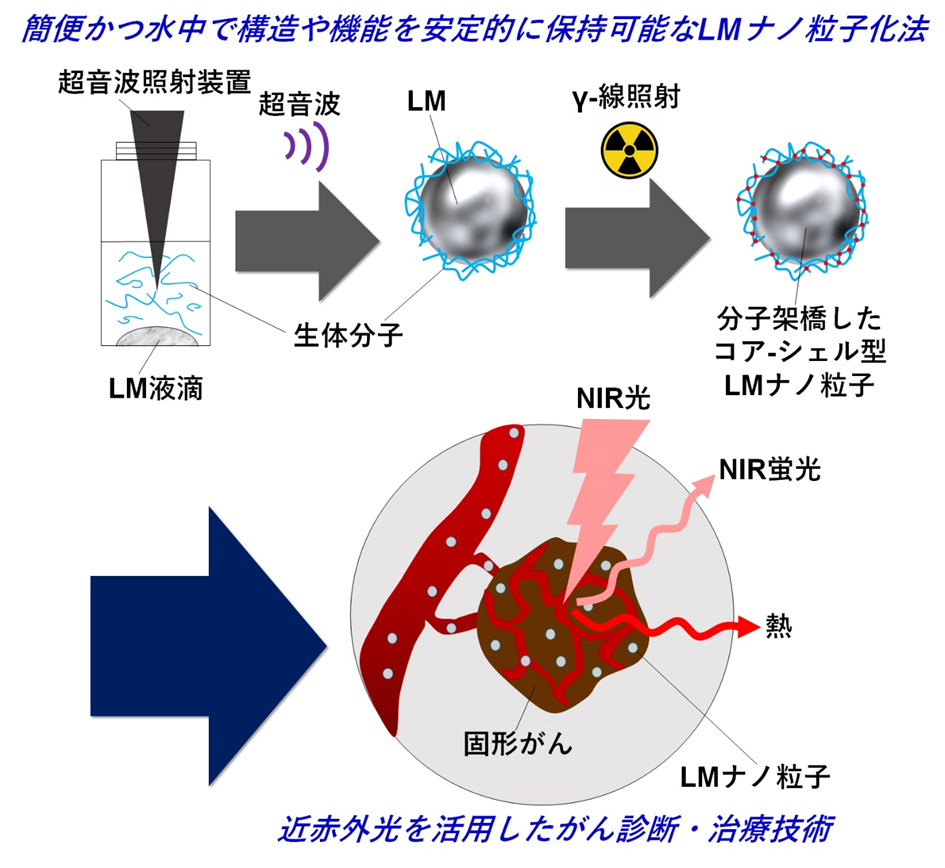
図1. ガンマ線を利用した生体分子-液体金属ナノ複合体の合成と当該ナノ粒子を活用した光がん療法の概念。LM: 液体金属、NIR: 近赤外、FL: 蛍光。
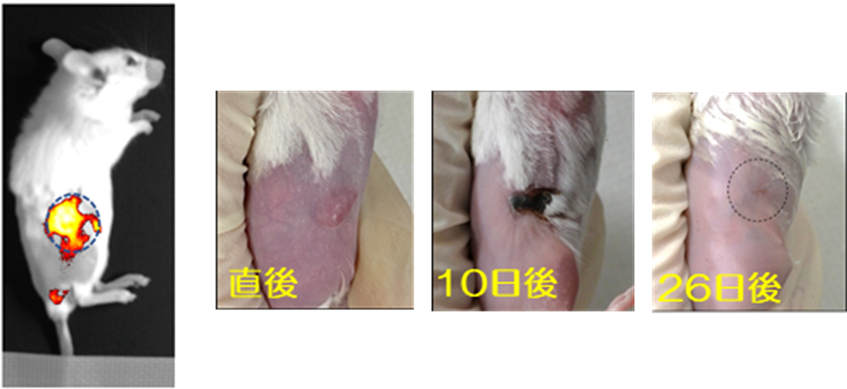
図2. ナノ粒子をがん患部に集積・可視化(左)し、光照射によりがんを治療(右)。
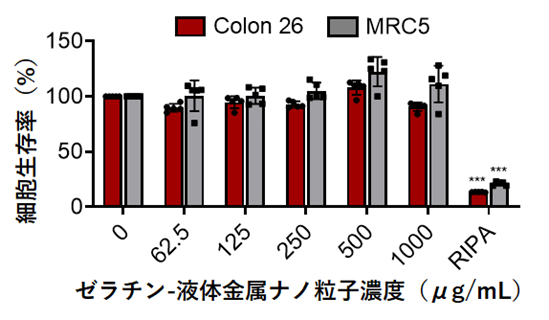
図3. CCK-8法によるゼラチン-液体金属ナノ粒子の細胞毒性評価。
赤:マウスの大腸がん細胞、グレー:ヒトの正常細胞、
RIPA: Radioimmunoprecipitation Buffer(細胞や組織の溶解に使用される緩衝液、本実験の陽性対照に利用)
論文情報
掲載誌 Applied Materials Today
論文題目 Sonication- and γ-ray-mediated biomolecule-liquid metal nanoparticlization in cancer optotheranostics
著者 Qi Yun, Atsushi Kimura, Mitsumasa Taguchi, Eijiro Miyako*
掲載日 2021年12月20日にオンライン版に掲載
DOI 10.1016/j.apmt.2021.101302
関連研究情報
北陸先端科学技術大学院大学(JAIST)、先端科学技術研究科物質化学領域の都研究室では、近赤外レーザー光により容易に発熱するナノ材料の特性(光発熱特性)に注目し、これまでに、“三種の神器”を備えた多機能性グラフェン(2020年4月23日 JAISTからプレス発表)、ナノテクノロジーと遺伝子工学のマリアージュ(2020年8月17日 JAISTからプレス発表)、がん光細菌療法の新生(2021年2月16日JAISTからプレス発表)などの光がん療法を開発している。
量子科学技術研究開発機構(QST)、先端機能材料研究部プロジェクト「生体適合性材料研究」では、量子ビーム微細加工技術による先端医療デバイスの創製の一環として、これまでに、診断や創薬における微量検体の分析性能が数10倍に!(2019年6月25日 QSTからプレス発表)、平面状の細胞シートが立体的に!細胞が自分の力でシートを3次元化(2021年7月14日QSTからプレス発表)などの機能性材料作製技術を開発している。
用語説明
*1 ガンマ線
ガンマ線とは、放射性同位元素(コバルト60など)の崩解によって放出される量子ビームの一種。
*2 液体金属
室温以下あるいは室温付近で液体状態を示す金属のこと。例えば、水銀(融点マイナス約39℃)、ガリウム(融点約30℃)、ガリウム-インジウム合金(融点約15℃)がある。
*3 コア–シェル型
コアは核、シェルは殻を意味し、一つの粒子で核と殻の素材が異なるものをこのように呼ぶ。
*4 EPR効果
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみがん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
*5 近赤外レーザー光
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。