α線を放出するアスタチン-211を用いた新たな薬剤により悪性黒色腫の顕著な抑制に成功
2019-09-24 量子科学技術研究開発機構
発表のポイント
- 悪性黒色腫などのがん細胞の表面に存在する“代謝型グルタミン酸1型受容体(mGluR1)1)”に結合してα線2)を放出する標的アイソトープ3)治療薬候補211At-AITM4)を開発した
- mGluR1が細胞表面に多く存在する悪性黒色腫5)モデルマウスに211At-AITMを投与した結果、がん細胞の増殖が顕著に抑制された
- 治療中、副作用の指標となる体重減少などは認められなかった
- 悪性黒色腫のみならず、乳がんや大腸がんなどの治療薬候補としての展開も期待できる
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子医学・医療部門 放射線医学総合研究所 先進核医学基盤研究部 謝琳主任研究員、破入正行研究員、張明栄部長らは、がん細胞の表面に存在する代謝型グルタミン酸1型受容体(mGluR1)に結合し、悪性黒色腫に対するα線を放出する新しい標的アイソトープ治療薬候補211At-AITMの開発に成功し、モデルマウスによりそのがん増殖抑制効果を明らかにしました。
悪性黒色腫は、日本では10万人に1~2人が発症する希少がんで、皮膚だけでなく、眼球、鼻腔、口腔、食道などの粘膜にも発生します。悪性黒色腫が皮膚や粘膜にとどまっていれば、病変とその周囲を切除する外科手術による治療となります。しかし、リンパ節や他の臓器に転移した場合には外科手術、放射線治療、抗がん剤などの薬剤療法を組み合わせた治療が行われますが、従来の放射線治療は効きにくいため、予後が悪く、新たな治療法の開発が望まれています。
量研では、放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高いα線を放出する放射性核種アスタチン-211(211At)を加速器で効率よく製造することに成功しています(2016年6月13日プレスリリース)。この211Atをがん細胞だけに送り込むことが出来れば、周囲の正常細胞にダメージを与えることなく、がん細胞だけ殺すことができます。
そこで、本研究では、悪性黒色腫のがん細胞表面に高密度に存在しているmGluR1というタンパク質に着目し、mGluR1と強く結合する低分子化合物ITMを開発しました。次にITMに211Atを付加してα線を放出する標的アイソトープ治療薬候補として211At-AITMを作製しました。
211At-AITMを、悪性黒色腫のモデルマウスに1回投与したところ、顕著ながん増殖抑制効果があることを確認しました。一方で、副作用の指標となる体重減少などは認められませんでした。
このことから、211At-AITMによるα線を放出する標的アイソトープ治療は、悪性黒色腫に対して副作用の少ない効果的な治療法となることが期待されます。また、mGluR1は乳がんや大腸がんなどの細胞表面にも高密度に存在していることから、これらのがんに対する治療薬候補としても展開できることが期待されます。
この成果は、核医学研究の分野でインパクトの大きい論文が数多く発表されている米国核医学会誌「Journal of Nuclear Medicine」2019年8月26日にオンライン掲載されました。
研究の背景と目的
悪性黒色腫は、日本では10万人に1~2人が発症する希少がんで、皮膚だけでなく、眼球、鼻腔、口腔、食道などの粘膜にも発生します。悪性黒色腫が皮膚や粘膜にとどまっていれば、病変とその周囲を切除する外科手術による治療となります。
しかし、特に顔面・頭頸部に発生した場合は機能や容姿を大きく損なう問題があり、外科手術による治療が困難となることが多く、放射線と抗がん剤などを併用した治療が行われます。また、リンパ節や他の臓器に転移した場合には外科手術、放射線治療、抗がん剤などの薬剤療法を組み合わせた治療が行われますが、従来の放射線治療は効きにくいため、予後が悪く、新たな治療法の開発が望まれています。近年は免疫チェックポイント阻害薬や分子標的薬による治療成績の向上が期待されていますが、それぞれ副作用や効果に個人差があるといった問題があることもわかってきました。
量研では、体の外から放射線を照射してがんを治療する重粒子線治療に、体内に投与した放射性核種から出る放射線でがんを治療する標的アイソトープ治療を組み合わせることで、最初に発生したがん(原発巣)と転移したがんの両方を治療することを目指して研究開発に取り組んでいます。頭頸部の粘膜悪性黒色腫に対する重粒子線治療では、外科手術による治療が困難な症例でも良好な治療成績が得られ、現在は保険診療での治療を行っています。
一方、標的アイソトープ治療では、放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高いα線を放出する放射性核種211Atを加速器で製造することに成功しています。この211Atをがん細胞に効率よく届けることが出来れば、周囲の正常組織に障害を与えることなくがんを治療することが可能ではないかと考えました。
そこで、211Atを悪性黒色腫に届ける手法として、正常細胞と比べてがん細胞の表面に高密度に存在している代謝型グルタミン酸1型受容体(mGluR1)というタンパク質に着目しました。mGluR1は、悪性黒色腫、乳がんなど多くのがんの細胞表面に存在し、がんの発生や成長と大きく関わることが知られています。
そのため、先進核医学基盤研究部では、数年前からがんの診断や治療薬剤の開発において、mGluR1が有望な標的分子になり得ると考え、mGluR1に結合する放射性薬剤の開発に取り組んできました。現在までにmGluR1と強く結合する数種の低分子化合物を陽電子放射断層撮影(PET:Positron Emission Tomography)用の放射性同位体である18Fや11Cで標識した、診断用の放射性薬剤を開発しました。これらの薬剤を用い、生きた動物に対してPETによるがんのイメージングに成功してきました。
これまでのmGluR1に結合する化合物の開発や、その化合物を放射性同位体で標識した薬剤の開発で得られた技術や治験を活かし、本研究では、mGluR1に結合してα線を放出する新しい標的アイソトープ治療薬候補として新たに211At-AITM(4-211At-astato-N-[4-(6-(isopropylamino)pyridine-4-yl)-1,3-thiazol-2-yl]-N-methylbenzamide)(図1)を開発し、モデルマウスを用いて悪性黒色腫に対するがん増殖抑制効果を評価しました。
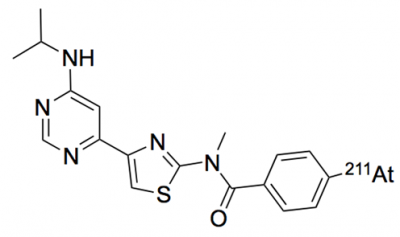
図1 211At-AITMの構造式
研究の手法と成果
悪性黒色腫のがん細胞表面に高密度に存在しているmGluR1と強く結合する低分子化合物ITM (N-[4-[6-(isopropylamino)pyrimidin-4-yl]-1,3-thiazol-2-yl]-N-methylbenzamide)に211Atを付加して211At-AITMを作製しました。
悪性黒色腫瘍細胞を皮下に移植したモデルマウスに211At-AITMを1回静脈投与して、がんの大きさの変化を調べました。その結果、211At-AITMを1.11 MBq6)、1.85 MBq、2.96 MBq投与したグループで、211At-AITMを投与しなかったグループに比べて、いずれも有意ながん増殖抑制効果が確認されました(図2)。
211At-AITMの2.96 MBq投与群においては、がんが完全に消失するマウスも現れました。
一方、211At-AITMを投与した全ての群において、副作用として懸念された体重減少などは観察されませんでした。
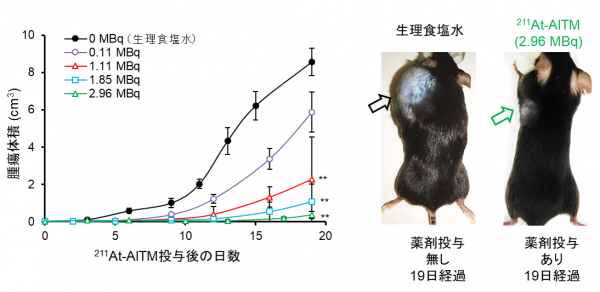
図2 211At-AITM投与によるがん増殖抑制効果の比較
マウスに移植した悪性黒色腫の体積(or容積)変化でがん細胞の増殖抑制効果を評価。
211At-AITMは、非投与群(グラフの黒線)と比べて、1.11 MBq(赤線)あるいは1.85 MBq(青線)、2.96 MBq(緑線)それぞれ1回の投与で有意にがんの増殖が抑えられた。特に、2.96 MBqを投与した群では、がんが完全に消失するマウスも現れた。右が211At-AITMを1回投与したマウス。
今後の展開
本研究により、211At-AITMによるα線標的アイソトープ治療は、悪性黒色腫に対する顕著な増殖抑制効果を有することがわかりました。標的アイソトープ治療薬は、一般的な抗がん剤と比べて非常に少ない投与量で治療できるとされています。それに加えて、211At-AITMはがん細胞表面のmGluR1に選択的に結合してがん細胞に作用するため、従来の抗がん剤を用いた治療法よりも副作用を低減し、かつ効果的に悪性黒色腫を治療できることが期待できます。また、悪性黒色腫の約70%以上において、mGluR1が高密度に存在していることから1)、mGluR1を標的とした211At-AITMによるα線標的アイソトープ治療は、従来の分子標的薬を用いた治療法よりも多くの患者さんに適応可能となることが期待されます。現在、悪性黒色腫だけでなく、mGluR1が細胞表面に高密度に存在する乳がん、大腸がんなどについても、モデル動物を用いて、がん増殖抑制効果の評価を始めています。
本研究で開発したAITMの合成や、AITMに211Atを結合させる技術により、ヒトに投与できる品質の211At-AITMを安定的に製造、供給することが可能となります。今後はヒトへの応用に向けて、薬剤のより一層の安全性や治療の最適化に向けた検討に取り組んでいきたいと考えています。
用語解説
1.)代謝型グルタミン酸1型受容体(mGluR1)
mGluR1は細胞表面に存在しているタンパク質で、細胞の増殖や分化などに関与しているといわれています。悪性黒色腫、乳がん、大腸がんなど多くの種類のがんで高い発現をしており、がん細胞の増殖とがんの成長に関与していることがわかっています。mGluR1を発現する悪性黒色腫の割合については、複数の研究グループによる報告があり、その割合は報告により異なり、68~80%と幅があります。
2.)α線
α線はヘリウム原子核が非常に速いスピードで飛んでいるものです。物質中を通過する際、物質と相互作用し、例えば物質中の分子が持っている電子を弾き飛ばす(電離といいます)ことで、物質に対してエネルギーを付与します。α線は質量が大きく、物質中の分子などと衝突しやすいため、透過性が非常に低く、紙一枚で遮断することができる代わりに、物質中では短い通過距離で高いエネルギーを付与することから、分子などを密に電離することができます。α線を細胞に照射した場合、DNAに、修復することが難しいキズ(DNA二重鎖切断)ができます。この現象はα線が、がん細胞を効果的に殺滅できる理由のひとつです。
3.)標的アイソトープ治療
細胞傷害能力を有する粒子放射線(α線やβ線)を放出する放射性同位体を用いた治療法。RI内用療法、核医学治療とも呼ばれます。放射性同位体を体内に注射し、がん細胞だけを標的として、がん細胞に粒子放射線を体内から照射し殺傷します。
4.)211At-AITM
α線を放出する核種であるアスタチン-211(211At)をITM(N-[4-[6-(isopropylamino)pyrimidin-4-yl]-1,3-thiazol-2-yl]-N-methylbenzamide)で標識した新しい放射性医薬品候補です。悪性黒色腫に高発現している代謝型グルタミン酸1型受容体(mGluR1)に結合する化合物です。
5.)悪性黒色腫
皮膚、眼窩内組織、口腔粘膜上皮などに発生するメラノサイト由来で転移しやすく、予後不良の悪性腫瘍です。正確な発生原因は不明ですが、表皮基底層部に存在するメラノサイトの悪性化によって発症します。また、皮膚に発生する悪性黒色腫は紫外線曝露と、足底に発生するものは機械的刺激と関連性が深いと考えらます。
6.)MBq(メガベクレル)
放射能の単位。
放射能量(放射能の強さ)を示す単位。ベクレル(Bq)に100万倍を表す接頭辞「メガ」を付けて表すものである。
1ベクレルは、放射性同位体が1秒間に1回の原子核崩壊を起こして1本の放射線を発する性質(放射能)の強さを表す。1メガベクレルは、1秒間に100万本の放射線を発する放射能をもつことを表す。
論文について
131I-IITM and 211At-AITM: Two Novel Small-molecule Radiopharmaceuticals Targeting Oncoprotein Metabotropic Glutamate Receptor 1
Lin Xiea,1, Masayuki Hanyua,1, Masayuki Fujinaga1, Yiding Zhang1, Kuan Hu1, Katsuyuki Minegishi1, Cuiping Jiang1, Fuki Kurosawa1,2, Yukie Morokoshi2, Huizi Keiko Li2,3, Sumitaka Hasegawa2, Kotaro Nagatsu1, Ming-Rong Zhang1.
1Department of Advanced Nuclear Medicine Sciences,
2Department of Charged Particle Therapy Research, National Institute of Radiological Sciences, National Institutes for Quantum and Radiological Science and Technology, Chiba, Japan.
3The Japan Society for the Promotion of Science, Japan.