生体内の狙った疾患部位で働く糖鎖付加人工金属酵素の開発
2919-07-02 理化学研究所
理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員(科技ハブ産連本部バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 副チームリーダー)、ケンワード・ヴォン基礎科学特別研究員、江田昌平特別研究員(研究当時)、イゴール・ナシブリン特別研究員らの国際共同研究グループ※は、がん細胞で遷移金属触媒反応[1]を実施することにより、抗がん活性分子を合成して、がんを効果的に治療することに成功しました。
本研究成果は、生体内の疾患部位において触媒的に薬剤を合成することから、副作用の少ない次世代がん治療法として利用されることが期待できます。
近年、効率的な遷移金属錯体触媒や人工金属酵素[2]が開発されていますが、反応を妨げることもあるさまざまな生体分子の共存下では、これらの金属触媒を失活させずに、求める触媒反応を実施することは困難でした。
今回、国際共同研究グループは、糖鎖付加アルブミン[3]の疎水性ポケットにルテニウム触媒を導入することで、生体内でも閉環メタセシス反応[4]の触媒活性が保持されることを見いだしました。さらに、ヒトがん細胞に選択的に糖鎖付加アルブミン・ルテニウム触媒を導入して、強い抗がん活性を持つ天然物であるウンベリプレニンを触媒的な閉環メタセシス反応により「現地合成」し、治療することに成功しました。
本研究は、英国の科学雑誌『Nature Catalysis』のオンライン版(7月1日付け:日本時間7月2日)に掲載されます。
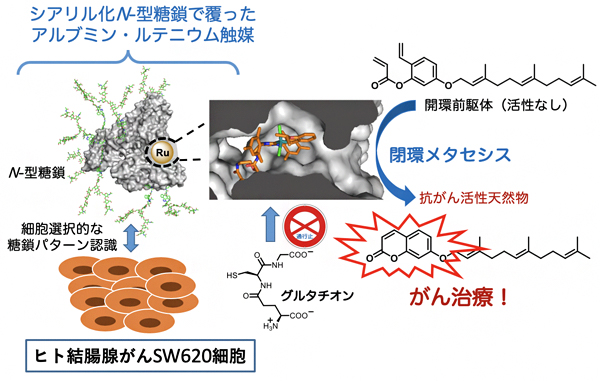
図 抗がん活性天然物の触媒的「現地合成」によるがん治療
※国際共同研究グループ
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(科技ハブ産連本部バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 副チームリーダー)
基礎科学特別研究員 ケンワード・ヴォン(Kenward Vong)
特別研究員(研究当時) 江田 昌平(えだ しょうへい)
特別研究員 イゴール・ナシブリン(Igor Nasibullin)
環境資源科学研究センター
創薬シード化合物探索基盤ユニット
研究員 工藤 紀雄(くどう のりお)
ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(よしだ みのる)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
背景
有機合成化学の分野では、薬剤や機能性材料などさまざまな分子を自在に合成するために、これまでに多くの金属触媒が開発されてきました。近年、金属触媒の中でも遷移金属(周期表で第3族から第11族までに属する元素)触媒を用いた新しい有機合成反応が盛んに研究されています。
これまで遷移金属触媒反応は、無水かつ反応を妨げる分子がない条件のフラスコ内で行われてきました。しかし、体内には、水、血清、タンパク質、糖鎖、脂質、あるいはグルタチオン[5]など、さまざまな分子が混在し、遷移金属触媒を失活させます。このため、体内で効率的に遷移金属触媒反応を進行させることは不可能だと考えられてきました。
しかし、遷移金属触媒反応を体内の特定の臓器や疾患細胞で行うことができれば、患者の体内の狙った臓器で速やかに薬を合成することが可能になり、副作用を軽減することができます。また、これまで体内で不安定だった薬が、狙った疾患部位で安定な化合物として合成できる可能性も生まれます。疾患を薬剤による有機反応で直接治すことになれば、従来の創薬研究の問題点を解決する次世代的治療戦略、「生体内合成化学治療」が実現されると期待されています。
そこで田中主任研究員らは、2017年から糖鎖を人工的に付加した血清アルブミンの疎水性ポケットに金(III)触媒を配位させる研究を行いました。この研究では、糖鎖付加アルブミン・金触媒をヌードマウスに静脈注射したところ、糖鎖構造によって肝臓や腸管に運び分けられ、さらに肝臓や腸管で金触媒による化学反応が実現できることを報告しました注1,2)。
今回、国際共同研究グループは、金触媒の部分をルテニウム(Ru)触媒に変えることにより、抗がん活性を持つ天然物を生成するために必要な、触媒的な閉環メタセシス反応も同様に進行するか検討しました。
注1)2017年2月15日プレスリリース「狙った臓器で金属触媒反応を実現」
注2)2018年6月28日プレスリリース「マウス内で金属触媒によるカップリング反応」
研究手法と成果
国際共同研究グループは、血清アルブミンの疎水性ポケットに対して、疎水性リガンド[6]であるN-ジエチルアミノクマリンを介することで、ルテニウム触媒を配位させました(図1A)。
配位はN-ジエチルアミノクマリンとルテニウム触媒との距離を変えた4つの分子(PEG1-Ru,PEG2-Ru,PEG3-Ru,PEG6-Ru)を用いて行い(PEGはポリエチレンリンカー)、得られた4つのアルブミン・ルテニウム触媒で、二重結合や三重結合を持つ5種類の基質1~5の閉環メタセシス反応を検討しました(図1B)。その結果、水中、37°Cで2時間反応させたところ、たった1mol%(基質に対してmol比で1%の量)のアルブミン・ルテニウム触媒を用いた場合にも、閉環メタセシス反応が効率的に進行し、それぞれの基質に対応する環状化合物6~10が得られました。特に、N-ジエチルアミノクマリンとルテニウム触媒との距離が最も短いPEG1-Ruが、最も高い触媒活性を示しました。また、基質4や5との反応では、触媒1molあたり20~30molもの基質が生成物に変換されたことが分かりました。これは天然の金属酵素にも匹敵する値であり、これまで報告されている中で人工金属酵素としては驚異的な触媒活性です。
生体内、特に細胞内には、ルテニウム触媒に配位して触媒活性を失活させるグルタチオンが過剰に存在することが知られています。したがって、生体内におけるルテニウム触媒による閉環メタセシス反応は実現が困難でした。しかし、今回のアルブミン・ルテニウム触媒を用いた場合には、グルタチオン存在下でも閉環メタセシス反応が効率的に進行することが判明しました(図2)。例えば、基質4に対する閉環メタセシス反応では、系内に20mM(基質に対して1,000当量に相当する)のグルタチオンを共存させた場合でも効率的に進行し(図2)、かつN-ジエチルアミノクマリンとルテニウム触媒との距離が最も短いPEG1-Ruが最も高い触媒活性を示すことのほか、グルタチオンだけでなく、さまざまな生体分子が共存する血清中でも効率的に反応が進行することも明らかとなりました。
そこで、さまざまな反応基質、あるいはグルタチオン誘導体の合成やそれらの速度論解析、さらに計算科学を用いて調べた結果、ルテニウム触媒はアルブミンの疎水性ポケットの中でうまく覆い隠され、守られていることが示されました(図3A)。グルタチオンなどの親水性分子は、この疎水性ポケットの中に入り込めず、ルテニウム触媒を失活させることができません。これに対して疎水性の基質は、疎水性ポケットの中でルテニウム触媒と効果的に出会うことができるため、閉環メタセシス反応が良好に進行すると考えられます。この疎水性効果は、N-ジエチルアミノクマリンとルテニウム触媒との距離が最も短いPEG1-Ruにおいて顕著で、この距離を次第に長くしていくと、ルテニウム触媒が疎水性ポケットから出てしまうために反応性が悪くなることが分かりました(図3B)。
次に、特定のがん細胞上でアルブミン・ルテニウム触媒を用いてがん活性分子を触媒合成し、治療することができるかを調べました。植物から単離された天然物のウンベリプレニンはがん細胞に対して強力な細胞毒性を示すことが知られていますが、正常細胞に対しても毒性を示します。一方、その前駆体である開環体(開環前駆体)は、がん細胞にも正常細胞にもほとんど活性を示しません。この性質を利用し、目的のがん細胞で触媒的に開環前駆体からウンベリプレニンを合成することで、がんが治療できると考えました。
これまでに国際共同研究グループは、「糖鎖パターン認識[7]」により標的の細胞を高度に見分けることに成功しています注3-6)。今回開発したアルブミン・ルテニウム触媒の表面に対して、ヒト結腸腺がんであるSW620細胞を選択的に認識するN-型糖鎖を付加し、数種類のがん細胞に作用させたところ、予想通り、SW620細胞のみにルテニウム触媒を固定させることができました。加えて、ウンベリプレニンの開環前駆体を作用させたところ、SW620細胞で閉環メタセシス反応によりウンベリプレニンを触媒的に合成することができ、著しい細胞障害を与えることに成功しました(図4)。
注3)2018年2月23日プレスリリース「理研クリック試薬の誕生」
注4)2016年2月23日プレスリリース「生体内部を高度に認識できる糖鎖複合体」
注5)2016年11月28日プレスリリース「糖鎖は不均一であることが重要」
注6)2018年7月4日プレスリリース「がんを糖鎖のパターンで認識」
今後の期待
今回、アルブミンの疎水性ポケットに遷移金属触媒を配位させることにより、遷移金属触媒を水に可溶化するとともに、生体内の環境下でも金属触媒を安定化させ、効率的な触媒反応を実現しました。今回はルテニウム触媒による閉環メタセシス反応を検討しましたが、あらゆる金属触媒反応に展開可能であると考えられます。近年、多くの有機構造、あるいは無機構造を基盤とする金属配位子や人工金属酵素触媒が報告されています。今後、実用化に向けて、人工金属酵素の体内での安全性や基質汎用性についてさらに検討を加える予定です。
金属触媒が狙った疾患のところで自在に利用できれば、これまで副作用や安定性の問題で使用できなかった薬理活性分子や創薬候補分子、あるいは診断分子を「現地合成」できる可能性が生まれます。国際共同研究グループが提唱する「生体内合成化学治療」は、新しい分子を開発するのではなく、既存の分子を有機合成化学の視点で改めて見直す“分子ルネッサンス”であり、創薬や治療を改革すると考えられます。
原論文情報
Shohei Eda, Igor Nasibullin, Kenward Vong, Norio Kudo, Minoru Yoshida, Almira Kurbangalieva and Katsunori Tanaka, “Biocompatibility and Therapeutic Potential of Glycosylated Albumin Artificial Metalloenzymes”, Nature Catalysis, 10.1038/s41929-019-0317-4
発表者
理化学研究所
主任研究員研究室 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(科技ハブ産連本部バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 副チームリーダー)
基礎科学特別研究員 ケンワード・ヴォン(Kenward Vong)
特別研究員(研究当時) 江田 昌平(えだ しょうへい)
特別研究員 イゴール・ナシブリン(Igor Nasibullin)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 遷移金属触媒反応
- 周期表で第3族から第11族までに属する遷移金属元素は、様々な分子が金属に配位することができるため多様な反応性を示す。このユニークな性質を利用して、効率的な有機合成反応が実現されている。
-
- 人工金属酵素
- 通常は金属を含まないタンパク質に触媒活性を持つ金属錯体を固定させることで、触媒活性を持たせたタンパク質・金属錯体の複合体。タンパク質の反応場を利用することで、選択性な反応を行うことができる。
-
- アルブミン
- 血清中の大部分を占め、分子量が6万程度の極めて安定な可溶性タンパク質。さまざまな薬物と配位する疎水性ポケットが存在し、血中内でこれらの薬物を運搬する。
-
- メタセシス反応
- 2種類の二重結合や三重結合の間で結合の組み換えが起こり、新しい多重結合が生成する反応。

-
- グルタチオン
- グルタミン酸、システイン、グリシンからなるトリペプチドで、細胞内に高濃度で存在する。活性酸素種や生体分子と反応することで細胞を守るなど、生命維持に重要な役割を果たしている。
-
- リガンド
- 特定の生体分子と結合することで、生理的な作用を発揮する物質のこと。一般的には受容体に結合する分泌因子(ホルモンや成長因子など)を指すことが多い。
-
- 糖鎖パターン認識
- ある一つの分子が特定の受容体を認識する場合において、糖鎖クラスターのような複数個の分子が二つ以上の受容体を「パターン」で認識する場合を指す。複数個と複数個の認識である。
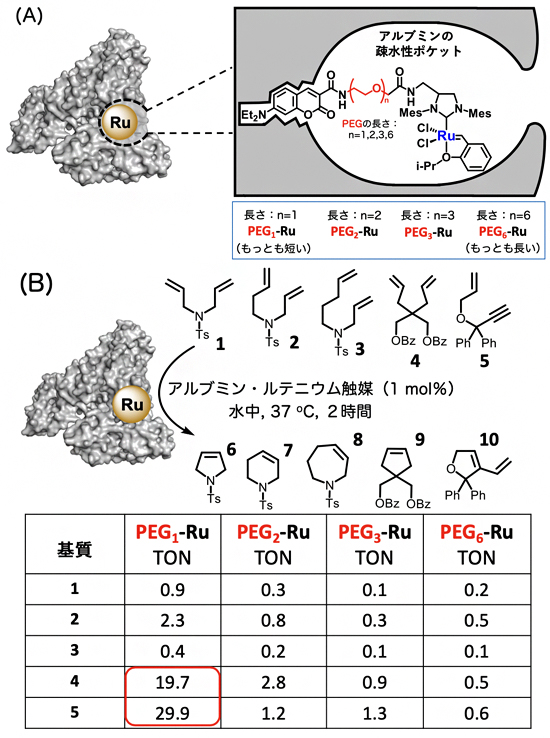
図1 血清アルブミン疎水性ポケットへのルテニウム触媒の導入と閉環メタセシス反応
(A) 血清アルブミンへのルテニウム触媒(Ru)の導入。右側に詳細を示す。血清アルブミンの疎水性ポケットに対してルテニウム触媒を導入する際、触媒と疎水性リガンドをつなぐリンカーにはさまざまな長さを持つPEG(ポリエチレンリンカー、n=1,2,3,6)を用いた。PEGの左側部分がN-ジエチルアミノクマリン、右側部分がルテニウム触媒。N-ジエチルアミノクマリンとは、アルブミンの疎水性ポケットに強く配位するリガンドの1つであり、蛍光性を示すことからアルブミンへの相互作用解析に使われる。
(B) アルブミン・ルテニウム触媒による閉環メタセシス反応の検討。TONは触媒回転数で、触媒1モルあたりどれくらいのモル数の基質が生成物に変換されたかを示す。赤い四角で示したように、リンカーの長さが最も短いPEG1-Ruを用いた際に、最も高い触媒活性が見られた。なお、官能基のTsはトシル基、Bzはベンゾイル基、Phはフェニル基を指す。
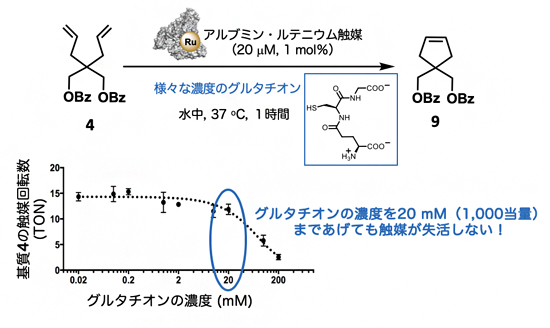
図2 グルタチオン存在下でのアルブミン・ルテニウム触媒の閉環メタセシス反応
下のグラフで示すように、グルタチオンが20mM程度存在下でも閉環メタセシス反応は良好に進行していることが分かる。
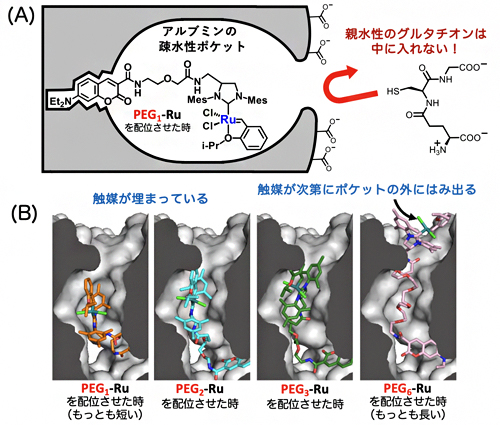
図3 グルタチオン存在下でアルブミン・ルテニウム触媒が失活しない理由
(A) ルテニウム触媒はアルブミンの疎水性ポケットの中に埋め込まれているため、疎水性の基質分子は中に入り込んで閉環メタセシス反応が進行するが、親水性のグルタチオンは中に入ることができない。
(B) N-ジエチルアミノクマリンとルテニウム触媒をつなぐリンカーをPEG1からPEG6へ長くするほど、ルテニウム触媒が疎水性ポケットの外にはみ出し、触媒が失活する。
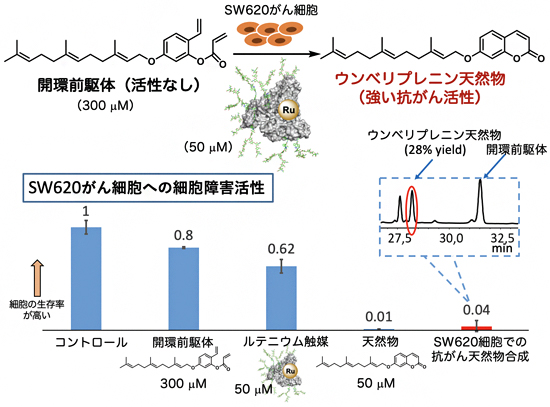
図4 アルブミン・ルテニウム触媒へのN-型結合糖鎖の導入とがん選択的な細胞障害
SW620がん細胞に対して、ジメチルスルホキシド(コントロールの溶媒)、天然物ウンベリプレニンの開環前駆体のみ、アルブミン・ルテニウム触媒のみを作用してもほとんどがん細胞への細胞障害は見られないが、開環前駆体とアルブミン・ルテニウム触媒の両者を作用させたときに、ウンベリプレニン天然物と同様な抗がん活性が認められた。さらに細胞抽出液を解析した結果、この細胞で閉環メタセシス反応が起こってウンベリプレニン天然物が28%の収率で生成し、細胞障害を発現していることがわかった。



