クライオ電子顕微鏡、放射光での生体分子の構造、電荷の精密解析へ
2018-04-27 理化学研究所
理化学研究所(理研)放射光科学研究センターの生体機構研究グループの米倉功治グループディレクターらの共同研究チーム※は、クライオ電子顕微鏡[1]および大型放射光施設「SPring-8[2]」などの放射光を用いて、タンパク質やその複合体などの生体分子を構成する原子のイオンの「散乱因子[3]」を決定しました。
今後、イオンの散乱因子を用いて、タンパク質などの生体分子の立体構造、電荷分布の精密解析ができるようになれば、生体分子の作動メカニズムをより深く解明することにつながり、生命科学の発展、新たな治療法や薬の開発、工学などへの応用が期待されます。
生体分子の構造は、X線や電子線を試料に照射し、その散乱から得られる回折パターンや分子像から調べることができます。X線や電子線の散乱のされ方を散乱因子といい、元素によって決まっています。タンパク質を構成するアミノ酸やDNA、RNAなどの核酸は、水素、炭素、窒素、酸素、リン、硫黄の原子から構成されますが、このうち酸素を除いて、イオンの散乱因子は求められていませんでした。これらのイオンは自然界で安定に存在できませんが、分子中では複数の原子にわたり電荷が分布するため、部分電荷を持つ原子の散乱因子をイオンと中性の原子の散乱因子から見積もることが必要になります。さらに、イオンと中性の原子の間で電子線に対する散乱因子に大きな違いがあり、この特徴を利用して電荷の可視化に利用できるなど有用性は高いと考えられます。今回、共同研究チームは、生体分子を構成する原子のイオンの散乱因子を「相対論的量子化学計算[4]」から決定しました。最近のクライオ電子顕微鏡の発展に伴い、原子のイオンの散乱因子の重要性は増していくと予想されます。
本研究は、国際結晶学会のオンライン科学雑誌『IUCrJ』(4月27日号)に掲載されます。
※共同研究チーム
理化学研究所 放射光科学研究センター
利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治(よねくら こうじ)
特別研究員(研究当時) 松岡 礼(まつおか れい)
特別研究員(研究当時) 山下 良樹(やました よしき)
XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
研究員 眞木 さおり(まき さおり)
横浜市立大学大学院生命医科学研究科
教授 木寺 詔紀(きでら あきのり)
教授 池口 満徳(いけぐち みつのり)
特任助教 山根 努(やまね つとむ)
※研究支援
本研究は、科学技術振興機構(JST)先端計測分析技術・機器開発プログラム「電子顕微鏡の高精度制御及び生体高分子結晶構造解析ソフトウェアの開発(研究代表者:米倉功治)」、日本学術振興会(JSPS)科学研究費補助金挑戦的萌芽研究「電子線結晶構造解析によるクーロンポテンシャルの可視化(研究代表者:米倉功治)」、同基盤研究B「イオン駆動力供給体の電子線とX線による作動機構の解明(研究代表者:米倉功治)」などの支援を受けて行われました。
背景
タンパク質の立体構造を決める手法として最も一般的なX線結晶構造解析[5]では、研究対象のタンパク質の結晶を作製することが必要です。得られた結晶にX線を照射すると、結晶内のタンパク質分子を構成する原子の周りの電子によってX線が散乱され、回折パターンが得られます。この回折パターンの強度情報から計算した「電子密度[6]マップ」に基づいて、立体構造を決定します。この手法では、数マイクロメートル~百マイクロメートル(μm、1μmは100万分の1メートル)サイズの良質な結晶が必要です。しかし、重要な生命機能を担う膜タンパク質[7]や巨大なタンパク質複合体の結晶作製は非常に難しく解析を困難にしています。
一方、クライオ電子顕微鏡を用いると、結晶を必要とせず構造解析を行うことができます。電子顕微鏡の電子線の波長はピコメートル(pm、1pmは1兆分の1メートル)程度と短く、光学顕微鏡に比べて格段に高い倍率で分子の拡大像が得られます。電子顕微鏡を用いて生体試料を観察するためには、その自然な状態を保つため、試料溶液を急速凍結して液体窒素冷却の温度(-190から-170℃)に保つことが必要です。2次元の電子顕微鏡像からその立体構造を決定するためには、さまざまな方向から観察した多数の分子像を集め、人体の内部構造可視化の技術として医療分野で広く用いられているCT法[8]と同じ原理に基づいて、構造再構成の計算を行います(単粒子解析法[9])。しかし、この単粒子解析で得られる分子像の信号対雑音比(S/N比)は非常に悪いため、膨大な数の像を集めても空間分解能[10]が悪く、乏しい情報しか得られないといった問題がありました。
最近、電子線の検出カメラと統計に基づく画像解析の技術革新により、理想的な試料ではX線結晶構造解析に匹敵する空間分解能で大きなタンパク質の構造解析が可能になり、注目を集めています。また、米倉グループディレクターらは、独自に開発した3次元微小結晶の電子線結晶構造解析注1)で、電荷の可視化に成功しています。
X線は、波長のごく短い光で電気的に中性であるのに対して、電子線は負の電荷を持っています。同じ原子でも電荷を持ったものと中性のものでは、散乱のされ方が大きく異なります。このため、電子線ではX線からは得ることができない試料の荷電状態を反映する「静電ポテンシャルマップ[11]」が得られます。特に、アミノ酸の荷電状態は、タンパク質などが機能を発揮する上で大きな影響を与えます。そのため、電子線解析から得られる情報は非常に有益であると考えられますが、これまでその可能性はほとんど検討されてきませんでした。
注2) 2016年8月25日プレスリリース「生体分子の電荷分布の高精度解析法」
研究手法と成果
共同研究チームは、炭素(C)、窒素(N)、酸素(O)、リン(P)、硫黄(S)の正負イオンの周囲の電子密度を「相対論的量子化学計算」で求めました。これらに水素(H)を加えると、生命を形作る基本的な分子であるアミノ酸とDNAやRNAなどの核酸に含まれる全ての元素になります。また、以上の原子のイオンは自然界で安定に存在することはできませんが、分子中では複数の原子にわたって電荷が分布します(図1)。この部分電荷を持つ原子の「散乱因子」は、中性のものとイオンのものを足し合わせることで近似することができます。
X線は原子の周りの電子に散乱されるため、電子密度を周波数空間へ変換することで、X線に対する散乱因子を取得しました。次に、静電ポテンシャルと電子密度の関係を表す式に基づいて、X線の散乱因子から電子に対する散乱因子を求めました。このとき、水素の正イオン(H+)の電子散乱因子も計算しました(図2)。また、中性の原子と酸素の負イオン(O-)に対する散乱因子も同様に計算し、これまで構造研究に利用されてきた参照データと比較したところ、今回の計算の手法が正しいことが分かりました。さらに、いろいろな構造解析のプログラムで用いる際の利便性を上げるため、得られた散乱因子を「非線形の最適化アルゴリズム[12]」で解析的に表現できる形式に整えました。また、今回の計算のため開発したプログラム(scsumrhofft.py, scatcurev package)は、論文と同時に公開し利用可能としました。
今後の期待
タンパク質は、20種類のアミノ酸が順番につながった鎖状の分子で、鎖が折り畳まれて複雑な3次元構造を形作ります。アミノ酸の中には、pH(酸性・アルカリ性の程度)が中性で、負の電荷を持つもの、正の電荷を持つもの、極性[13]を示すもの、疎水性を示すものに分類されます。現在、2016年に米倉グループディレクターらが開発した手法注2)を発展させ、これらのアミノ酸の個々の原子に部分電荷を与えて、得られた散乱因子の有用性をクライオ電子顕微鏡のデータに対して検証する作業を進めています。
参照データとなっている中性原子、金属イオンなどの散乱因子は、構造研究で必須の基礎データとして活用されていますので、この研究で求めたイオンの散乱因子は、多くの研究で利用されると考えられます。
今回得られたイオンの散乱因子を用いて、タンパク質などの構造、荷電状態の精密な解析が可能になれば、生体分子の作動機構のより詳細な解明につながるため、その有用性は非常に大きく、最近のクライオ電子顕微鏡の発展に伴い、その重要性は増していくと予想されます。今後、本成果を利用して新しい基盤技術として確立することができれば、生命科学の発展や医療、創薬、工学などの分野への貢献が見込まれ、次世代の構造生命科学への寄与が期待できます。
注2) 2016年8月25日プレスリリース「生体分子の電荷分布の高精度解析法」
原論文情報
Koji Yonekura, Rei Matsuoka, Yoshiki Yamashita, Tsutomu Yamane, Mitsunori Ikeguchi, Akinori Kidera, and Saori Maki-Yonekura, “Ionic Scattering Factors of Atoms Composing Biological Molecules”, IUCrJ, 10.1107/S2052252518005237
発表者
理化学研究所
放射光科学研究センター 利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治 (よねくら こうじ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- クライオ電子顕微鏡
- タンパク質などの生体分子を、水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料は氷中に保持でき、また、冷却することで電子線の照射による損傷を減らせる。Jacques Dubochetは氷包埋の手順を作り、2017年度のノーベル化学賞の受賞者の一人に選ばれた。
-
- SPring-8
- 理研が所有する、兵庫県の播磨科学公園都市にある世界最大かつ最高性能の放射光施設。SPring-8の名前はSuper Photon ring-8 GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細く強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。タンパク質の結晶構造解析の分野でも、大きな成果を上げている。
-
- 散乱因子
- X線や電子線が原子に散乱される際の散乱曲線。散乱角(空間分解能)に対する強度として表され、原子種、イオンによって異なる。X線の散乱因子は、中性の原子と電荷を持つものでほとんど違いは無いが、電子線では両者は大きく異なる。
-
- 相対論的量子化学計算
- 原子などの微小な現象を記述する量子論に、高速に移動する物体の運動を記述する特殊相対性理論の補正項を加えて計算する手法。
-
- X線結晶構造解析
- 生体分子の立体構造を決める手法として最も一般的な手法。精製したタンパク質試料に塩、添加化合物の種類、濃度、pH、温度などの条件を探索して、分子が規則正しく並んだ結晶を作製する。得られた結晶にSPring-8などの放射光施設の強力なX線を照射し、散乱されて得られた回折パターンの強度情報から、立体構造を計算し、原子モデルを構築する。この手法では、数マイクロメートル~百マイクロメートル(μm、1μmは100万分の1メートル)サイズの良質な結晶が必要とするが、結晶化が非常に難しい試料も多い。
-
- 電子密度
- 原子核の周りの電子の分布を表し、単位は単位体積あたりの電子の数になる。
-
- 膜タンパク質
- 細胞膜を構成しているタンパク質で、全ゲノムがコードするタンパク質の3分の1を占める。細胞膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。細胞外のシグナルを捕える受容体、細胞膜を介して物質の出入を担うチャネルやポンプ、細胞同士の結合に関わる接着分子など、生命活動に重量な役割を果たす。疾病に関連しているものも多く創薬の重要なターゲットとされるが、結晶化が難しく構造解析が最も進んでいない。
-
- CT法
- 可視光、X線、電子線などが、対象を透過して出来る2次元の投影像をいろいろな方向から集め、その組から3次元構造を再構成する手法。対象の内部の構造が可視化できる。人体の断層写真の撮影など医療分野での利用も多い。CTはComputed Tomographyの略。
-
- 単粒子解析法
- 電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法。結晶を作製しなくても分子の構造が得られるが、特殊な形態の試料を除いて、到達できる空間分解能(細かい構造を可視化できる指標)が高くできないことが問題であった。しかし、この状況はここ数年で大きく進展し、理想的な試料ではX線結晶構造解析に匹敵する分解能の構造が決定され、原子モデルの構築ができるようになってきた。この進展は、主として電子線直接検出型の量子検出効率のよい高速カメラの開発と、統計に基づく画像解析アルゴリズムの導入によりもたらされた。2017年度のノーベル化学賞の受賞者の一人、Joachim Frankにより単粒子解析法の基礎が作られた。
-
- 空間分解能
- 分解能とは、どのくらい細かくものを“見る”ことできるかの目安。分解能が小さな値では細かく(分解能が高く)、大きな値では粗く(分解能が低く)なる。空間分解能が高いほど、物体をより精細に観測できる。原子の大きさは、1オングストローム(Å、1Åは100億分の1メートル)程度で、原子モデルの構築には、3.5Å程度の空間分解能が必要になる。
-
- 静電ポテンシャルマップ
- 分子の電位の分布。電子線散乱から得られる。X線回折からは、電子密度マップが得られる。
-
- 非線形の最適化アルゴリズム
- 加減算や定数のかけ算で表せる一次式(線形)の関係にないデータから、最適な解を推定するアルゴリズム。極所的な解に陥ることもあり、解法が難しいとされる。本研究では、電子線の原子散乱因子を表すパラメーターを求めるために、効率的で堅牢なレーベンバーグ・マーカート(Levenberg-Marquardt)法を用いた。
-
- 極性
- 負の電荷を持つ電子の局在から生じる電気的特性。生体分子では、主に水素と酸素がそれぞれ正と負の極性を示し、両者が緩く結合する水素結合は生体分子の機能、安定性に重要な役割を果たす。

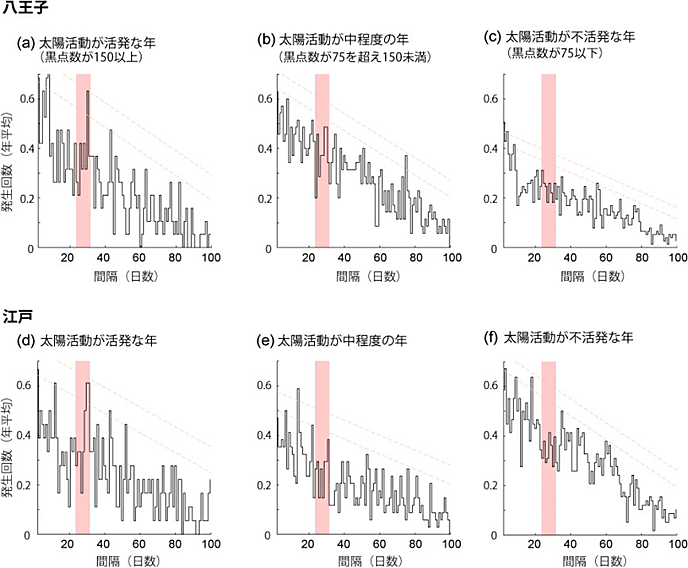
図1 アミノ酸や核酸における部分電荷の分布
それぞれの数値は理論計算から求められた電荷を示す(赤色が正、青色が負)。アスパラギン酸とシステインはアミノ酸の一種。核酸は遺伝情報を担うDNAやRNAのヌクレオチドで、Rは塩基(A、T/U、G、C)を示す。DNAやRNAはリン酸と糖、塩基が結合したヌクレオチドがその構成単位となる。

図2 本研究で決定したイオンの電子線に対する散乱因子
比較のため中性原子の散乱因子も表示。中性原子(H, C, N, O, P, S)に比べ、負イオン(C-, N-, O-, P-, S-)や正イオン(H+, N+, O+, P+, P2+, S+, S2, S3+)でカーブの概形が大きく異なることが分かる。Å(オングストローム)は100億分の1メートル。