2022-10-11 分子科学研究所
発表のポイント
◆ 回転イオンポンプVoV1のイオン輸送律速の回転運動の高精度1分子解析に成功した
◆ VoV1の2つの回転モーターは類縁のFoF1より硬く繋がり連動することを明らかにした
◆ VoとV1が硬く連動することでイオンの逆流を防いで能動輸送を行うことが示唆された
概要
分子科学研究所の大友章裕助教、飯田龍也大学院生(当時)、大国泰子技術支援員、飯野亮太教授、東京大学の上野博史講師、千葉大学の村田武士教授らの研究チームは、回転イオンポンプであるVoV1-ATP分解酵素(VoV1)の高精度1分子解析を行い、VoとV1の2つの回転分子モーターが比較的硬く繋がって連動して働くことを明らかにしました。この結果は、VoとV1が硬く連動することでイオンの逆流を防ぎつつ能動輸送(*1)を行うことを示唆します。また、VoV1の硬い連動は、イオンの受動輸送(*2)でATP合成を行うFoF1-ATP合成酵素(FoF1)の柔らかく弾性的な連動とは異なっており、この違いはそれぞれの複合体の構造の違いに由来することが示唆されました。本成果は、米国科学アカデミーが発行する国際学術誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」に、2022年10月10日付でオンライン掲載されました。
研究の背景
VoV1-ATP分解酵素(VoV1)は ATP(アデノシン三リン酸)(*3)の化学エネルギーを駆動力として回転運動を行い、細胞膜を介する濃度勾配に逆らってイオンを能動輸送する回転イオンポンプとして働きます。VoV1は真核生物の膜小胞や細菌の原形質膜に存在しており、膜小胞内部の酸性化による細胞内外成分の分解の促進、細菌内部のイオン濃度の調整による細胞毒性の軽減、といった幅広い役割を担っています。
VoV1は、膜に埋まったVoと膜から突き出したV1の2つの分子モーターの複合体です(図1)。V1モーターはATPを分解しながら1方向に回転し、この回転運動に連動してVoモーターが回転することでイオンの能動輸送を行います。
飯野教授らの研究チームは以前、単離したV1モーターの回転運動の素過程および律速過程を可視化することで、V1モーターがATP加水分解反応の化学エネルギーを回転運動の力学的エネルギーに変換する機構を解明しました(2019年10月25日付プレスリリース: https://www.ims.ac.jp/news/2019/10/25_4457.html)。しかしながら、Voモーターの回転運動の素過程や律速過程は可視化されておらず、V1モーターで生み出された回転運動のエネルギーがどのようにVoモーターに伝わってイオンの能動輸送が行われるのかは明らかになっていませんでした。
研究の成果
Voモーターのイオン輸送を伴う回転運動の素過程および律速過程を明らかにするには、広い範囲のイオン濃度で回転運動を観察することが重要です。本研究で対象とした腸球菌由来のVoV1はナトリウムイオン(Na+)を選択的に輸送するので、回転速度のNa+濃度依存性をまず調べました。VoV1複合体のVo部分をガラス基板に固定し、V1部分に回転運動を可視化する目印として金ナノ粒子を取り付け、独自に開発した全反射暗視野レーザー顕微鏡を用いて1分子観察しました。その結果、Na+濃度が低下すると回転が遅くなり、VoモーターへのNa+の結合がVoV1の回転運動の律速過程となることが明らかとなりました。
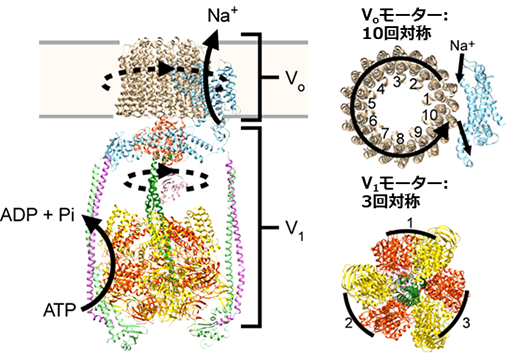
図1. 腸球菌由来VoV1の構造
次に、回転運動をさらに詳細に解析するためもう一工夫を加えました。具体的には、VoモーターにあるNa+取り込み口にアミノ酸変異を導入してNa+輸送を遅くすることを試みました。その結果、作製したaE634A変異体は、野生型と同様に回転速度がNa+濃度依存性を示しただけでなく、狙い通り野生型よりも10倍程度小さな回転速度を示しました。
上記の結果を踏まえ、回転が遅い低Na+濃度でのaE634A変異体の回転運動を詳細に解析しました(図2)。図2Aに示すように、aE634A変異体は1回転あたり10箇所の停止と前方へのステップ(前進)を繰り返す回転運動を示しました。これはVoモーターの回転子リングが10箇所のイオン結合部位を持つことに対応すると考えられました(図1)。さらに、停止時間のNa+濃度依存性を解析することで、停止はNa+の結合を待つ時間に対応することが明らかとなりました。
さらに、Na+とATPの両方の濃度を下げた条件での回転運動の詳細な解析を行いました。この条件では、Na+とATP両方の結合が回転運動の律速過程になると考えられます。その結果、図2Bに示すようにVoモーターの10箇所のNa+結合部位とV1モーターの3箇所のATP結合部位を反映した1回転あたり13箇所の停止が観察されました。また前進ステップだけでなく時折、後方にも小さくステップ(後退)することが分かりました。これらの結果は、VoモーターがNa+の結合を待つ角度とV1モーターがATPの結合を待つ角度が異なること、および両者が硬く連動していることを示しています。さらに、小さな後退ステップはVoモーターとV1モーターの隣接する停止角度間での遷移を示していると考えられ、Voモーターはブラウニアンラチェット機構(*4)で動くことが示唆されました。
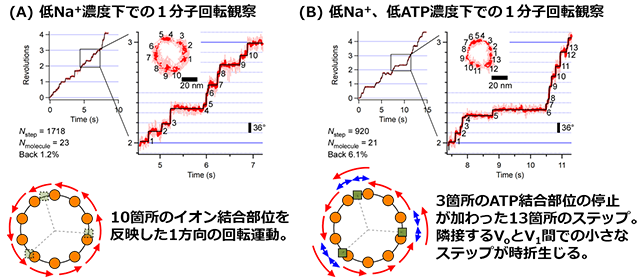
図2. aE634A変異体の異なる条件下での1分子回転観察の例
今回明らかとなったVoV1の硬い連動は、イオンの逆流を防ぎつつ能動輸送を行う上で重要と考えられます。また、VoV1の硬い連動は、柔らかく弾性的に連動することが報告されているFoF1とは大きく異なります。FoF1では1本の周辺固定子によって2つのモーターが繋がれているのに対し、VoV1は2本または3本の複数の周辺固定子を持ち、さらに複数の周辺固定子がFoF1にはない腕型のサブユニットによって支えられています(図1)。2つのモーターの連動の硬軟と生理的機能との関係の解明は今後の課題ですが、この構造の違いによりVoV1は硬く連動していると考えられました。
今後の展開・この研究の社会的意義
VoV1やFoF1は、ATPの化学エネルギーとイオンの電気化学ポテンシャル(*5)を相互変換するナノサイズのエネルギー変換装置であり、その仕組みは一見、揚水発電(*6)によく似ています。サイズが大きく異なるにもかかわらず、天然と人工のエネルギー変換装置がよく似た方式を採用しているのは驚くべきことです。今後は、VoV1のエネルギー変換の効率や可逆性を定量的に解析することで、微小な天然エネルギー変換装置と巨大な人工エネルギー変換装置の相違点や共通点を解明したいと考えています。さらに、天然の分子を解析するだけでなく積極的に改変することで、輸送イオンの選択性の機構やイオン/ATP比の変化による効率や可逆性への影響等を解明したいと考えています。
用語解説
*1)能動輸送:
細胞膜を介したイオンの濃度勾配(濃度差)に逆らう輸送。能動輸送により濃度差は増える。
*2)受動輸送:
細胞膜を介したイオンの濃度勾配(濃度差)に従う輸送。受動輸送により濃度差は減る。
*3)ATP(アデノシン三リン酸):
ADP(アデノシン二リン酸)とリン酸への加水分解により、生命活動に必要な化学エネルギーを生み出す。生体内エネルギー通貨とも呼ばれる。
*4)ブラウニアンラチェット機構:
熱ゆらぎによるブラウン運動を制御(整流)することで一方向性の運動を達成する仕組み。
*5)電気化学ポテンシャル:
細胞膜を介したイオンの濃度差によって形成されるポテンシャルエネルギー。イオンの能動輸送によって形成される。
*6)揚水発電:
発電所の上部と下部に水を貯える調整池を作り、上部調整池から下部調整池に水を流して発電する仕組み。電力の使用量が少ない時間に水車を逆回転させ上部調整池に水をくみ上げ、必要な時に水を流下させ発電を行う。
論文情報
掲載誌:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
論文タイトル:“Direct observation of stepping rotation of V-ATPase reveals rigid component in coupling between Vo and V1 motor”(V-ATPaseの回転ステップの直接観察によりVoとV1モーター間の硬い共役成分を明らかにした)
著者:Akihiro Otomo, Tatsuya Iida, Yasuko Okuni, Hiroshi Ueno, Takeshi Murata, Ryota Iino
掲載日:2022年10月10日(オンライン公開)
DOI:10.1073/pnas.2210204119
研究グループ
分子科学研究所
東京大学
千葉大学
研究サポート
科研費・新学術「発動分子科学」JP18H05424, JP1805425, JP19H05380
科研費・基盤B 21H02454
科研費・若手研究 21K15060
科研費・特別研究費 20J01316
自然科学研究機構・若手研究者による分野間連携プロジェクト 01312001
研究に関するお問い合わせ先
大友章裕(おおとも あきひろ)
分子科学研究所 助教
飯野亮太(いいの りょうた)
分子科学研究所 教授
報道担当
自然科学研究機構 分子科学研究所
研究力強化戦略室 広報担当