2020-02-27 横浜市立大学,日本医療研究開発機構
横浜市立大学学術院医学群 微生物学 梁明秀教授、松永智子助教らの研究グループは、本学医学群 免疫学教室、国立感染症研究所、国立国際医療研究センター研究所などとの共同研究で、合成Notch受容体の細胞内・外のドメインのカスタマイズにより、B型肝炎ウイルス(HBV)の表面抗原を検知して特異的に免疫応答を活性化できる、人工免疫細胞の樹立に成功しました。
研究成果のポイント
- 合成Notch受容体(*1)の細胞内と細胞外の部分をカスタマイズし、B型肝炎ウイルス(HBV)の表面抗原を検知して細胞内での転写を促す人工免疫細胞を開発した。
- 活性化した人工免疫細胞は中和抗体(*2)とインターフェロン(*3)を分泌することでHBVの伝播を抑制することを細胞レベルで確認できた。
研究の背景
慢性B型肝炎について
世界保健機関(WHO)の報告によると、世界中で約20億人がB型肝炎ウイルス(HBV)に感染していると推計されており、そのうち2億4千万人以上が肝硬変や肝細胞がんに進行するリスクがある慢性B型肝炎に罹患しています。これらの疾患予防にはHBVワクチンの有効性が高いものの、ウイルスの伝染しやすさや、一旦感染すると体内からの排除が困難であることなどから、有病率は高いままになっています。
慢性B型肝炎の現在の治療法は肝硬変、肝細胞がんへの進行を防ぐことを目的にしており、HBV排除の有効性は限られています。また、治療が長期におよぶと副作用のリスクが高くなるとともに、薬剤耐性ウイルスが出現し、治療の失敗と病気の進行につながる可能性があります。更に、慢性B型肝炎の患者さんでは、抗ウイルス薬により一時的に肝炎を沈静化できても、治療中止後に肝炎が再燃し、劇症化するケースも見られます。したがって、これらの課題を克服しうる慢性B型肝炎治療のための新たな抗ウイルス療法が必要とされています。
細胞療法と合成Notch受容体について
一般的に、抗ウイルス薬として用いられている低分子化合物や生物製剤は、常に高い活性状態にあるため、生体内で速やかに生物学的効果を発揮し、全身性の影響が出たり、副作用が起きたりしやすいことが知られています。これに対し、近年研究が進んでいる「細胞療法」は、投与された細胞が周囲の環境を感知し、特定の分子シグナルがある場合にのみ応答できるため、疾患局所での集中的な作用が期待できます。
最近、がんの免疫療法のために開発された合成Notch(synNotch)受容体は、細胞外領域に特定の分子に結合する一本鎖抗体(single chain Fv:scFv)(*4)を、細胞内領域には核内に移行して遺伝子の発現を誘導できる転写因子を、それぞれNotch受容体本来の細胞膜貫通領域に結合させたキメラ分子です(図1)。これにより、細胞外からの特定のインプットに対して意図したアウトプットを発現させる機能をもつ細胞をデザインし、細胞療法に利用できると考えられます。
研究の内容
私たちは、ウイルス感染を抑制する因子群を細胞に発現・分泌させれば、感染局所からのウイルス伝播を阻止できるのではないかと考えました。そこで本研究課題では、HBV粒子表面の抗原(HBs)に対するモノクローナル抗体由来の可変領域遺伝子をsynNotch受容体の細胞外領域に配置することで、HBV粒子上のHBs抗原を特異的にセンシングしてHBV粒子およびHBV感染細胞を検出できる細胞の創生を目指しました。また、細胞内領域にはウイルス阻害因子群(中和抗体、インターフェロン)を発現させられるようデザインしました(図1)。
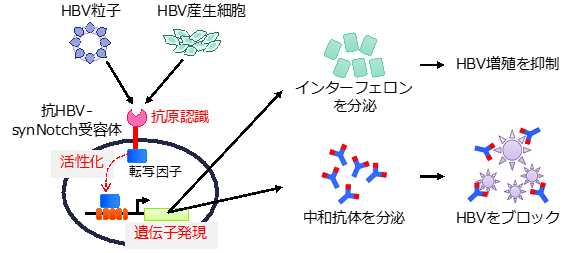
(図1)合成Notch(synNotch)受容体を用いたB型肝炎ウイルス(HBV)に対する人工免疫細胞(黒丸)とその機能を示す概略図
細胞外においてHBV粒子の表面抗原(HBs抗原)を認識し活性化されると、細胞内で転写因子が働き、インターフェロンや中和抗体を分泌する。その結果、HBVの感染(伝播)が抑制される。
この抗HBs-synNotch受容体を導入した細胞は、HBV感染部位の近傍のみで活性化してウイルス感染を検知し(緑色蛍光タンパク質(GFP)を目印としている:図2)、中和抗体とインターフェロンを分泌することを今回、細胞レベルで確認できました。抗原に対する抗体産生とインターフェロンの放出とは「液性免疫」(*5)と「自然免疫」(*6)そのものであり、いわば「人工免疫細胞」ができたことになります。また、Notch受容体は結合した近傍細胞の膜タンパク質が細胞内に牽引されることをきっかけに切断、活性化されますが、このような制御を受けないウイルス表面タンパク質でもNotch受容体が活性化されることも今回初めて明らかになりました。
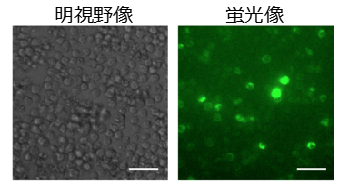
(図2)HBVを認識して光る人工免疫細胞
今後の展開
最近保険適用になった免疫細胞療法には、がんのCAR-T療法があります。これは患者さんのT細胞を遺伝子改変することで「細胞性免疫」というタイプの免疫を強化した治療法です。これに対し、本研究において作成した人工免疫細胞は、「液性免疫」と「自然免疫」を強化します。今回の研究により、synNotch技術を用いた人工免疫細胞が難治性の感染症に対する新たな治療法の開発に向けた重要なツールになる可能性を示唆することができました。ただし、この先の実用化に向けては、生体内での安全性と有効性、既存の方法に対する優位性の検証が必要となります。
また、今回の研究においてsynNotch受容体がHBV粒子上のリガンドに対しても機能することが明らかになったことから、インフルエンザウイルスやエボラウイルスなど、脂質二重膜を有するエンベロープウイルスにも応用できることが見込まれます。今回の成果を基軸に、ウイルスの表面抗原を標的にした新しいタイプの治療法開発へ展開させたいと考えています。
用語説明
- (*1) 合成Notch受容体:
- Notch受容体は、細胞の分化や維持に関わる1回膜貫通型の膜タンパク質。Notchは同じ1回膜貫通型の膜タンパク質Deltaと結合すると、TACEと呼ばれるタンパク質分解酵素によって細胞外部分で切断された後、γセクレターゼという酵素により細胞内部分で切断される。切断された細胞内ドメインは、自身の持つ核内移行シグナルにより核内へと移動して転写因子として働く。
合成Notch受容体は、Notch の細胞外領域を任意のリガンドを認識する配列(一本鎖抗体など)に置き換え、細胞内領域を特定の転写因子に置き換えたキメラ受容体。このように合成された受容体は、任意のリガンドを認識して任意の遺伝子の発現を誘導することができる。2016年にカリフォルニア大学サンフランシスコ校のDr. Roybalらにより考案された (Cell 164(4):780-91, 2016; Cell 167(2):419-432, 2016)。 - (*2) 中和抗体:
- ウイルス感染の阻止能(中和能)を有する抗体。一般に、ウイルスタンパク質の受容体結合部位を認識する抗体は、ウイルスの受容体結合を阻止することでウイルスの侵入を阻止できることから、中和抗体と呼ばれる。
- (*3) インターフェロン:
- 哺乳動物におけるサイトカインファミリーの一種で、ウイルス感染を抑制できる因子であり、I型からIII型に分類される。自然免疫系におけるウイルス認識により、細胞内のシグナル伝達経路を介して誘導される。
- (*4) 一本鎖抗体:
- 抗体の抗原結合部位を構成する2つの可変領域断片(重鎖可変領域および軽鎖可変領域)を柔軟なリンカーアミノ酸配列で連結して作製される人工小型抗体。特定の分子を認識できるので、他の機能性タンパク質と融合させることで、分子標的療法のツールとして用いることができる。
- (*5) 液性免疫:
- 主に、B細胞や形質細胞から分泌される抗体を中心とした免疫系。感染症では、病原体に対して特異的に反応する抗体が産生される。これらの抗体は病原体に結合し、感染力を失わせたり、食細胞の貪食を助ける効力を発揮する。
- (*6) 自然免疫:
- 生体内に病原体が侵入した直後から働く免疫系。病原体に対する最初の防御機構であり、マクロファージ、樹状細胞、NK細胞などが中心的役割を担う。サイトカインなどの炎症性物質の産生を促し、ウイルス感染ではインターフェロンが大きな役割を果たす。
※本研究はCell Pressが発行する学際的なオープン・アクセス・ジャーナルの『iScience』に掲載されます。(米国時間2月26日午前11時付:日本時間2月27日午前1時付オンライン)
掲載論文
Engineering cellular biosensors with customizable antiviral responses targeting hepatitis B virus
Satoko Matsunaga, Sundararaj S. Jeremiah, Kei Miyakawa, Daisuke Kurotaki, Sayaka Shizukuishi, Koichi Watashi, Hironori Nishitsuji, Hirokazu Kimura, Tomohiko Tamura, Naoki Yamamoto, Kunitada Shimotohno, Takaji Wakita and Akihide Ryo, iScience, in press.
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)肝炎等克服実用化研究事業「B型肝炎ウイルスの感染複製増殖機構解明による創薬基盤形成に関する研究」、科学技術振興機構(JST)「世界に誇る地域発研究開発・実証拠点(リサーチコンプレックス)推進プログラム「世界に誇る社会システムと技術の革新で新産業を創るWellbeing Research Campus」(提案機関:地方独立行政法人神奈川県立
産業技術総合研究所)」の支援を受けて行われました。
お問い合わせ先
本資料の内容に関するお問い合わせ
公立大学法人横浜市立大学
学術院医学群 微生物学 教授 梁 明秀
取材対応窓口、詳細の資料請求など
公立大学法人横浜市立大学
研究企画・産学連携推進課長 渡邊 誠
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 感染症研究課