2024-02-29 理化学研究所,科学技術振興機構
理化学研究所(理研)環境資源科学研究センター 生体機能触媒研究チームの千葉 洋子 上級研究員、大岡 英史 研究員、中村 龍平 チームリーダーらの研究グループは、酵素活性[1]を支配する要因として、近年注目されている酵素と基質[2]の親和性[3]の重要性を裏付けるとともに、アレニウスプレ因子[4]など、基質親和性と並ぶ重要な因子があることを新たに発見しました。本研究成果は、高性能酵素の開発に貢献すると期待できます。
酵素は生物が有する触媒で、特定の化学反応を加速する機能を持っています。酵素によって加速される反応速度の大きさを酵素活性と呼びます。酵素活性を決める因子を特定することは、生物進化の理解など、基礎科学的にはもちろん、高活性な酵素設計にもつながるため工学的にも重要です。
今回、研究グループは、多様なホスホセリンホスファターゼ[5]の活性を実験的に測定し、触媒化学の理論[6]を用いて解析することで、酵素活性の支配因子を評価しました。その結果、近年、活性支配因子として確立されつつある基質親和性が重要であることを改めて示し、それと同程度の影響力を持つ別の因子があることも明らかにしました。本研究の成果により、これらの因子を最適化することで酵素活性の向上が可能であると考えられます。
本研究は、科学雑誌『Angewandte Chemie International Edition』オンライン版(2月26日付)に掲載されました。
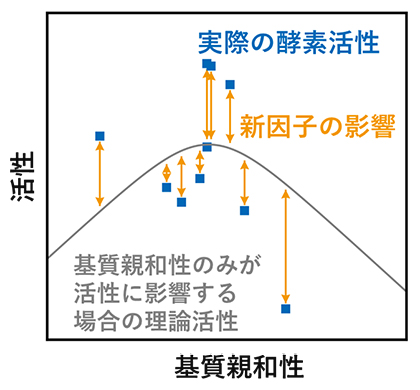
基質親和性とそれ以外の新因子によって決まる酵素活性
背景
酵素はアミノ酸やDNAの合成、呼吸、光合成など、生命に不可欠な化学反応を担う存在です。工学的には、温和な条件下で機能する環境に優しい触媒として注目されており、医薬品の精密合成やバイオ燃料生産などに役立てられています。このため、酵素反応の速度を表す酵素活性が何によって決まるかを明らかにすることは、自然界における酵素進化の理解だけでなく、バイオテクノロジーによるクリーンなモノづくりにも重要です。
これまで100年以上もの間、酵素活性を高めるためには酵素と基質の親和性をできる限り高めることが重要であると考えられてきました。これに対し近年、基質親和性を限界まで高めるのではなく、高過ぎず低過ぎもしない、「ちょうどよい値にする」方が高い活性が得られる、という新たな考え方が実験注1)と理論注2)の両方から報告され始めました。しかし、これまでは類似の反応環境(温度やpH)で機能している酵素間のみで比較解析がなされていたため、異なる環境で進化してきた多様な酵素においてもこの考え方が適応できるのか、不明でした。
注1)欧州のグループの論文
注2)2023年8月24日プレスリリース「酵素活性を最大化する理論的な条件の発見」
研究手法と成果
本研究では、ヒトや大腸菌など、進化系統[7]的に多様な10種類の生物からアミノ酸合成酵素の一種であるホスホセリンホスファターゼを取得し、その活性を比較解析しました。10種類の生物の中には、ヒトのように室温に適応したものもいれば、85℃の高温環境に適応した微生物もいます。このため、10種類のホスホセリンホスファターゼも、全く異なる環境で反応することに適応して進化したと考えられます。このように、評価対象の酵素に多様性を確保することで、酵素活性の支配因子を明らかにしようと試みました。
まず各酵素について、基質親和性と酵素活性を実験的に求め、これらと基質濃度の関係を解析しました(図1)。その結果、どの濃度でも、中間的な基質親和性(およそ0.5ミリモーラー(mM、1mM=1mol/m3))のときに活性が最大となることが分かりました。これは、多様な酵素においても、基質親和性を最適化することが活性向上に重要であることを示しています。
一方、これまでの報告とは異なり、特に低い基質濃度では、複数の基質親和性において反応速度が最大化されました。これは「基質親和性の最適化で酵素の活性向上が可能である」という近年の考え方およびその基となった触媒化学の理論から逸脱する結果であり、基質親和性以外にも、酵素活性に影響する因子があることを示しています。
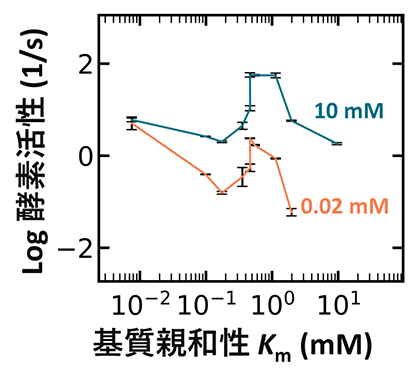
図1 基質親和性(Km)と酵素活性の関係
高基質濃度(10mM、青緑色の線)では基質親和性が0.5mM程度のときに酵素活性が最大となった。一方、低基質濃度(0.02mM、オレンジ色の線)では基質親和性0.5mM付近に加えて10-2mM付近においても活性が高かった。複数の基質親和性で活性が高くなることはこれまでの理論予測からは逸脱しており、未知の因子が酵素活性に影響している可能性を示唆している。
この未知の因子を特定するため、基質親和性が主な活性支配因子であると報告されている別の酵素、セルラーゼ[8]と比較しました(図2)。セルラーゼの場合、基質と酵素の親和性を表すKmと、基質濃度無限大における酵素の理論的な最大活性を表すkcat[9]が相関関係を示します。これは、「親和性を高めると、最大活性が小さくなる」ことを表しており、近年の考え方の通り、基質親和性を主要な因子として酵素活性を記述することができます。一方、ホスホセリンホスファターゼの場合、Kmとkcatの間に明確な相関関係は見られませんでした。図2の直線(Kmとkcatの相関関係)からのズレは、基質親和性と並ぶ新たな酵素活性支配因子によるものと捉えることができます。
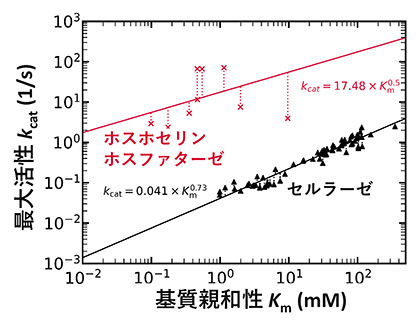
図2 各酵素における基質親和性(Km)と最大活性(kcat)の関係
セルラーゼ(黒)の場合、基質親和性と最大活性は相関し、両者はトレードオフの関係にある。すなわち、Kmの値が小さく基質親和性が高い酵素では、kcatの値が小さく最大活性も小さくなる。一方で、ホスホセリンホスファターゼ(赤)の場合、Kmとkcatの相関関係を示す直線(赤実線)から外れており、基質親和性と最大活性に明確な関係性は見られない。
この直線関係からのズレにはいくつかの物理的な起源が考えられますが、その一つとして、生成物が酵素から離れる速度を決める因子の一つであるアレニウスプレ因子が挙げられます。実際、ホスホセリンホスファターゼのアレニウスプレ因子の値を測定したところ、直線関係からのズレを説明し得るほど大きな多様性があることが分かりました。
以上の結果は、多様な環境で働く酵素間においても基質親和性の最適化が活性向上に有効であることを確認し、さらに親和性以外の因子も活性に影響を与えることを示します。本研究で同定されたアレニウスプレ因子を含む新たな因子を制御できるようになれば、酵素の活性を基質親和性の最適化だけでは到達できない領域まで向上できると期待されます。
今後の期待
今回の発見は、基質親和性と最大活性の間の制約を破ることで、高活性な酵素を作ることができる可能性を示唆します。本研究で見つかった支配因子を人為的に操作することが実際に酵素反応の効率向上につながれば、酵素を利用するバイオ工学・代謝工学において幅広く応用が可能だと期待されます。
これは、国際連合が定めた17項目の「持続可能な開発目標(SDGs)[10]」のうち、「2.飢餓をゼロに」「3.すべての人に健康と福祉を」「7.エネルギーをみんなに そしてクリーンに」「13.気候変動に具体的な対策を」に貢献するものです。
補足説明
1.酵素活性
酵素反応の速度を表す尺度。高活性な酵素ほど目的生成物を速く、たくさん合成できるため、酵素活性の向上は工学的に重要な課題である。
2.基質
酵素反応によって消費される化学物質のこと。例えば、酒類に含まれるエタノールはアルコール分解酵素の基質である。
3.親和性
基質と酵素の結合しやすさの度合いのこと。Km(ミカエリス・メンテン定数)は基質親和性の強さを表す指標で、最大活性の半分の活性値を示す基質濃度を意味する。したがってKmの値が小さいほど基質親和性が強く、低基質濃度で最大活性に近づく。
4.アレニウスプレ因子
温度依存的な化学反応速度(酵素反応を含む)を表すアレニウスの式を構成する要素の一つ。アレニウスプレ因子は、温度に無関係な定数で頻度因子(A)とも呼ばれる。
5.ホスホセリンホスファターゼ
アミノ酸合成酵素の一種で、ホスホセリンからセリンを作る反応を触媒する。ホスホセリンホスファターゼには進化的起源が異なるものが3種類存在するため、評価対象の酵素の多様性を確保することが可能となった。
6.触媒化学の理論
人工触媒の分野には、「基質と適度な親和性を持つ触媒を用いると反応速度が向上する」という経験則がある。これは、親和性が弱過ぎると触媒の影響が薄く、逆に強過ぎると、反応が終わっても基質からできた生成物が触媒から離れなくなってしまうためである。この「親和性を高め過ぎると反応速度が低下してしまう」という考え方は、人工材料だけでなく、生物触媒である酵素にも適用可能と近年考えられており、これが本研究における理論解析の土台となった。
7.進化系統
分子進化の観点で示された生物の類縁関係(系統)のこと。
8.セルラーゼ
酵素の一つで、セルロース(糖のポリマーで、植物などに豊富に含まれる)分解を触媒する。
9.kcat
ミカエリス・メンテン機構に従う酵素は、基質濃度が大きければ大きいほど反応が加速する。しかし、基質濃度が十分に大きいと、それ以上基質濃度を上げてもほとんど加速しなくなり、ある限界の速度に漸近する。kcatとは、この酵素ごとの最大速度である。
10.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
研究チーム
理化学研究所 環境資源科学研究センター
生体機能触媒研究チーム
チームリーダー 中村 龍平(ナカムラ・リュウヘイ)
(東京工業大学 地球生命研究所 教授)
上級研究員 千葉 洋子(チバ・ヨウコ)
(筑波大学 生命環境系 准教授(連携大学院))
研究員 大岡 英史(オオオカ・ヒデシ)
テクニカルスタッフⅠ(研究当時)ウィンツァー・マリー(Marie E. Wintzer)
テクニカルスタッフⅡ 常松 奈緒(ツネマツ・ナオ)
分子構造解析ユニット
技師 野川 俊彦(ノガワ・トシヒコ)
生命分子解析ユニット
ユニットリーダー 堂前 直(ドウマエ・ナオシ)
専任技師 鈴木 健裕(スズキ・タケヒロ)
研究支援
本研究は、科学技術振興機構(JST)ACT-X「酵素のKm値再考察:最適値を決める因子の探索(研究代表者:千葉洋子、JPMJAX20BB)」および同機構創発的研究支援事業「非平衡状態における触媒反応ネットワーク理論の開拓(研究代表者:大岡英史、JPMJFR213E)」による助成を受けて行われました。
原論文情報
Yoko Chiba, Hideshi Ooka, Marie E. Wintzer, Nao Tsunematsu, Toshihiko Nogawa, Takehiro Suzuki, Naoshi Dohmae, Ryuhei Nakamura, “Rationalizing the Influence of the Binding Affinity on the Activity of Phosphoserine Phosphatases”, Angewandte Chemie International Edition, 10.1002/anie.202318635
発表者
理化学研究所
環境資源科学研究センター 生体機能触媒研究チーム
上級研究員 千葉 洋子(チバ・ヨウコ)
研究員 大岡 英史(オオオカ・ヒデシ)
チームリーダー 中村 龍平(ナカムラ・リュウヘイ)
報道担当
理化学研究所 広報室 報道担当
科学技術振興機構 広報課
JSTの事業に関すること
科学技術振興機構 戦略研究推進部 先進融合研究グループ
宇佐見 健(ウサミ・タケシ)