2021-08-26 アメリカ合衆国・ノースウェスタン大学
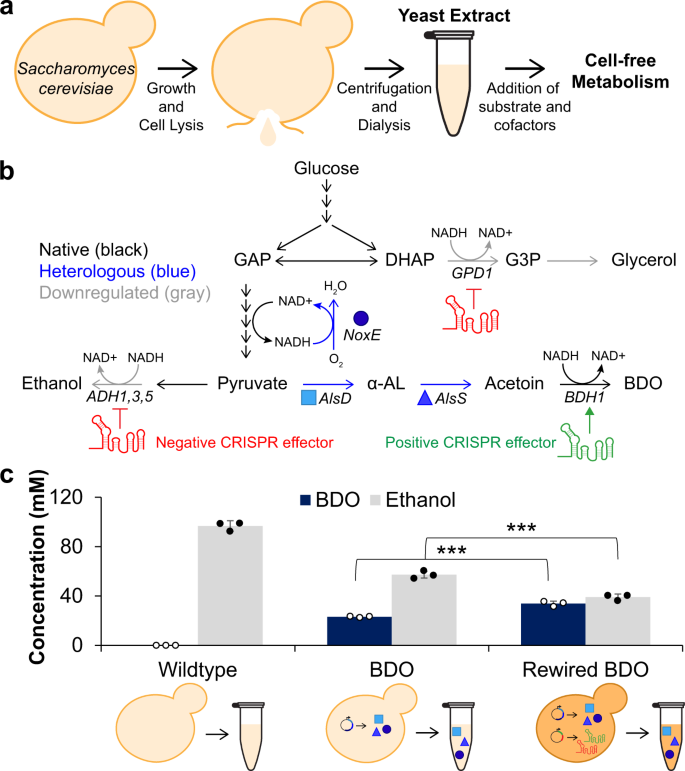
・ ノースウェスタン大学とテキサス大学オースチン校が、パンの製造やアルコール醸造に利用されている酵母の一種であるサッカロミカス・セルビシエ(S-cervisiae)の遺伝子改変菌株の細胞抽出物を利用した、インビトロ・セルフリー(無細胞)生合成(バイオケミカル生産)プロセスを開発。
・ 数十年にわたる代謝研究と遺伝子改変ツールの開発を通じて高度に制御が可能なバイオケミカル生産のフレームワークとなった S-cervisiae は、工業や健康維持のアプリケーションに向けた様々な標的分子の生産に利用されている。
・ 細胞を利用したバイオケミカル生産システムでは、細胞生産と物質生産の競合が課題となっている。細胞から抽出した材料をセルフリーの生化学反応に利用することで、生体細胞では調整が困難な代謝改変手段を最適化した。
・ 細胞抽出物は 溶解した細胞の可溶性の構成要素を分離することで、細胞増殖の無い化学物質合成手段を提供する。細胞増殖中の酵素生産とセルフリー反応によるバイオケミカル生産プロセスを切り離し、元の菌株よりも大きな容積生産性での多様な化学物質の生合成を可能にする。
・ セルフリー反応の生合成の可能性を高めるために、S-cervisiae からの抽出物の利用と細胞代謝工学技術の導入により、改変無しの E.Coli を使用した従前のセルフリー生合成技術を発展させた。細胞の代謝再配線で作製した抽出物が、野生型(改変無し)の抽出物や細胞培養に比べてより多く物質を生合成可能なことを実証した。
・ 特に、細胞を使用した同様なアプローチの最大 10 倍速いブタンジオール、グリセロールとイタコン酸の 3 種類の化学製品のセルフリー生産の実証は、セルフリー生合成による細胞工学導入の適応性と有効性を示している。
・ 次は、本研究の成果を踏まえ、代謝変更における経路のプロトタイピングと現行の細胞ベース手法を補完するセルフリー・バイオマニュファクチャリングに着手する。
・ 本研究は、米国エネルギー省(DOE) Joint Genome Institute(JGI)の Emerging Technologies
Opportunity Program(ETOP)が支援した。
URL: https://www.mccormick.northwestern.edu/news/articles/2021/08/using-yeast-to-create-alternative-petrochemical-processes/
<NEDO海外技術情報より>
(関連情報)
Nature Communications 掲載論文(フルテキスト)
An integrated in vivo/in vitro framework to enhance cell-free biosynthesis with metabolically rewired
yeast extracts
URL: https://www.nature.com/articles/s41467-021-25233-y
Abstract
Cell-free systems using crude cell extracts present appealing opportunities for designing biosynthetic pathways and enabling sustainable chemical synthesis. However, the lack of tools to effectively manipulate the underlying host metabolism in vitro limits the potential of these systems. Here, we create an integrated framework to address this gap that leverages cell extracts from host strains genetically rewired by multiplexed CRISPR-dCas9 modulation and other metabolic engineering techniques. As a model, we explore conversion of glucose to 2,3-butanediol in extracts from flux-enhanced Saccharomyces cerevisiae strains. We show that cellular flux rewiring in several strains of S. cerevisiae combined with systematic optimization of the cell-free reaction environment significantly increases 2,3-butanediol titers and volumetric productivities, reaching productivities greater than 0.9 g/L-h. We then show the generalizability of the framework by improving cell-free itaconic acid and glycerol biosynthesis. Our coupled in vivo/in vitro metabolic engineering approach opens opportunities for synthetic biology prototyping efforts and cell-free biomanufacturing.



