2020-06-03 神戸大学,熊本大学,日本医療研究開発機構
神戸大学大学院医学研究科内科系講座小児科学分野の野津寛大特命教授、山村智彦助教、松尾雅文前教授、飯島一誠教授ら、同医療情報部の髙岡裕准教授および、熊本大学の甲斐広文教授ら、理化学研究所の髙里実チームリーダーらのグループが、第一三共株式会社との共同研究で、これまで治療法がなくほとんどの患者が進行して腎不全を発症する難治性の腎疾患を呈するアルポート症候群に対し、核酸医薬*1 を用いた特異的治療法としてエクソンスキッピング療法の開発を行い、同療法が疾患モデル動物において著効することを明らかにしました。
研究成果は、2020年6月2日(現地時間)に、国際科学誌「Nature Communications」にオンライン公開されました。
ポイント
- アルポート症候群は腎炎、難聴、目の合併症(円錐水晶体や白内障など)を伴う遺伝性の疾患で、そのほとんどがX染色体連鎖型*2の疾患であるため、特に男性で重症の症状を呈する。
- 具体的には男性患者では40歳までに90%が腎不全になり、透析や腎臓移植などの腎代替療法が必要になる。また、特にアルポート症候群の原因遺伝子であるCOL4A5に重症型の変異(ナンセンス変異*3 など)を有する場合が重症で、20歳代前半で末期腎不全に進行することが知られている。
- 本研究チームは、重症型の変異を有するアルポート症候群患者に対する、核酸医薬を用いたエクソンスキッピング療法により、軽症型の遺伝子変異に置換する治療法を開発した。
- 本治療法により、疾患モデルマウスで腎機能悪化を抑制し、生存期間も著明に延長させることができ、疾患モデルマウスの腎不全進行に対して著効することを証明した。
- この研究成果は、現在まで根治療法の無いアルポート症候群に対する、世界で初めての特異的治療法の開発に大きく貢献することが期待できる。
研究の背景
アルポート症候群は常染色体優性多発性嚢胞腎(ADPKD)に次いで2番目に発症頻度の高い遺伝性腎疾患で、海外からは発症頻度は5,000人から10,000人に1人と報告されています。しばしば腎不全へと進行する腎症、難聴、眼合併症を特徴とし、その遺伝形式にはX染色体連鎖型、常染色体優性、常染色体劣性の3つの遺伝様式がありますが、約80%がX染色体連鎖型です。X染色体連鎖型アルポート症候群(XLAS)は、男性患者で特に重症化しやすく、男性患者の約90%が40歳までに末期腎不全へと進行しますが、これまで疾患特異的治療法は存在しません。4型コラーゲンα5鎖(α5(IV))をコードする遺伝子COL4A5遺伝子の異常により発症するため、男性患者においては腎臓にα5(IV)タンパクの発現を一切認めません。XLAS男性患者がCOL4A5遺伝子にナンセンス変異等の重症型の変異を有する場合、ミスセンス変異などの軽症型の変異を有する場合に比較し、15年以上腎不全進行が早いことが知られています。つまり、本疾患においては、重症型変異を軽症型変異に置換することができれば軽症化が可能と考えられました。
研究の内容
本研究チームは核酸医薬(アンチセンス核酸;ASO*4)を用いて重症型変異を軽症型変異に置換する、エクソンスキッピング療法の開発に着手しました(図1)。ASOを用いた治療は近年注目されており、脊髄性筋萎縮症およびデュシャンヌ型筋ジストロフィーなどの難治性の遺伝性疾患に対してすでに臨床応用され、非常に注目されています。
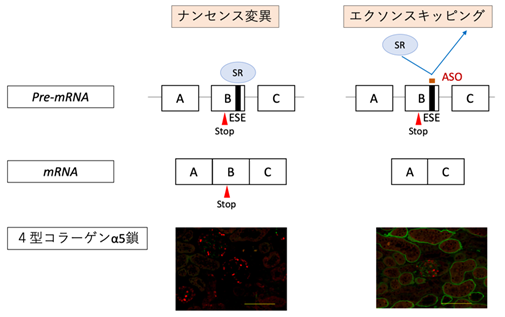
図1 エクソンスキッピング療法作用機序
XLASは、腎臓の糸球体基底膜を構成する最も重要なタンパクであるα5(IV)をコードする遺伝子COL4A5に変異を有することで、異常なα5(IV)が産生されることで発症します。特にCOL4A5にナンセンス変異等の重症型の遺伝子変異を認める場合は20歳代前半までに末期腎不全へと進行します。一方、3の倍数の塩基数の欠失(in-frame変異*5)を認める場合は軽症型となり、およそ10年間末期腎不全進行年齢が遅延することを野津特命教授らは過去に報告しています。そのため、ASOを用いたエクソンスキッピング療法により、重症型変異を軽症型変異(in-frame変異)へと置換することで軽症化が可能になると考えられました。アルポート症候群の原因遺伝子であるCOL4A5遺伝子は、ほとんどのエクソン*6が3の倍数の塩基数で構成されています。そのため、それらのエクソンにナンセンス変異を有する場合、そのエクソンをスキッピングさせる、つまり、変異が存在するエクソン部分がスプライシングによって除かれるようにすることにより3の倍数の変異(in-frame変異)へと置換することが可能です。
具体的なASOによるエクソンスキッピング療法の作用機序に関して図1に示します。ナンセンス変異を有する場合、メッセンジャーRNA*7(mRNA)においてもナンセンス変異が残存するため、不完全なタンパクが産生されます。その結果、腎臓においてα5(IV)タンパクの発現を認めません(図1 左、腎臓においてα5(IV)タンパクを示す緑のシグナルを全く認めない)。一方、ASOを用いたエクソンスキッピング療法を行うことで、pre-mRNAにおいて、ASOがExonic splicing enhancer(ESE)領域に結合し、エクソンに対するSRタンパク*8の結合がブロックされます。SRタンパクの結合はエクソンとして認識されるための重要な作業であり、それがブロックされることでエクソンのスキッピングが誘導されます。これにより、ナンセンス変異を有さないmRNAが産生されます(図1右)。実際、COL4A5のナンセンス変異を有するマウスモデルに同治療法を行ったところ、腎臓において、α5(IV)タンパクの発現が確認されました(図1 右下、緑のシグナル)。また、同療法により、ASO治療群では尿タンパクの漏出を生理食塩水投与(Vehicle)群に比較して有意に抑制し(図2)、腎機能障害の進行(血清クレアチニン値の上昇)も抑制しました(図3)。さらに生存期間を著明に延長させることに成功しました(図4)。これらの結果に加え、腎病理組織学的にも腎障害の進行を著明に抑制できました。
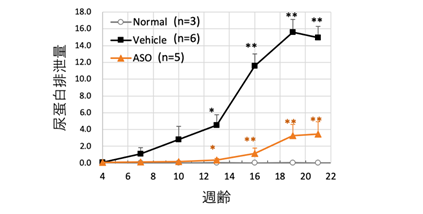
図2 エクソンスキッピング療法の尿蛋白量への影響
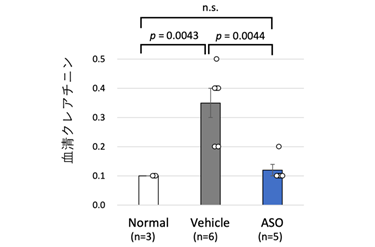
図3 エクソンスキッピング療法の腎機能への影響
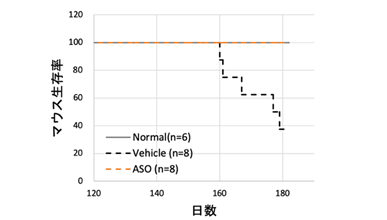
図4 エクソンスキッピング療法による生存期間の延長
以上からエクソンスキッピング療法は重症の遺伝子変異を有するアルポート症候群モデルマウスに対して著効することが証明されました。
今後の展開
現在、モデル動物において薬剤の投与量の決定および安全性を評価する試験を進行中であり、これらの評価が終了後、患者さんに対する治験を行う予定です。
用語解説
- *1 核酸医薬;
- 核酸医薬とは、生物の遺伝情報を司る、DNAやRNAの構成成分であるヌクレオチドを基本骨格とする医薬品の総称であり、低分子医薬品、抗体医薬品に続く第3の医薬品と言われ大変注目されている。従来の医薬品では治療が難しかった疾患を根治する可能性を秘めた、次代の医療を支える医薬品として期待されている。
- *2 X染色体連鎖型遺伝性疾患;
- X染色体上にコードされている遺伝子の異常により発症する遺伝性疾患。男性はX染色体が1本のみであるため、2本保持している女性に比較し重症の臨床像を呈することを特徴とする。
- *3 ナンセンス変異;遺伝子上の塩基配列の異常(遺伝子変異)のうち、ストップコドンが形成される変異をさす。その場合、ナンセンス変異を有する場所で産生されるタンパクが途切れるため、不完全なタンパクが産生される。一方、同じ遺伝子変異でもミスセンス変異といわれる変異は一つのアミノ酸が他のアミノ酸に置換されるため異常な蛋白が産生されるが、タンパクは途切れず、全長産生される。そのため、XLASにおいてはナンセンス変異を有する場合は最重症の臨床像を呈する。
- *4 in-frame変異;
- 3つの塩基毎に1つのアミノ酸がコードされている。そのため3で割り切れる塩基数の欠失変異では、それに対応するアミノ酸の欠失を認めるが、その後の配列は正常と同じである。このように、欠失の後の変異が正常のアミノ酸配列と同じとなる変異をin-frame変異と呼ぶ。XLASにおいてはこのような変異はナンセンス変異より明らかに軽症である。
- *5 アンチセンス核酸(ASO);
- 核酸医薬の中でも、標的とするメッセンジャーRNA(*7で解説)に存在する核酸の配列に対する相補的な配列をもつ核酸医薬を用いることで遺伝子の発現をコントロールすることができる。そのような核酸の配列を有する核酸医薬をアンチセンス核酸と呼ぶ。
- *6 エクソン;
- タンパクの設計図とも言える遺伝子は塩基の決まった配列で構成されている。その中でも実際のタンパクの配列をコードしている箇所をエクソン、コードしていない箇所をイントロンと呼び、遺伝子の中でもエクソンは最も重要な部分と考えられる。
*7 メッセンジャーRNA; - タンパクの設計図である遺伝子から特に重要であるエクソンの部分の配列のみを転写・スプライシングという作業を経て映し出したもの。遺伝子がタンパクの設計図としたら、メッセンジャーRNAは設計図を元に作り出した、タンパクの鋳型と言える。このメッセンジャーRNAの塩基配列に従い、各種アミノ酸が組み込まれて、タンパクが形成される。
- *8 SRタンパク;
- メッセンジャーRNAからは転写という過程を経てプレメッセンジャーRNAが産生される。さらにスプライシングという作業を経てメッセンジャーRNAが産生される。このスプライシングの作業において、SRタンパクがエクソン部分に結合することで、エクソンがエクソンとして認識され、イントロンをとばしてエクソンによるメッセンジャーRNAが産生される。
謝辞
この研究は2014年12月、第一三共株式会社の創薬共同研究公募プログラム「TaNeDS」で採択され、同社と共同で研究開発が開始されました。また2017年4月からは国立研究開発法人日本医療研究開発機構(AMED)の難治性疾患実用化研究事業・希少疾患に対する画期的な医薬品医療機器等の実用化に関する研究・薬事承認を目指すシーズ探索研究(ステップ0)の支援のもとに研究を継続して参りました。
論文情報
- タイトル
- Development of an Exon skipping therapy for X-linked Alport syndrome with truncating variants in COL4A5
- DOI
- 10.1038/s41467-020-16605-x
- 著者
- Tomohiko Yamamura1, Tomoko Horinouchi1, Tomomi Adachi2, Maki Terakawa2, Yutaka Takaoka3, Kohei Omachi4, Minoru Takasato5, Kiyosumi Takaishi2, Takao Shoji6, Yoshiyuki Onishi6, Yoshito Kanazawa6, Makoto Koizumi6, Yasuko Tomono7, Aki Sugano3, Akemi Shono1, Shogo Minamikawa1, China Nagano1, Nana Sakakibara1, Shinya Ishiko1, Yuya Aoto1, Misato Kamura4, Yutaka Harita8, Kenichiro Miura9, Shoichiro Kanda8, Naoya Morisada1, Rini Rossanti1, Ming Juan Ye1, Yoshimi Nozu1, Masafumi Matsuo10, Hirofumi Kai4, Kazumoto Iijima1 and Kandai Nozu1*
-
- Department of Pediatrics, Kobe University Graduate School of Medicine
- Rare Disease Laboratories, Daiichi Sankyo Co., Ltd, Shinagawa
- Division of Medical Informatics and Bioinformatics, Kobe University Hospital
- Department of Molecular Medicine, Graduate School of Pharmaceutical Sciences, Kumamoto University
- RIKEN Center for Developmental Biology
- Modality Research Laboratories, Daiichi Sankyo Co., Ltd, Shinagawa
- Division of Molecular Cell Biology, Shigei Medical Research Institute
- Department of Pediatrics, Graduate School of Medicine, The University of Tokyo
- Department of Pediatric Nephrology, Tokyo Women’s Medical University
- Department of Physical Therapy, Faculty of Rehabilitation, Kobe Gakuin University
- 掲載誌
- Nature Communications
お問い合わせ先
研究について
神戸大学大学院医学研究科内科系講座小児科学分野
特命教授 野津 寛大(のづ かんだい)
熊本大学大学院生命科学研究部附属グローバル天然物科学研究センター
大学院薬学教育部 遺伝子機能応用学研究室
教授 甲斐 広文(かい ひろふみ)
報道担当
神戸大学総務部広報課
熊本大学総務部総務課広報戦略室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構 創薬事業部創薬企画・評価課



