ポリマーコーティングの2段階の水和挙動を簡単に検出
2020-05-13 理化学研究所,大阪府立大学,近畿大学,北川鉄工所
理化学研究所(理研)生命機能科学研究センター集積バイオデバイス研究チームの田中信行上級研究員、田中陽チームリーダー、大阪府立大学大学院工学研究科の児島千恵准教授、松本章一教授、近畿大学工学部の白石浩平教授、株式会社北川鉄工所の春園嘉英課長らの共同研究グループは、医療材料として用いられるポリマーコーティングの「水和」挙動を簡単に評価できる手法を開発しました。
本研究成果は、血栓防止などの機能性付与のために、生体接触型医療機器に用いられるコーティングの性能評価や素材開発に貢献すると期待できます。
生体接触型医療機器の表面にタンパク質などが付着すると、機器表面に細胞が接着したり、血管中に血栓が形成されたりします。これを防ぐために開発されたポリマーコーティング材料の機能性は、生体内の水分子とポリマーがなじむ水和により発揮されます。しかし、水和を簡単に評価することは難しく、水和の詳しい理解とポリマーコーティング材料の簡便な評価法が求められていました。
今回、共同研究グループは、乾燥と湿潤の両状態で親水性を評価できる手法を開発し、二つのポリマーコーティング材料の機能性を調べた結果、「乾燥状態から湿潤状態への移行による親水性の変化」と「湿潤状態が長く続くことによる親水性の変化」の2段階の水和挙動が引き起こされることを明らかにしました。
本研究は、科学雑誌『Langmuir』のアクセプト版(4月19日付)に掲載され、オンライン版も近日中に公開されます。
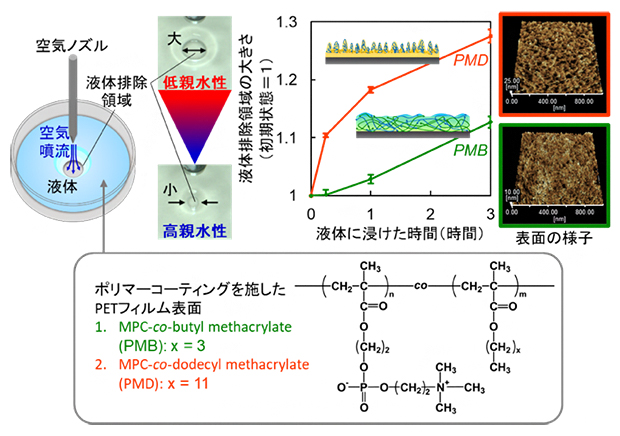
空気噴射液体排除法によるポリマーコーティングの水和挙動評価
背景
人工心肺、人工血管、ステントなどの医療機器の表面に、タンパク質などの生体高分子が付着すると、それがきっかけとなり機器表面に細胞が接着したり、血管中で血液が固まって血栓が形成されたりすることがあります。この血栓が、ひとたび循環系に流れ出てしまうと、血管の閉塞や虚血(臓器や組織に必要量の血液が供給されない状態)による組織壊死が引き起こされます。このような生体高分子の付着を防ぐために、体内医療機器表面に生体高分子が付着しないようにするポリマーコーティング材料が開発されています(図1)注1)。
ポリマーコーティング材料は、水となじみやすい部分(親水性部分)とそうでない部分(疎水性部分)の構造を併せ持っており、細胞接着を抑制する能力は、ポリマーの親水性部分と生体内に豊富に存在する水がよくなじむ現象(水和)によって発揮されます。一方、疎水性部分は医療材料表面にポリマーコーティングする際に欠かせない部分ですが、この部分をわずかに変えるだけで、細胞接着の抑制能力が変わってしまうことが知られています。したがって、疎水性部分の変化もポリマーコーティング素材の水和に影響を及ぼしていると考えられます。
しかし、このような水和は、ナノメートル(nm、1nmは10億分の1メートル)オーダーの分子同士の相互作用に起因することから、簡単に評価することが難しく、水和の詳しい理解と簡便な評価法が求められていました。
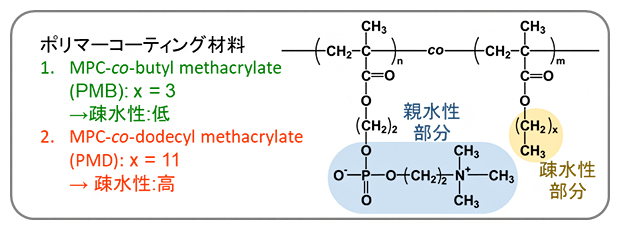
図1 医療材料表面へのポリマーコーティング材料
2種類のポリマーコーティング材料の構造式を示した。1の「PMB」は、ポリ(MPC-co-ブチルメタクリレート)の略であり、MPCとブチルメタクリレートの共重合体を意味する。MPCは2-メタクリロイルオキシエチルホスホリルコリンを指す。2の「PMD」はポリ(MPC-co-ドデシルメタクリレート)の略で、MPCとドデシルメタクリレートの共重合体を意味する。PMBでは疎水性部分のメチレン基(-CH2-)が3個、PMDでは11個連なっているため、PMDの方がPMBよりも疎水性が高い。
注1)R. Katayama, M. Ikeda, K. Shiraishi, A. Matsumoto, C. Kojima, “Formation of hydrophobic domains on the poly(MPC-co-dodecyl methacrylate)-coated surface recognized by macrophage-like cells”, Langmuir, 35, 12229-12235 (2019)
研究手法と成果
共同研究グループは、親水性を評価することにより、ポリマーコーティング材料の水和を捉えることができるのではないかと考えました。一般的に親水性の評価には、評価対象表面に水滴を接触させたときの接触角が用いられますが、これは乾燥状態での評価が基本であるため、水和を対象とすることは困難でした。これまで、理研と株式会社北川鉄工所は水滴の代わりに、液体に覆われた評価対象の物体表面に空気噴流を当てたときの液体の動きから、親水性を評価する空気噴射液体排除法(air injection-mediated liquid exclusion; AIEL法)を共同開発しており(図2)、液体中にある培養細胞の評価やバイオフィルム[1]の検出などに応用されています注2-4)。この手法によって、空気噴流で生じた「液体排除領域」が小さいほど、物体表面の親水性は高いということが明らかになっています。
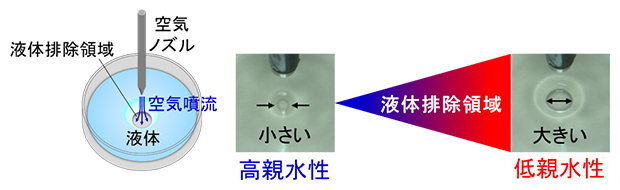
図2 空気噴射液体排除法(AILE法)による物体表面の親和性評価
液体に覆われた物体表面に空気噴流を当てると、空気噴流によって液体が排除される。この液体排除領域の面積が小さいほど、物体表面の親水性は高い。
注2)2019年6月11日プレスリリース「触れずにヌメリをはかる」
注3)2017年9月19日プレスリリース「細胞のうるおいを測る」
注4)Nobuyuki Tanaka, Makoto Kondo, Ryohei Uchida, Makoto Kaneko, Hiroaki Sugiyama, Masayuki Yamato, and Teruo Okano, “Splitting culture medium by air-jet and rewetting for the assessment of the wettability of cultured epithelial cell surfaces.” Biomaterials, 34, 9082-9088, 2013.
今回は、容器に液体を入れた後で空気を噴射する通常のAILE法に加えて、先に空気を噴射してから液体を注入したときに生じる液体排除領域を計測する「Pre-jetted AILE法」を導入しました。通常のAILE法では湿潤状態の、Pre-jetted AILE法では乾燥状態の物体表面の親水性をそれぞれ調べることができます。これにより、ポリマーコーティングの乾燥状態から湿潤状態への親水性の変化、湿潤状態での水和による親水性の経時変化を総合的に評価できるようになりました。
実際の医療機器への応用を模擬して、二つのポリエチレンテレフタレート(PET)製フィルムにポリマーコーティング材料のPMB[2](分子の疎水性部分が短い)とPMD[2](分子の疎水性部分が長い)をそれぞれコーティングし、親水性を評価しました。その結果、PMBとPMDコーティングのどちらのフィルムにおいても、乾燥状態から湿潤状態に移行すると液体排除領域が急激に小さくなることが分かりました(図3左)。一方、通常のAILE法で親水性を経時的に評価したところ、どちらのコーティングでも、液体に漬けた時間が長くなると液体排除領域が徐々に大きくなることが分かりました(図3右)。
以上の結果から、ポリマーコーティングの親水性には、「乾燥状態から湿潤状態に移行する際の変化」と「湿潤状態が長く続くことによる変化」の二つがあると考えられます。つまり、乾燥状態ではもともと親水性が低かった表面が、液体に漬けて湿潤状態になるといったん親水性が高まり、その後、湿潤状態が長く続くと親水性が徐々に低下していくという変化です。
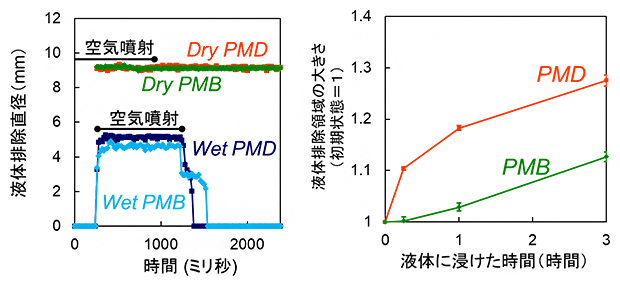
図3 ポリマーコーティングされたPET製フィルムの液体排除領域の大きさの変化
(左)PMBおよびPMDでコーティングされたPET製フィルムを用いて、空気噴射液体排除を行った。グラフは、Pre-jetted AILE法で計測した乾燥状態(Dry)、および通常のAILE法で計測した湿潤状態(Wet)の液体排除領域の直径を示す。PMBおよびPMDのどちらのコーティングでも、乾燥状態から湿潤状態に移行すると液体排除領域は急激に小さくなった。
(右)通常のAILE法により、液体に漬けた際の経時変化。PMBおよびPMDのどちらのコーティングでも、液体に漬けた時間が長くなると液体排除領域が徐々に大きくなった。
このような親水性における、乾燥状態から湿潤状態の変化と湿潤状態における経時変化は異なる物理現象によると考えられました。そこで、ポリマーコーティングされたPET製フィルムの表面を微視的に観察することにし、走査型プローブ顕微鏡[3]による表面の凹凸の観察と、エリプソメトリー[4]と呼ばれる光学的手法によるポリマーコーティング膜厚の計測をそれぞれ行いました。
まず、走査型プローブ顕微鏡の結果、分子の疎水性部分が長いPMDでは、フィルム表面の凹凸の大きさ(粗さ)が乾燥状態から湿潤状態になると約1.8倍になるのに対して、分子の疎水性部分が短いPMBでは変化しないことが分かりました(図4上)。親水性部分と疎水性部分を持つポリマーでは、乾燥状態から湿潤状態に移行すると、親水性部分と疎水性部分の位置関係が変化する「再配列」現象が生じることが知られています。具体的には、もともとランダムに並んでいた親水性と疎水性の部分が、親水性部分は水側に、疎水性部分はポリマーの内部に配列する変化が起こります。今回、特にPMDでは、表面の粗さが変化するようなより極端な再配列が生じたと考えられます。
一方、エリプソメトリーで計測したポリマーコーティング膜厚は、PMBとPMDのいずれも乾燥状態から湿潤状態になると増加することが分かりました(図4下)。これは、ポリマーコーティング膜が湿潤状態に置かれたことで、スポンジのように水を吸収して「膨潤」したからだと考えられます。
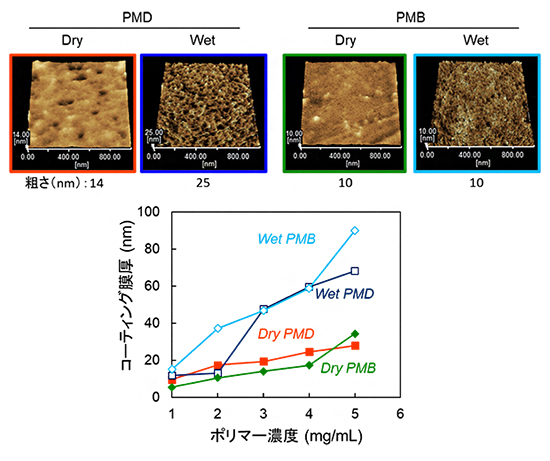
図4 ポリマーコーティングPET製フィルムの微視的観察
(上)走査型プローブ顕微鏡によるフィルム表面の凹凸の大きさ(粗さ)の観察結果。PMD(分子の疎水性部分が長い)では、粗さが乾燥状態(Dry)から湿潤状態(Wet)になると、14nmから25nmへと約1.8倍になった。PMB(分子の疎水性部分が短い)では、粗さは10nmで変化しなかった。
(下)エリプソメトリーによるポリマーコーティング膜厚の計測結果。PMBとPMDのいずれの膜厚も、乾燥状態(Dry)から湿潤状態(wet)になると増加した。
なお、ポリマー分子の再配列は秒単位で生じる極めて速い変化であり、膨潤はポリマー内部まで水分子が行きわたるまで時間がかかるため遅い変化であることが知られています。つまり、最初にポリマーコーティング膜表面の分子の再配列が起こり、その後コーティング膜内部まで水和し膨潤したと考えられ、それぞれ、「乾燥状態から湿潤状態への移行による親水性の変化」と「湿潤状態が長く続くことによる親水性の変化」が引き起こされたと考察しています(図5)。
その結果、最終的には、PMDの表面には疎水性領域が部分的に出現し、疎水性相互作用(疎水性部分同士が水にはじかれ、集合する現象)などにより、タンパク質がPMD表面に吸着するのをきっかけに、細胞接着が誘導されやすい一方、PMBの表面は全体的により親水性となるので、タンパク質より水となじみやすいことからタンパク質吸着が抑制され細胞が接着されにくくなります。このように、PMBの方が、PMDよりも細胞接着の抑制能力が高いことが実証されました。
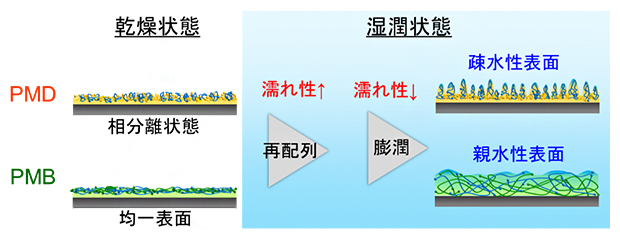
図5 ポリマーコーティング膜の水和挙動
水和は、ポリマー分子の「再配列」による短時間変化と、ポリマーコーティング膜の「膨潤」による比較的長時間の変化からなる。湿潤状態では最終的に、PMDの表面には疎水性領域が部分的に出現し、疎水性相互作用などによるタンパク質吸着をきっかけに細胞接着が誘導されやすい。一方、PMBの表面は全体的により親水性となるので、PMDよりも細胞が接着されにくい。
今後の期待
本研究では、医療機器の細胞接着や血栓の防止に用いられるポリマーコーティング膜の水和挙動を、表面の親水性を指標として、簡便に評価することに成功しました。水和が十分でない状態で、医療機器を体内に設置すると組織の癒着や血栓が起きやすくなりますが、AILE法を用いることで、各種ポリマーコーティング素材がどれくらい水和しやすいのか、またどれくらいの時間で十分な水和が生じるのかを簡便に調べることができます。本成果は、医療材料やコーティング方法の性能評価や製品の品質管理に役立つと期待できます。
また、AILE法は湿潤状態における表面の経時的な変化を追うことができます。細胞接着のきっかけとなるタンパク質の物体表面への吸着などは時々刻々と変化する現象ですが、このような液体に含まれる分子と物体表面との相互作用の解析に、AILE法が新たな手段として活用されると期待できます。
補足説明
1.バイオフィルム
微生物と微生物が産生する細胞外高分子物質(多糖類やタンパク質など)が、固体表面上に形成する構造体のこと。身近なところでは流しのヌメリなど。バイオフィルムは廃水処理に利用されるなど有用な面がある一方、各種材料の劣化や腐食、感染症などの健康被害を引き起こすことがある。
2.PMB、PMD
ポリマーコーティング材料。PMBは、ポリ(MPC-co-ブチルメタクリレート)の略であり、、MPCとブチルメタクリレートの共重合体を意味する。ここで、MPCは2-メタクリロイルオキシエチルホスホリルコリンを指す。PMDはポリ(MPC-co-ドデシルメタクリレート)の略であり、MPCとドデシルメタクリレートの共重合体を意味する。親水性部分はどちらも同じ構造である一方、PMBでは疎水性部分のメチレン基(-CH2-)が3個、PMDでは11個連なっている。疎水性部分が短いPMBの方が、PMDよりも細胞接着を抑制する能力が高い。
3.走査型プローブ顕微鏡
微小な針(プローブ)で試料表面をなぞることにより、試料の凹凸を観察する顕微鏡のこと。細胞や高分子などマイクロメートルからナノメートルの構造を観察するのに用いられる。プローブの種類やなぞり方を工夫することで、試料の硬さや磁力といった物性を観察できるものもある。
4.エリプソメトリー
薄膜表面に光を斜めからあて、反射した光を観察することにより薄膜の性質を評価する方法。薄膜の厚さ(膜厚)や光学特性を求めることができる。
共同研究グループ
理化学研究所 生命機能科学研究センター 集積バイオデバイス研究チーム
上級研究員 田中 信行(たなか のぶゆき)
チームリーダー 田中 陽(たなか よう)
大阪府立大学大学院 工学研究科
博士前期課程2年(研究当時) 片山 里紗(かたやま りさ)
(理研 生命機能科学研究センター 集積バイオデバイス研究チーム 研修生)
准教授 児島 千恵(こじま ちえ)
教授 松本 章一(まつもと あきかず)
近畿大学工学部 大学院システム工学研究科
博士前期課程2年(研究当時) 高木 優介(たかぎ ゆうすけ)
教授 白石 浩平(しらいし こうへい)
株式会社北川鉄工所 開発本部
課長 春園 嘉英(はるぞの よしひで)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究「非接触濡れ性センシングと細胞品質評価(研究代表者:田中信行)」および国際共同研究加速基金(国際共同研究強化(A))「濡れ性とマトリックス動態を介した細胞分化の非破壊評価(研究代表者:田中信行)」による支援を受けて行われました。
原論文情報
Risa Katayama, Nobuyuki Tanaka, Yusuke Takagi, Kohei Shiraishi, Yo Tanaka, Akikazu Matsumoto, and Chie Kojima, “Characterization of Hydration Process of Phospholipid-Mimetic Polymers Using the Air Injection-Mediated Liquid Exclusion Methods”, Langmuir, 10.1021/acs.langmuir.0c00953
発表者
理化学研究所
生命機能科学研究センター 集積バイオデバイス研究チーム
上級研究員 田中 信行(たなか のぶゆき)
チームリーダー 田中 陽(たなか よう)
大阪府立大学大学院 工学研究科
准教授 児島 千恵(こじま ちえ)
教授 松本 章一(まつもと あきかず)
近畿大学工学部 化学生命工学科・大学院システム工学研究科
教授 白石 浩平(しらいし こうへい)
株式会社北川鉄工所 開発本部
課長 春園 嘉英(はるぞの よしひで)
報道担当
理化学研究所 広報室 報道担当
大阪府立大学 広報課
近畿大学工学部事務部 広報担当:小笠原、住田、新宅
株式会社北川鉄工所 開発本部



