新たな作用点と薬理作用を持つ薬づくりへ
2020-04-02 東京大学,次世代天然物化学技術研究組合,日本医療研究開発機構
医薬品の30%以上は、G蛋白質共役型受容体(GPCR)1)と呼ばれる膜タンパク質に存在する、生理的リガンドが結合する部位に作用して、シグナル伝達活性を変化させることで、治療効果を発揮します。GPCR上の生理的リガンド結合部位から離れた部位に作用するアロステリックモジュレーターと呼ばれる薬剤は、生理的リガンドや従来の医薬品がすでに結合したGPCRの活性を変えるため、新たな薬理作用を持つことが期待されています。
生体内において、GPCRは脂質二重膜中で機能します。脂質がGPCRの活性や構造に与える影響を解明することは、生理的環境下におけるGPCRの機能を理解する上で、またアロステリックモジュレーターを開発する上で重要です。しかし、脂質がどのようにGPCRの活性を制御するかは不明でした。
東京大学大学院・薬学系研究科および次世代天然物化学技術研究組合の嶋田一夫教授の研究グループは、核磁気共鳴法(NMR法)2)を用いて、GPCRにおける、シグナルを流さない構造と、シグナルを異なる程度で流す複数の活性構造の多型を検出し、さらに生体内に存在する脂質二重膜の脂質が、活性構造の存在比を変化させ、シグナル伝達活性を制御することを明らかにしました。
本研究により、脂質の作用を模倣することで、生理的リガンドや他の薬剤が結合したGPCRに作用する薬剤設計の道が開け、新たな作用点および薬理作用を持つ医薬品の開発が加速することが期待されます。
研究開発のポイント
- 脂質二重膜中のGPCRでは、シグナルを流さない不活性型構造と、異なる程度でシグナルを流す複数の活性構造の構造多型が存在しており、既存の薬剤は不活性型構造と活性型構造の存在比を変えることで、また脂質は複数の活性型構造の存在比を変化させることで、GPCRのシグナル伝達活性を制御することを明らかにした。
- 生理的リガンドや従来の薬剤が結合したGPCRに作用できる、新規の作用点および薬理作用を持つ薬剤を設計する道が開け、医薬品の開発が加速することが期待される。
研究概要
GPCRは、市販される医薬品の標的分子の30%以上を示す、創薬上重要な膜タンパク質ファミリーです。GPCRを標的とする医薬品は、GPCRの生理的リガンドが結合する部位に作用して、シグナル伝達活性を変化させることで、治療効果を発揮します。一方、GPCRの生理的リガンド結合部位とは異なる部位に作用する、アロステリックモジュレーターと呼ばれる薬剤の開発が試みられています。現在、GPCRに属するカルシウム受容体CaRやケモカイン受容体CCR5に対するアロステリックモジュレーターであるシナカルセトとマラビロクが、高カルシウム血症の治療薬および抗HIV薬として上市されています。このような医薬品は、生理的リガンドや従来の医薬品がすでに結合したGPCRに対して作用できるため、新たな薬理作用を持つことが期待されます。
GPCRは、生体内において、脂質二重膜中で機能し、脂質の種類は組織、環境によって異なります。脂質がGPCRの活性や構造に与える影響を解明することは、生理的環境下におけるGPCRの機能の理解およびアロステリックモジュレーターの開発の上で重要です。しかし、脂質がどのようにGPCRの活性を制御するかは不明でした。
東京大学大学院・薬学系研究科および次世代天然物化学技術研究組合の嶋田一夫教授の研究グループは、タンパク質の動的構造を生理条件下である溶液環境中で解析可能な核磁気共鳴法を用いて、代表的なGPCRであるアデノシンA2A受容体 (A2AAR)の構造を、脂質組成を制御できる脂質二重膜を持つ可溶性の粒子であるナノディスク3)の脂質二重膜中に再構成した状態で解析しました(図1)。その結果、ナノディスク中のA2AARには、シグナルを流さない不活性型構造と、異なる程度でシグナルを流す複数の活性型構造の多型があることを明らかにしました。そして、既存の薬剤は不活性型構造と活性型構造の存在比を変えることで(図2)、また脂質は複数の活性型構造の存在比を変化させることで(図3)、シグナル伝達活性を制御することも明らかにしました。
以上の結果は、脂質の作用を模倣することで、生理的リガンドや従来の薬剤がすでに結合したGPCRに作用してシグナル伝達活性を変化させる、新規の作用点および薬理作用を持つ薬剤の開発が可能であることを示しています。このようなメカニズムの医薬品はこれまでに例がなく、GPCRを標的とした新しい医薬品開発を加速させることが期待されます。
なお、本研究の詳細は、2020年3月18日に米国の科学誌Science Advances 誌に掲載されました。
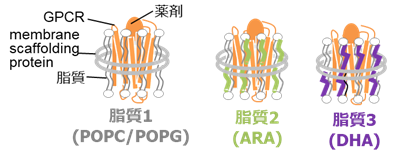
図1. ドコサヘキサエン酸 (DHA) 鎖、アラキドン酸 (ARA) 鎖を持つ脂質、および両者を含まない脂質(POPC/POPG)を含むナノディスクに再構成したA2AARの模式図。 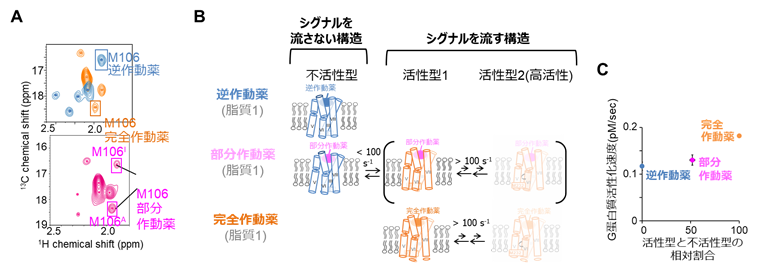
図2(A)薬効度の異なるリガンドが結合した条件で観測したA2AARのメチオニン106のNMRスペクトルの比較。部分作動薬結合状態では、化学シフトが逆作動薬結合状態に対応するシグナルと、完全作動薬結合状態に対応するシグナルが両方観測されたことから、シグナルを流さない構造と流す構造を遅く交換していることが示された。
(B)リガンドの薬効度に応じた、A2AARの構造多型の模式図。
(C) NMRで明らかになった構造多型の存在割合に対して、シグナル伝達活性が相関する。 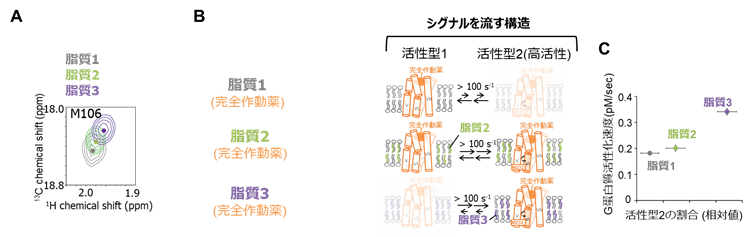
図3(A)脂質組成の異なるナノディスクに再構成したA2AARの、完全作動薬存在下におけるメチオニン106のNMRスペクトルの比較。化学シフトが連続的に変化しており、治療効果や副作用のシグナルを流す構造の存在割合が脂質により異なることが示された。
(B)脂質組成に応じた、A2AARの構造多型の模式図。
(C)NMRで明らかになった構造多型の存在割合に対して、シグナル伝達活性が相関する。
用語解説
- 1)Gタンパク質共役型受容体(GPCR)
- 7回膜貫通型の構造を特徴とする、真核生物における最大の膜蛋白質ファミリー。細胞膜上に発現し、細胞外からの神経伝達物質やホルモン等のリガンド刺激に応じて、細胞内のGタンパク質等のシグナル伝達分子を活性化させることにより細胞応答を誘起する。医薬品の最大の標的分子として認識されており、現在市販されている医薬品の多くがGPCRを標的としている。
- 2)核磁気共鳴(NMR)法
- 静磁場中の核スピンとラジオ波の相互作用を観測する分光法。タンパク質が活性を発揮する溶液中において、機能と関連するタンパク質の構造や運動性の性質を原子レベルで調べることができる。
- 3)ナノディスク
- 両親媒性へリックス構造を取るmembrane scaffold proteinが脂質二重膜構造を取り囲んだ、直径約10 nmのディスク状の粒子であり,中に膜蛋白質を再構成することが可能である。単分散で可溶性の粒子であるため、溶液NMR法に適している。ナノディスクを用いると、様々な組成の脂質二重膜環境における膜蛋白質の活性や構造を調べることが可能である。
特記事項
※この研究は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業(革新的中分子創薬技術の開発/中分子シミュレーション技術の開発)」および経済産業省の支援によって行われました。
論文情報
- 雑誌名:
- Science Advances (2020年3月18日)
- 論文タイトル:
- Activation of adenosine A2A receptor by lipids from docosahexaenoic acid revealed by NMR
- 著者:
- Takuya Mizumura, Keita Kondo, Masatoshi Kurita, Yutaka Kofuku, Mei Natsume, Shunsuke Imai, Yutaro Shiraishi, Takumi Ueda, Ichio Shimada
- DOI番号:
- 10.1126/sciadv.aay8544
お問い合わせ先
内容に関するお問い合わせ
国立大学法人東京大学大学院薬学系研究科 薬科学専攻
教授 嶋田 一夫(しまだ いちお)
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
次世代治療・診断実現のための創薬基盤技術開発事業担当