2022-08-11 マンチェスター大学
・ マンチェスター大学が、指向性進化法を通じてプラスチックの分解酵素を向上させる、新しい酵素を生成するプラットフォームを開発。
・ 近年、プラスチック廃棄物の問題に対処する環境に優しい支援策として、酵素を利用したプラスチックのリサイクル手法が注目されている。プラスチック分解酵素は、他のリサイクル手法に比べコスト効果的で効率的とされ、既存技術ではリサイクル困難な混合廃プラからの特定の構成要素の選択的な分解に利用できる。
・ 酵素によるプラスチックリサイクル手法の商業利用には、解決すべき課題が多い。例えば、プラスチック分解能力をもつ自然の酵素は、産業規模のプロセスの条件下では効果が薄れて不安定化する。
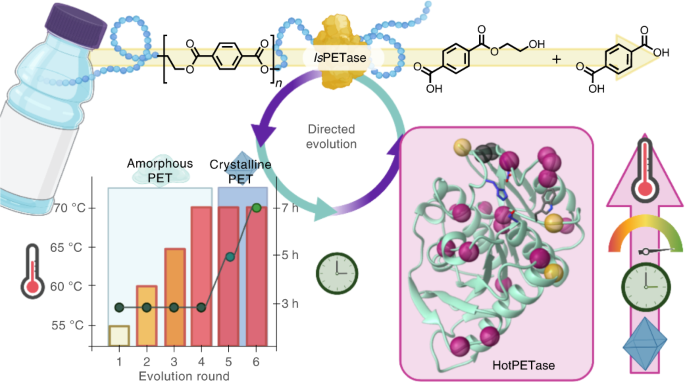
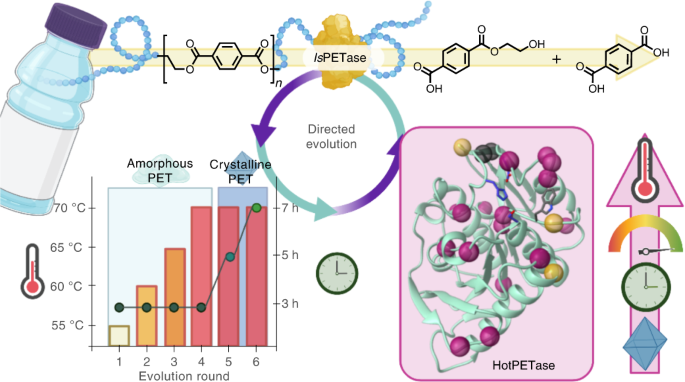
・ 新酵素生成プラットフォームは、一日当たり約 1,000 種類の酵素変異体のプラスチック分解能力を評価し、大規模リサイクルに適したプラスチック分解酵素の特性を迅速に向上させる。
・ 同プラットフォームの性能試験では、IsPETase の指向性進化法を通じ、HotPETase と呼ばれる新しい酵素を生成。IsPETase は、Ideonella sakaiensis が生産する最近発見された酵素で、ペットボトルに
使用されるポリエチレンテレフタレート(PET)を炭素・エネルギー源として使用する。
・ IsPETase は半結晶状態の PET の分解能力を有するが、望ましいプロセス条件を大きく下回る 40℃超の温度下では不安定となる。PET のガラス転移温度(~65℃)での反応が必要となるため、解重合率が低下する。
・ HotPETase は、PET のガラス転移温度を超える 70℃で活性する熱安定性酵素。従来酵素よりも迅速に半結晶 PET を解重合し、複合的な包装材の PET も選択的に分解できる。
・ プロセスエンジニアやポリマーサイエンティストとの学際的な産学協力を通じ、新酵素の実際のアプ
リケーションでの利用を目指す。新プラットフォームが、様々なプラスチック材料のリサイクルに向けた、より効率的で安定した選択的な酵素の生成に役立つことを期待する。
URL: https://www.manchester.ac.uk/discover/news/engineering-enzymes-to-help-solve-the-planets-plastic-problem/
<NEDO海外技術情報より>
関連情報
Nature Catalysis 掲載論文
Directed evolution of an efficient and thermostable PET depolymerase
URL: https://www.nature.com/articles/s41929-022-00821-3
Abstract
The recent discovery of IsPETase, a hydrolytic enzyme that can deconstruct poly(ethylene terephthalate) (PET), has sparked great interest in biocatalytic approaches to recycle plastics. Realization of commercial use will require the development of robust engineered enzymes that meet the demands of industrial processes. Although rationally engineered PETases have been described, enzymes that have been experimentally optimized via directed evolution have not previously been reported. Here, we describe an automated, high-throughput directed evolution platform for engineering polymer degrading enzymes. Applying catalytic activity at elevated temperatures as a primary selection pressure, a thermostable IsPETase variant (HotPETase, Tm = 82.5 °C) was engineered that can operate at the glass transition temperature of PET. HotPETase can depolymerize semicrystalline PET more rapidly than previously reported PETases and can selectively deconstruct the PET component of a laminated multimaterial. Structural analysis of HotPETase reveals interesting features that have emerged to improve thermotolerance and catalytic performance. Our study establishes laboratory evolution as a platform for engineering useful plastic degrading enzymes.