2022-07-07 量子科学技術研究開発機構
発表ポイント
- がんを切らずに、楽に治し、その高い治療効果が注目のアルファ線1)を放出するアクチニウム225(225Ac)3)標識薬剤による標的アイソトープ治療(TRT)2)を身近に。
- 全国的なTRT施設不足を解消するため、225Ac標識薬剤によるTRT専用のトレーラーハウス型施設を設計・製作。
- 本施設は、従来施設(数億円程度)の1/10程度のコストで病院に設置可能。
- トレーラーハウス型のため、必要な時に、必要とする病院に移動可能。
概要
国立研究開発法人 量子科学技術研究開発機構(理事長:平野俊夫、以下「量研」)は、アルファ線を放出するアクチニウム225(225Ac)を用いた標的アイソトープ治療(TRT)が可能なトレーラーハウス型RI施設を世界で初めて設計・製作しました(図1)。このトレーラーハウス型RI施設は、高額で手間のかかる建屋の建設・施工を要するRI治療施設のこれまでの常識を大きく塗り替えて、安価で容易に設置でき、移動可能なトレーラーハウス型にするという発想の転換によって誕生した、量研独自開発の世界初の施設です。令和4年6月30日に、原子力規制委員会からこの施設の放射線管理区域としての使用が許可されました。
225Acで標識された薬剤のひとつが、転移性前立腺がんに対して非常に高い治療効果を示した報告がなされて(2016年、ドイツ・ハイデルベルク大学)以降、225Acは世界的に注目されている放射性同位体(RI)4)です。225Ac標識薬剤はまだ世界では薬事承認されていませんが、量研では、日本で225Ac標識薬剤を用いたTRT(225Ac-TRT)を実現するために、225Acの国産化に貢献する製造法や、中皮腫5)および滑膜肉腫6)に対する225Ac標識薬剤の開発を行なってきました。開発が順調に進んでいる一方、肝心の225Ac-TRTを実施するための場所を確保することが全国的に難しく、将来、本治療を実現する際の社会的課題になることが懸念されています。
RIを取り扱う施設は、その設備等の能力に基づき、原子力規制委員会から許可された量(放射能)のRIしか使用することができません。既存のTRT施設の多くは、治療を最大限行うために、薬事承認されているベータ線7)放出RIとアルファ線放出RIを使用許可量の上限まで充てています。このため、既存施設に手を加えず、225Acの使用許可を新たに得て使用するためには、すでに使用許可を得ているRIの使用量を減らす必要が生じます。それでは、現在行なわれている治療ができなくなってしまい、患者に大きな不利益が生じます。また、すでに実施中のTRT診療に必要なRIの使用量は維持した上で、新たに225Acを使えるようにするには、TRT施設を新設・増設する必要があります。しかし、そのためには、数億円程度の投資が必要となるとされており、全国的に新たな治療施設を数多く整備することは容易ではありません。
そこで、高い治療効果が見込める225Ac-TRTを多くの患者に届けるため、量研は、従来のRI施設の新設・増設と比べて、1/10程度のコストで製作・設置でき、道路交通法に準拠しているため移動が可能な、トレーラーハウス型RI施設を考案しました(2020年2月18日特許申請)。この施設は、必要に応じて容易に移動できるため、希望する病院の駐車場などに一時的に配置することも可能です。225Ac-TRTの普及に大いに貢献することが期待されます。
今後は、225Ac標識薬剤を初めて人へ投与するFirst-in-human試験の3年後の実施を目指し、臨床利用に向けた実証試験として、トレーラーハウス型RI施設で225Ac使用時の空気中濃度や空間線量の測定、および臨床模擬試験などを行う計画です。

図1 トレーラーハウス型RI施設外観
開発の背景
TRTは、RIを体内に投与し、がんに集積したRIから放出される放射線によって、がんを殺す治療法です。従来は、ベータ線を放出するRIが利用されてきました。2021年には新規で2つのベータ線放出RIを標識したTRT製剤(ルタテラⓇ静注、ライアットMIBG-I131静注Ⓡ)が国内導入されました。さらに前立腺がんという患者数の多い疾患を対象とした177Lu8)標識TRT製剤PluvictoTMが米国で2022年3月承認され、国内でも臨床治験が開始される予定で、数年以内に国内でも承認されるものと期待されています。
また、近年は、放射線の飛ぶ距離が細胞数個分と短く、ベータ線を放出するRIに比べて当たった細胞を殺傷する能力が高い、アルファ線を放出する225Acで標識された薬剤のひとつが、他の治療が奏功しなかった転移性前立腺がんに対して非常に高い治療効果を示した報告がなされた(2016年、ドイツ・ハイデルベルク大)ことを契機に、以降、世界中で225Acのほかアスタチン211(211At)などのアルファ線治療薬の開発競争が激化しています。
225Ac標識薬剤を用いたTRT(225Ac-TRT)では、2022年現在、世界的にも薬事承認された薬剤は存在しませんが、量研では、日本で225Ac-TRTを実現するために、225Acの国産化に貢献する製造法の開発、中皮腫や滑膜肉腫という希少がんに対する225Ac-TRT薬剤の開発(2021年9月23日、2021年12月22日プレスリリース)を行なってきています。国内の他の研究機関や製薬企業も開発を精力的に進めており、225Ac-TRT薬剤の開発は順調に進んでいます。しかし、肝心の225Ac-TRTを実施するための場所を確保することが全国的に難しく、将来、本治療を実現する際の社会的課題になることが懸念されています。
日本にも、TRTができる施設はありますが、治療を最大限行うために、多くの場合、既に臨床使用が承認されているベータ線放出RI(131I9),90Y10),177Lu)とアルファ線放出RI(223Ra11))が使用許可量の上限まで充てられています。既存施設に手を加えず、225Acの使用許可を新たに得て使用するためには、すでに使用許可を得ているRIの使用量を減らさなければなりませんが、ベッド数の減少などから、例えば131Iを利用したTRT 治療を待つ甲状腺がんの患者の入院待ちが数ヶ月に及び、社会問題となっている中で、131Iの使用量を減らすことは、入院待ち期間のさらなる延長を生じ、治療を提供できない患者が出てきてしまう恐れもあります。
すでに実施中のTRT治療を維持した上で、新たに225Acを用いた治療も行うにはTRT施設の新設・増設が必要です。しかし、そのためには一般的に数億円の投資が必要とされており、全国的に新たな治療施設を数多く整備することは容易ではありません。日本で225Ac-TRTを実現する上で、治療施設の整備は解決しなければならない大きな課題と言えます。
225Ac-TRTを多くの患者に届けるため、量研は、低コストで製作・設置できるトレーラーハウス型RI施設を考案(2020年2月18日特許申請) し、今回その実証のため施設を設計・製作しました。
トレーラーハウス型RI施設について
アルファ線は飛ぶ距離が細胞数個分と短いので、その遮へいのために分厚いコンクリートの壁の建屋を建設する必要がありません。また、RI施設はその規模に応じた容量の換気装置などの設備を設置しなければなりませんが、トレーラーハウスの大きさは幅2.35m、長さ7m、高さ3.75mで、通常のRI施設と比べて非常に小さな空間なので、設備を縮小することが可能です。これらにより、従来のRI施設の新設・増設に比べて1/10程度のコストで製作することができました。
トレーラーハウスの内部には、225Ac標識薬剤を注射器に移し分ける際などに用いるドラフトチャンバー、緊急用除染シャワー、手洗い、換気装置、排水設備など、RI施設に必要な要件がすべてコンパクトに収納されています。その上で、患者が楽な姿勢で225Ac標識薬剤の投与を受けられるよう、病院で使用されているベッドも設置してあります。
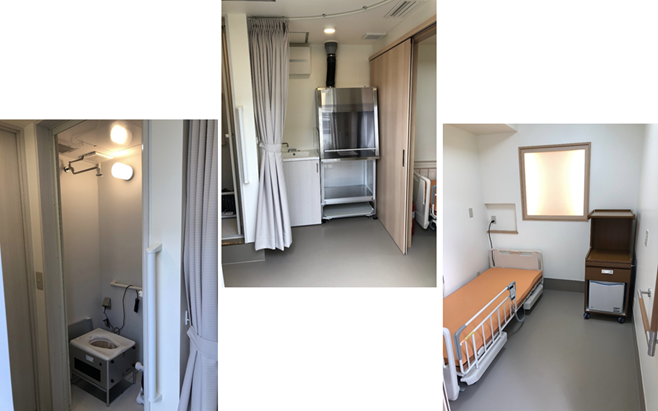
図2 トレーラーハウス内部
手洗い(左)、ドラフトチャンバー(中央)、投与時に使用するベッド(右)
開発の成果と今後の展望
世界初のトレーラーハウス型RI施設は、令和4年6月30日に、原子力規制委員会から放射線管理区域としての使用が許可されました。
本施設の製作費用は従来の施設の1/10程度と安価で、全国各地の病院への設置実現の可能性が拡がると考えられます。また、道路交通法に準拠した設計となっているため、牽引車を用いることによって、公道での移動が可能ということも大きな特長です。車体のサイズは駐車場の駐車スペースで乗用車3台分程度であり、駐車場に余裕のある病院なら、容易に設置可能です。
TRTを行う医師の転勤などで225Ac-TRT診療を中止することになった場合、RI施設を保持することは医療機関にとって大きな負担になります。一方、トレーラーハウスは、必要とする別の医療機関などに移動させることで負担を回避することができます。また、将来、災害があった場合に、被災地に移動させ、治療の継続という使い方も考えられます。これらのことから、トレーラーハウス型RI施設は、225Ac-TRTの普及に大いに貢献することが期待されます。
今後は、3年後のFirst-in-human試験の実施を目指し、臨床利用に向けた実証試験として、225Ac使用時の空気中濃度や空間線量などの測定や臨床模擬試験などを行う計画です。
用語解説
1)アルファ線
アルファ(α)線はヘリウム(He)原子核が非常に速いスピードで飛んでいるものです。物質中を通過する際、物質と相互作用し、例えば物質中の分子が持っている電子を弾き飛ばします(電離といいます)。α線(He原子核)は質量が大きく、物質中の分子などと衝突しやすいため、透過性が非常に低く、紙一枚で遮断することができる代わりに、物質中では短い通過距離で高いエネルギーを付与することから、分子などを密に電離することができます。α線を細胞に照射した場合、DNAに修復することが難しいキズ(DNA二重鎖切断)ができます。この現象は、α線ががん細胞を効果的に殺すことができる理由のひとつです。
2)標的アイソトープ治療( TRT: Targeted Radioisotope/Radionuclide Therapy )
エックス線やガンマ線に比べ強い細胞傷害能力を有する粒子放射線(アルファ線やベータ線)を放出する放射性同位体を用いた治療法。RI内用療法、核医学治療とも呼ばれます。がん細胞だけを標的とするように、がん細胞に集積する性質を持つ薬剤と結合させた放射性同位体を体内に注射し、体内から粒子放射線をがん細胞に照射し殺傷します。
3)アクチニウム225(225Ac)
半減期日、天然には存在しない(ネプツニウム)系列のアクチニウム同位体,アクチノイド元素の1つです。安定核(209)に達するまでに回のアルファ崩壊(原子核がα線を放出すること)と回のベータ崩壊(原子核がベータ線を放出すること)をするため,回の投与でも付与線量が大きくなる特徴があります。一連の崩壊過程で気体となるラドンを生じないことから、放射線安全管理の面でも大きなメリットがあり、放射線管理区域としてトレーラーハウス型を用いる今回の治療施設での使用に適した核種です。
アクチニウムは,水に溶けるとき3価の陽イオンになるため,多くの既存放射性医薬品で、応用されている配位子(キレーターとも言い、金属イオンを薬剤内に封鎖するために用いられる)が利用できる汎用性の高さも,アクチニウム創薬の魅力を上げる大きな要因となっています。
4)放射性同位体(RI: Radioisotope)
同一の原子番号であるものの、中性子の数が異なるものを同位体と呼びます。放射能をもつものを放射性同位体、放射能をもたないものを安定同位体と呼びます。
5)中皮腫
中皮腫は胸膜や腹膜をおおっている膜を構成している細胞のひとつ中皮細胞が悪性化したもので、発生部位は胸膜(80~85%)、腹膜(10~15%)、心膜(2%程度)、精巣鞘膜(1%以下)にみられます。発症原因は、欧米男性悪性中皮腫症例の78〜88%で、同女性例の23〜65%でアスベスト(石綿)ばく露との関連性が指摘されています。アスベストの取り扱い実態を見ると、輸入及び使用量は1970〜1980年代がピークでしたが、使用規制として含有率1%超について輸入・使用禁止となったのは1995年であり、全アスベストに対して原則使用禁止とされたのは2004年です。このような規制の遅れによる健康被害の救済に石綿健康被害救済法が制定されています。罹患率は日本国内で900人/年と低く、いわゆる希少がんですが、世界的な罹患率は先進国(日本を含む)で10,000人/年、中国は2,000人/年となっています。また世界全体で年間4万人が死亡しており、アスベスト使用禁止が遅れている先進国の一部と開発途上国は患者の増加が予測されています。
6)滑膜肉腫
滑膜肉腫は皮下組織や筋肉などの軟部組織から発生する悪性軟部肉腫の一つです。発症頻度は低い希少がんですが、若年層を中心に発症し、しばしば肺転移やリンパ節転移を伴う治療困難、予後の悪い疾患です。発症場所としては四肢が多いですが、全身に腫瘤として発症します。
7)ベータ線
ベータ(β)線は電子が非常に速いスピードで飛んでいる放射線の一種です。放射性同位体の原子核から放出されるβ線もα線同様にDNAにキズをつけますが、α線に比べると修復しやすいキズをつけると言われており、その細胞障害能力はα線に比べると低いとされています。
8)ルテチウム177(177Lu)
半減期日、ベータ崩壊をするランタノイド元素(原子番号のランタンに化学的性質のよく似た元素の総称。から番元素ルテチウムまでの元素を指す)。価の陽イオンになるため,既存のキレーターを利用した創薬を期待出来ます。
原子炉を利用して176ターゲットに中性子を付加し177(半減期時間)を得ると,その崩壊によって高純度の177が高効率で得られるほか,加速器を利用した製造も可能です。
国内では,神経内分泌腫瘍を対象とする放射性治療薬,ルタテラⓇ静注が2021年に承認されています。
9)ヨウ素131(131I)
半減期約8日、ヨウ素の放射性同位体のひとつで、崩壊に伴ってβ線とガンマ(γ)線を放出します。核分裂生成物として、原発事故の際に問題視される放射性同位体のひとつですが、医療や製薬分野では有用な放射性同位体として使用されています。ヨウ素は甲状腺ホルモンの原料で、体内に入ると甲状腺に集積する特徴があります。そのため、バセドウ病や甲状腺がんの治療に131Iが使用されています。また、褐色細胞腫やパラガングリオーマに対するがん治療薬として、2021年国内でも薬事承認されたライアットMIBG-I131静注Ⓡでは、131Iが標識されて利用されています。
10)イットリウム90(90Y)
半減期時間のベータ崩壊核種。核分裂生成物のひとつで、半減期が約年と比較的長い90から、ベータ崩壊によって得られます。90のベータ崩壊は常に起こっているため、徐々に蓄積していく90を容易な化学操作で必要なときに分離・使用可能とするジェネレータ製剤化がなされており、大量生産が可能となっています。
CD20抗原というタンパク質が発現している再発・難治性非ホジキンリンパ腫に対する世界初の放射性治療薬(ゼヴァリンⓇ)で利用され高い奏効率を示して以降、ヨウ素131と共に治療用ベータ線源としての地位を固めています。90Yはほとんどガンマ線を出さない特徴があるため,患者さんへ投与した後、介護者や公衆に対する二次的な被ばくを考慮する必要がない利点があります。
11)ラジウム223(223Ra)
半減期11日、安定核(207Pb)に落ち着くまでに4回のアルファ崩壊と2回のベータ崩壊をする4n+3(アクチニウム)系列の1つで,世界で初めて放射性医薬品として承認されたアルファ線放出薬剤(ゾーフィゴⓇ)です。
アルカリ土類元素が自然に持つ骨に蓄積しやすい特性を利用して、骨転移のある去勢抵抗性前立腺がんに利用されています。世界初のアルファ線治療薬はブロックバスターとなり,驚異的な売り上げのみならず,TRTが持つ優れた効果や治療可能性を社会に示しました。
223Raは,原子炉で226Ra(半減期1600年)に中性子を付加することで得られる227Ra(半減期42分)から、227Ac(半減期約22年)と227Th(半減期約19年)を経由して得られます。比較的長い寿命を持つ親核種2つに由来する生産方式のため,生産計画が立てやすく,安定した供給が可能となっています。