2021-09-03 理化学研究所
理化学研究所(理研)開拓研究本部伊藤ナノ医工学研究室の森島信裕特別嘱託研究員、創発物性科学研究センター創発生体工学材料研究チームの秋元淳研究員、伊藤嘉浩チームリーダー(開拓研究本部伊藤ナノ医工学研究室主任研究員)らの研究チームは、ヒトの血液中にある新型コロナウイルス(SARS-CoV-2)に対する抗体の量(抗体価)を、迅速に高感度で測定できる「ウイルス・マイクロアレイ[1]検出システム」を開発しました。
本研究成果により、今後重要となるSARS-CoV-2ワクチン接種の効果を、医療現場において効率的に精密検査することが可能になるものと期待できます。
現在、SARS-CoV-2の抗体検査は、免疫クロマトグラフィー法[2]による医療現場での定性的な簡易検査、もしくは検査センターへ血液サンプルを送付し、数日から1週間かけて行う定量的な精密検査しかありません。
今回、研究チームは、SARS-CoV-2を構成するヌクレオカプシドタンパク質[3]とスパイクタンパク質[4]をマイクロアレイチップ上に固定化し、それら複数のタンパク質に対する抗体量を完全自動で測定する、ウイルス・マイクロアレイ検出システムを開発しました。この検出システムでは、医療現場で採取した1滴の血液から30分程度で抗体量の定量測定が可能であり、感度は免疫クロマトグラフィー法の約500倍に上ります。
本研究成果は、日本化学会の欧文誌『Bulletin of the Chemical Society of Japan』のオンライン版(9月3日付)に掲載されました。
背景
新型コロナウイルス(SARS-CoV-2)のワクチン接種が世界中で進められています。ウイルスに感染しているか、もしくはワクチン接種により抗体ができたかどうかを調べる抗体検査は、医療現場で指先から採血し、免疫クロマトグラフィー法によって行われていますが、肉眼に基づく検査のため定性的であり、感度も十分でありません。一方、検査センターに検体を送って精密な定量検査を行うには、腕などからの採血によるより多くの血液量を要するだけでなく、相応の時間もかかります(図1)。
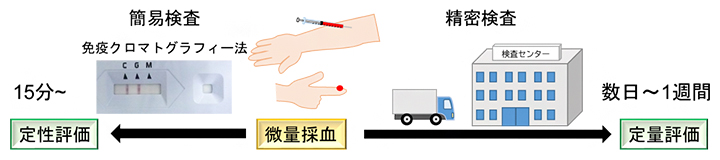
図1 現在の新型コロナウイルス抗体の検査法
現在のウイルス抗体検査には、医療現場における免疫クロマトグラフィー法による簡易検査、もしくは検査センターにおける精密検査がある。
伊藤嘉浩チームリーダーらは2003年に、生体由来の物質など有機化合物であれば何でも基板に固定化できる「何でも固定化法」を開発しました。その後、改良を重ね、2013年にはさまざまなウイルスを固定化して免疫感染履歴が測定できるシステムを発表しました注1)。さらに、2019年には41種類のアレルゲンを固定化したチップを用いた特異的IgE検査キット「ドロップスクリーン」の開発を報告し注2)、2020年2月以降、日本ケミファ株式会社から販売されています。
今回、このシステムを用いて、SARS-CoV-2を構成するいくつかのタンパク質を基板上にマイクロアレイ固定化し、それらに対する抗体があるかどうかを自動的に測定できるシステムの開発を目指しました。
注1)2013年12月19日プレスリリース「免疫履歴がその場で分かるマイクロアレイ診断システムを開発」
注2)2019年10月23日プレスリリース「「血液1滴からその場で41種類のアレルギー検査ができるシステムの開発」
研究手法と成果
研究チームは、ヒトの血液中にあるSARS-CoV-2に対する抗体の量(抗体価)を迅速に測定できる「ウイルス・マイクロアレイ検出システム」を開発しました。この手法では、まず、光反応性高分子をチップ(基板)上に被覆し、そこへウイルスに含まれるタンパク質を含む試料液をスポット状に吐き出します。乾燥後、紫外線を照射すると、光架橋[5]によりタンパク質がチップに固定化されたマイクロアレイチップが作製されます(図2)。
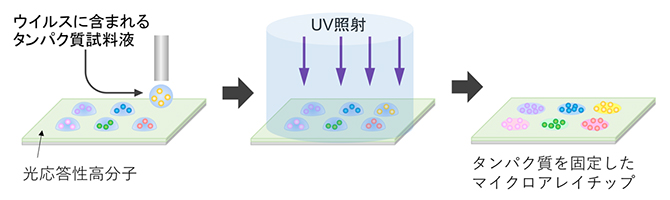
図2 光架橋によるタンパク質固定化マイクロアレイチップ作製法
光反応性高分子を被覆したチップに、ウイルスに含まれるタンパク質試料液を吐き出し、乾燥後に紫外線を照射すると、光架橋によりタンパク質がチップに固定されたマイクロアレイチップが作製できる。
この方法を用いて、SARS-CoV-2の内部にあるヌクレオカプシドタンパク質、表面にあるスパイクタンパク質の三つのセグメント(S1、S2、RBD)をそれぞれ固定化したマイクロアレイチップを作製しました(図3左)。このマイクロアレイチップを利用したウイルス・マイクロアレイ検出システムでは、検体血清中に各ウイルスタンパク質に対する抗体があると結合して発光し、その発光像をCCDカメラで撮影することで、抗体の多寡を判定します(図3右)。1滴(20マイクロリットル)の血液により、約30分で抗体量の測定が可能であり、感度は免疫クロマトグラフィー法の約500倍です。また、この検出システムでは、ヒト血清をチップに滴下してスイッチを押すだけで、反応、洗浄、検出という一連の工程を完全自動で行うことができます。
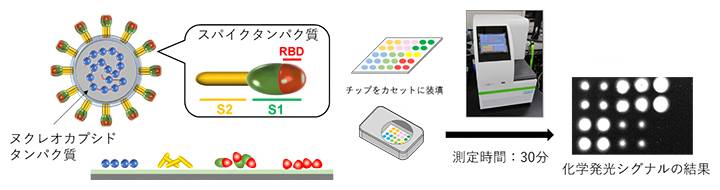
図3 SARS-CoV-2タンパク質を固定化したマイクロアレイチップによる抗体検出システム
左)SARS-CoV-2は主にヌクレオカプシドタンパク質(青)とスパイクタンパク質から構成される。スパイクタンパク質はS1領域とS2領域(黄)からなり、S1領域には、RBD(レセプター結合ドメイン、赤)が含まれる。
右)左の4種類のタンパク質をそれぞれ固定したマイクロチップをカセットに装填する。検体血清中にウイルスタンパク質に対する抗体があると結合する。結合した抗体を酵素修飾抗体で検出して化学発光させ、その化学発光シグナルをCCDカメラで撮影し、発光量を定量することで、それぞれの抗体の多寡を測定する。
図4に、マイクロアレイチップによるSARS-CoV-2タンパク質に対するウサギの抗体(免疫グロブリンG、IgG[6])での検出確認と、感染回復患者4人の抗体(IgG)の検出例を示します。抗S2-ウサギIgGはS2が固定化されたスポットに、抗RBD-ウサギIgGはRBDとRBDを含むS1のスポットに、各々結合しました。これにより、固定化されたタンパク質が特異的に抗体を認識できることを確認し、その後、感染回復患者のIgGを定量しました。

図4 マイクロアレイチップによるウサギIgGの検出確認と感染回復患者検体のIgG定量
左)4種類のタンパク質を固定したマイクロチップ。
中)特異的ウサギIgGを用いた化学発光の検出例。
右)感染回復患者4人の血清検体中のヌクレオカプシドタンパク質に対するヒトIgGの定量例。
さらに、2019年末から流行しているSARS-CoV-2のスパイクタンパク質のRBDへの抗体が、2003年に流行したSARS(重症急性呼吸器症候群)のコロナウイルス(SARS-CoV)のスパイクタンパク質のRBDを認識しないことが最近報告されましたが注3)、これは本検出システムを用いても確認できました。この結果は、両RBDのアミノ酸配列の違いは全体の約30%で、それにより免疫応答に大きな違いが現れたことを示しています。本検出システムは、今後、ワクチン接種で得られる抗体がSARS-CoV-2変異型[7](30%の中のアミノ酸の一部が変異)に対してどの程度効果を持つかを見極める手段になると考えられます。
注3)R. R. De Assis, A. Jain, R. Nakajima, A. Jasinskas, J. Felgner, J. M. Obiero, P. J. Norris, M. Stone, G. Simmons, A. Bagri, Nat. Commun. 2021, 12, 1.
今後の期待
これまでに研究チームは、「何でも固定化法」を用いて、多種類のアレルゲン、自己免疫抗原、感染症ウイルスをマイクロアレイの基板に固定したチップでアレルギー、自己免疫疾患、感染症履歴を、完全に自動で「その場」検査できるシステムを実現し、今回、それを新型コロナウイルス抗体検出システムへ応用することに成功しました。
本検出システムが実用化されれば、医療現場での精密検査が可能になります。ワクチン接種の必要性などをその場で容易に判断できるとともに、将来のパンデミックに備えた疫学調査も容易に行えるようになるものと期待できます。
補足説明
1.マイクロアレイ
複数の標的分子を1枚のチップ上に微小スポットとして固定化したもので、固定化するものによって、DNAチップやプロテインチップとも呼ばれる。
2.免疫クロマトグラフィー法
簡便かつ迅速に分析対象物の有無を調べる抗原・抗体検査法。検体をろ紙の上に滴下するだけで、10~15分程度で検査結果を定性的に判定できる。
3.ヌクレオカプシドタンパク質
ウイルスの内部にあるタンパク質で、遺伝子を包む働きをする。
4.スパイクタンパク質
ウイルスの表面にあるタンパク質で、感染する際に細胞表面にある受容体に結合する。
5.光架橋
光反応性の官能基が光照射によって活性化され、近くの有機物と反応して高分子同士を橋架けすること。
6.免疫グロブリンG(IgG)
ヒトの抗体は大きく分けてIgM、IgD、IgG、IgA、IgEの5種類がある。IgGは血液中で最も多い抗体であり、70~75%を占める。白血球やマクロファージによる抗原・抗体複合体の認識に重要で、危険因子を無毒化する。
7.変異型
ウイルスが増殖する過程では一定の頻度で遺伝情報の複製に誤りが生じ、変異型が生まれる。ヒトの細胞へ侵入する際に重要なスパイクタンパク質の一部のアミノ酸が変化すると、細胞への侵入効率が上がったり、ヒトの免疫系の監視から逃れやすくなる場合があり、感染性の上昇やワクチンの有効性低下につながる可能性が指摘されている。
研究チーム
理化学研究所
開拓研究本部 伊藤ナノ医工学研究室
特別嘱託研究員 森島 信裕(もりしま のぶひろ)
専任研究委員 礒島 隆史(いそしま たかし)
創発物性科学研究センター 創発生体工学材料研究チーム
人材派遣 柏木 裕晴(かしわぎ ひろはる)
研究員 秋元 淳(あきもと じゅん)
研究パートタイマーⅠ 小布 施聖(おぶせ せい)
チームリーダー 伊藤 嘉浩 (いとう よしひろ)
(開拓研究本部 伊藤ナノ医工学研究室 主任研究員)
研究支援
本研究は、埼玉県AIを活用した機器等・実証補助金(令和2年度)「AI機能を搭載した多項目バイオチップ検査システムの開発(研究代表者:秋元淳)」による支援を受けて行われました。
原論文情報
Hiroharu Kashiwagi, Nobuhiro Morishima, Sei Obuse, Takashi Isoshima, Jun Akimoto, and Yoshihiro Ito, “SARS-CoV-2 proteins microarray by photoimmobilization for serodiagnosis of the antibodies”, Bulletin of the Chemical Society of Japan, 10.1246/bcsj.20210215
発表者
理化学研究所
開拓研究本部 伊藤ナノ医工学研究室
特別嘱託研究員 森島 信裕(もりしま のぶひろ)
創発物性科学研究センター 創発生体工学材料研究チーム
研究員 秋元 淳(あきもと じゅん)
チームリーダー 伊藤 嘉浩(いとう よしひろ)
(開拓研究本部 伊藤ナノ医工学研究室 主任研究員)
報道担当
理化学研究所 広報室 報道担当