世界の放射線防護基準の基礎となるデータの獲得が可能に
2021-06-24 量子科学技術研究開発機構
発表のポイント
- 「被ばくに起因するがん」と「自然に発生したがん」を識別できる特殊なマウスを使う解析法で、中性子線の被ばくによる発がん影響を正確に評価することに成功
- 低線量の中性子線は、線量に依存してがんの発生率を増加させ、同じ線量のガンマ線よりがんの発生率が高くなるデータを、世界で初めて取得
- 本法を活用して、低線量被ばくによる発がん影響の研究を更に進め、より客観的・定量的なデータを積み重ねることで、世界の放射線防護基準の策定に役立つ基礎的知見となることが期待される
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子生命・医学部門放射線医学研究所放射線影響研究部の柿沼志津子部長、鶴岡千鶴主任研究員らは、量研が作り出した「被ばくに起因するがん」と「自然に発生したがん」を見分けることができる特殊なモデルマウスを使い、発がんにおける中性子線の影響を正確に評価する方法を開発しました。さらに、中性子線によるがんの発生リスクが同じ線量のガンマ線に比べて高くなることを、データとして示すことに世界で初めて成功しました。この成果は、放射線防護の基準を実測値に基づいて検討することを可能にするもので、基準の確からしさをより高めることに貢献します。
私たちの生活の中では、様々な要因ががんの発生に影響を与えます。放射線の被ばくもその要因の一つで、中性子線も含まれます。中性子線は、一般に原子炉や加速器で作り出し、研究や産業に利用されていますが、宇宙から来た放射線が大気中の原子に作用したときや一部の放射線治療を行ったときに二次的に発生するため、生活の中で被ばくする可能性がゼロではありません。
中性子線の被ばくががんのリスクを増加させることは他の放射線と同じですが、物理的に同じ量を被ばくした場合の発がん影響の強さは、他の放射線に比べて中性子線の方が大きくなることが知られています。しかし、これまで、がんを発生させる様々な要因の中から中性子線の被ばくが与える影響だけを取りだして、正しく評価する方法がなかったことから、発生したがんの中で中性子線の被ばくによる影響を正確に評価できているかは不確実でした。
そこで本研究では、低線量の中性子線による発がんリスクを正しく評価するために、量研が作り出した「被ばくに起因するがん」と「自然に発生したがん」を、遺伝子を調べることで区別できる特殊なモデルマウス(Ptch1遺伝子ヘテロ欠損マウス)に中性子線を照射して、「被ばくに起因するがん」の発生率を求めました。この方法により解析した結果、低線量の中性子線は線量に依存してがんの発生率が増加し、同じ線量であればガンマ線より発生率が高くなり、発がんリスクも高くなることを定量的に示すことに、世界で初めて成功しました。
量研が確立した方法により、様々な放射線の被ばくについてその影響を正しく評価する研究が進められるようになることから、客観性のある定量的なデータを着実に蓄積していくことで、世界の放射線防護基準の策定に役立つ基礎的知見となることが期待されます。
この成果は、放射線生物研究分野の論文が数多く発表されている米国の放射線影響学会誌「Radiation Research」に2021年5月27日付でオンライン掲載されました。この研究は、文部科学省科学研究費補助金(JP24700956)の支援を一部受けています。
研究開発の背景と目的
私たちは生活の中で放射線に被ばくをしています。例えば、がんの放射線治療による被ばくや、宇宙からの放射線が大気中の原子に作用したときに発生する放射線からの被ばく、などがあげられます。被ばくは、私達の健康に「発がん」などの影響をおよぼします。
放射線にはいくつもの種類があり、よく知られているエックス線以外にも、重粒子線や中性子線、陽子線などがあります。なかでも中性子線による被ばくは生体への影響が大きいことが知られています。中性子線は、放射線治療の時に二次的に発生することがあり、治療照射時に正常組織が少量の中性子線に被ばくします。このため放射線治療のあとには、この二次的な被ばくによって起こるがんのリスクにも注意する必要があります。そのため、中性子線被ばくによる発がん影響を正確に評価することが重要になります。
がんは、被ばく以外にもさまざまな要因により発生するので、被ばく後に発生したがんは、被ばくが原因のものだけでなく、他の要因によるものも含んでいます。そのため、要因を区別せずに被ばく後に発生したがんを調べるこれまでの方法では、被ばくによる発がん影響を正確に評価しているかは不確実でした(図1)。
そこで私達は、被ばく後に発生したがんを、中性子線被ばくが原因で生じたものか、それ以外の要因によって発生したものか区別できる方法があれば、被ばくに起因する発がんのリスクのみを取り出して議論することが可能になると考え、量研がこれまでに作り出したマウスの中で「Ptch1遺伝子ヘテロ欠損マウス」という実験用マウスに着目しました。
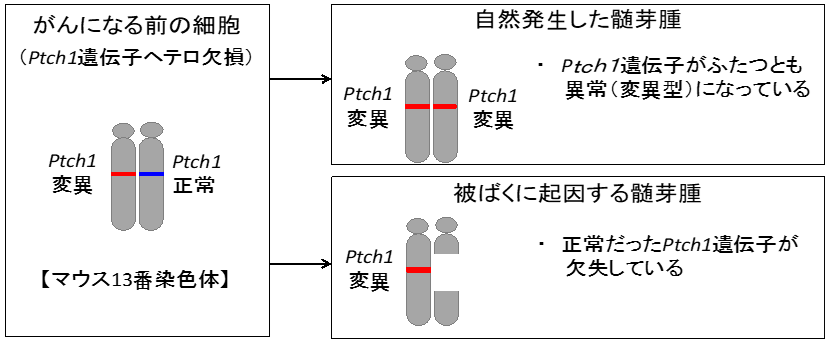
Ptch1遺伝子ヘテロ欠損マウスは、小脳のがんである髄芽腫を自然発生します。また出生前後に被ばくをすると髄芽腫の発生頻度がさらに増加します。我々はこれまでに、被ばくに起因する髄芽腫と自然に発生した髄芽腫では、がんの原因遺伝子(Ptch1遺伝子)の状態が異なっており、それを遺伝子解析により区別することができることを、エックス線を用いた研究より明らかにしています(図2)。
今回の研究では、この特殊な発がんモデルマウスを用いて、中性子線の発がんリスクを被ばくに起因するがんのみで正確に評価することを目的としました。
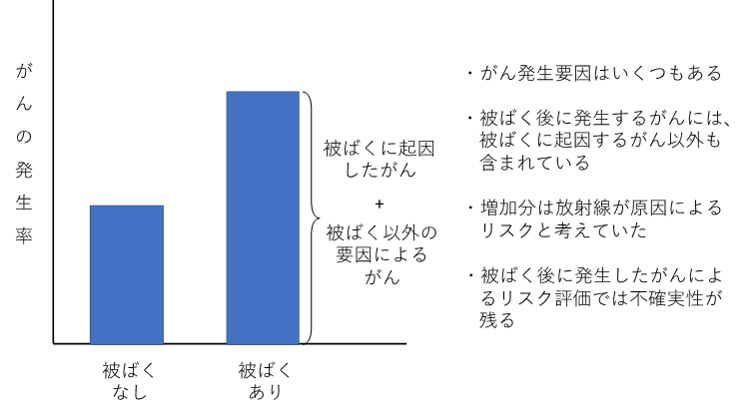
図1:がんの発生要因イメージ
図2:「自然に発生したがん(髄芽腫)」と「被ばくに起因するがん(髄芽腫)」の見分け方
研究の手法と成果
Ptch1遺伝子ヘテロ欠損マウスに、0.025から0.5 Gyの中性子線もしくはガンマ線を照射した後、500日間飼育し、その間にどれくらいがん(髄芽腫)が発生したかを調べました。
その結果、要因を特定しない場合は、ガンマ線においては線量増加にともなう発がん率の増加は認められず、ガンマ線の影響を正確に示すことができませんでした。一方、中性子線の影響は大きく、線量増加にともなう発がん率の増加傾向が認められました。(図3:黒点線)
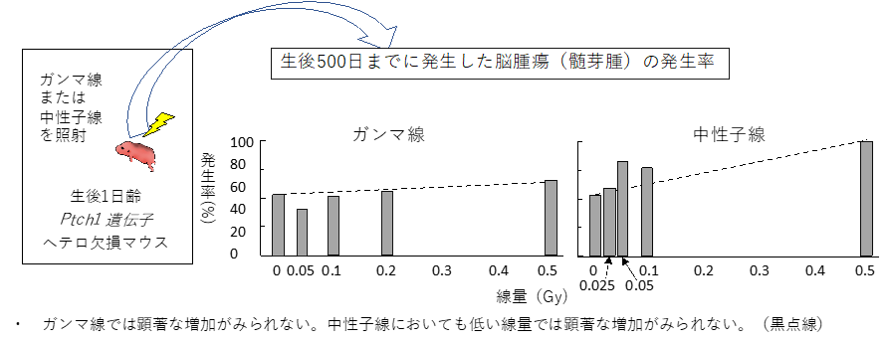
図3:実験方法、線種・線量とがん(髄芽腫)発生率との関係
そこで、図2に示した見分け方で、発生したがんを「被ばくに起因した髄芽腫」と「自然に発生した髄芽腫」に分け、被ばくに起因する髄芽腫が発生した時期(生後の日数)と発生した頻度からハザード比(照射をした時にどのくらい発がんリスクが高くなるかを数値化したもの。照射していない同じ時期のマウスでの発生頻度を1としたときの数値として表す。)を求めました(図4)。その結果、0.5 Gy以下という低線量のガンマ線、中性子線のいずれでも、線量とハザード比との間に、高い比例関係があることが実証されました。さらに、線種による違い、すなわち、ガンマ線より中性子線の発がん率が有意に高いことを見い出しました。
このような低線量域での放射線による発がんへの影響、特に、生体への影響が大きいと言われている中性子線について、他の要因による影響を排除した上で、定量的に明らかにしたのは、この研究が世界で初めてであり、量研が作り出した特殊なモデルマウス(Ptch1遺伝子ヘテロ欠損マウス)を用いることにより、初めてなし得た成果です。
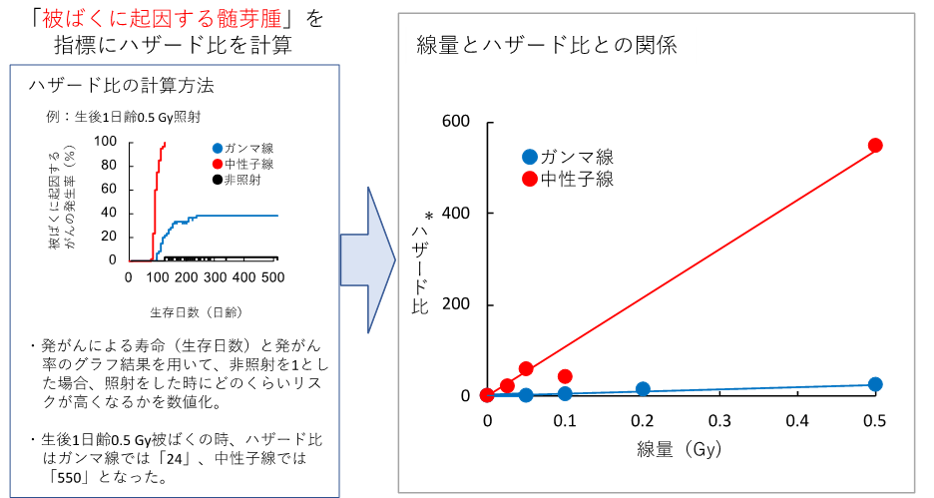
図4:「被ばくに起因した髄芽腫」の線量とリスクの関係
今後の展開
今後、中性子線以外の放射線(例えば、重粒子線や陽子線)や照射方法(連続照射など)における発がん影響を、今回用いた「被ばくに起因するがん」と「自然に発生したがん」を識別できる特殊なモデルマウスを用いて明らかにしていくことにより、より正確な発がんリスク推定が可能となります。また、今回の報告した脳腫瘍(髄芽腫)だけではなく他の臓器に発生するがんを調べることのできるモデルマウスを用いるなど、さまざまな条件での発がんリスクを明らかにすることにより、将来的に放射線防護の基準を考える基礎となるデータ提供に貢献できると期待されます。
用語解説
1)Ptch1遺伝子ヘテロ欠損マウス
ヒトの疾患のモデルマウスとして1998年に報告されました。Ptch1遺伝子は組織の発生に関与する分子のひとつで小脳の発達過程で重要なタンパクを生成します。このモデルマウスはPtch1遺伝子がもともと片方に変異が生じており(図2左側:ヘテロ欠損)、さらに残り(正常側)の遺伝子が欠失することによって髄芽腫(小脳のがん)を発症します。特に、量研で確立したC3B6F1系統のPtch1 遺伝子ヘテロ欠損マウスは髄芽腫になりやすく、遺伝子解析により「被ばくに起因する髄芽腫」を区別することで低線量域における被ばくの影響を正確に評価することができるため、今回の研究が可能になりました。
2)髄芽腫
主に小児の小脳に発生する悪性脳腫瘍。
3)ハザード比
ハザード比は統計学の用語で、臨床試験などで使用する相対的な危険度を客観的に比較する方法です。非照射のマウス(照射以外の要因で発がんしたマウス)を基準に、照射がマウスの発がんにどれくらいの影響を与えるか、その影響の度合いを数値化することで、定量的な議論が可能になります。ハザード比が1であれば、放射線を被ばくしたとしても、その被ばくは発がんへのリスクとならないことを意味します。ハザード比が1よりも大きくなれば、数字の大きさに比例して、照射によるがんのリスクが大きくなることを意味します。
High relative biological effectiveness of 2 MeV fast neutrons for induction of medulloblastoma in Ptch1+/– mice with radiation-specific deletion on chromosome 13
Chizuru Tsuruoka1, Mutsumi Kaminishi1, Mayumi Shinagawa1, Yi Shang1, Yoshiko Amasaki1, Yoshiya Shimada2 and Shizuko Kakinuma1,
1 Department of Radiation Effects Research, National Institute of Radiological Sciences, National Institutes for Quantum and Radiological Science and Technology;
2 Institute for Environmental Science