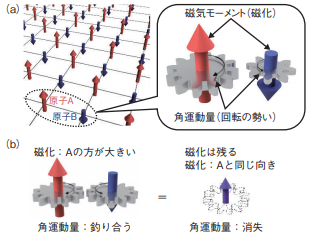
『原子力機構の研究開発成果2020-21』P.60
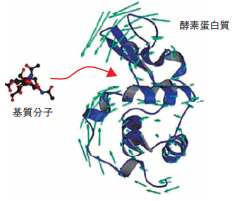
図5-11 機能発現に伴う蛋白質構造の動き
酵素蛋白質は基質分子と反応するために(→)、分子の形を変化させる必要があります。このような分子の構造揺らぎは、中性子非弾性散乱実験で見ることができます。
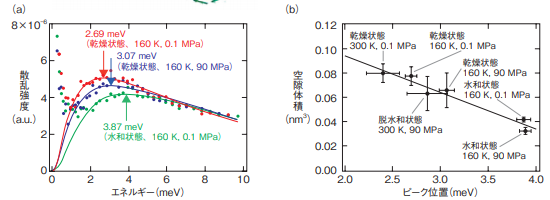
図5-12 蛋白質(核酸分解酵素)の(a)様々な環境でのボソンピーク、(b)ボソンピークのピーク位置と蛋白質構造の空隙の関係
(a)矢印で示したボソンピークの位置(矢印で示した位置のピークエネルギー)は、水和・温度・圧力で変化します。(b)そしてこのピーク位置は、蛋白質内部の空隙体積と相関があることが分かります。
細胞内の代謝反応から洗剤に含まれる酵素により触媒される化学反応に至るまで、様々な酵素反応において蛋白質が中心的な役割を果たします。従来は、蛋白質の機能解明にはその立体構造を知り、鍵と鍵穴のように、特定の相手(基質)の形との相補性が重要であると考えられてきました。しかし、現実の蛋白質の構造は柔らかく、実際には、周囲の環境に応じて構造が揺らいでおり、そのような構造の揺らぎが基質分子との結合に必要であることが分かっています(図 5-11)。
中性子非弾性散乱法を使うと、蛋白質の機能発現に重要とされる THz 領域(1 THz=4.1 meV)のエネルギー領域の構造揺らぎを定量的にかつ精度良く測定できます。特にこのエネルギー領域で観測されるボソンピークと呼ばれるピークは、機能に直結する分子の構造揺らぎであることが理論的に示されています。そして、「蛋白質のボソンピークと立体構造との関係性」について構造科学的な視点から解明することが、蛋白質の構造揺らぎから生命反応等を予測するための普遍的原理を導出するという蛋白質科学の重要な課題となっています。
本研究では、まず蛋白質(核酸分解酵素)のボソンピークの水和・温度・圧力効果を中性子非弾性散乱によって調べました(図 5-12(a))。その結果、ボソンピークのピーク位置が、水和・冷却・加圧によって高エネルギー側にシフトすることが分かりました。次に、このようなピークシフトと蛋白質の構造との関係性を調べるために、分子シミュレーションによって蛋白質内に存在する空洞の体積の計算をしました。その結果、ボソンピークの位置と空隙体積に相関関係があることが分かりました(図 5-12(b))。これら一連の研究により、蛋白質の機能発現に重要な構造の“揺らぎ”が、周囲の環境によって変化する蛋白質の構造の“内部の原子の詰まり具合”と関係することが分かりました。今回見いだされた蛋白質の体積特性と構造揺らぎとの間で相関があることを活用すれば、例えば構造未知の蛋白質であっても構造揺らぎの測定をすれば、立体構造情報の手掛かりを得ることができます。
本研究では、中性子非弾性散乱実験と分子シミュレーションの両方を駆使することで、これまで実験だけでは難しかった分子構造と対応付けた蛋白質の構造揺らぎの特徴の解明に成功しました。これは、これまで理論研究で予測されてきた蛋白質の構造揺らぎの研究の重要性を実証する成果です。今後このような研究に中性子非弾性散乱がますます有力な実験手段となることが期待されます。
本研究は、日本学術振興会科学研究費補助金挑戦的研究(萌芽)(No.18K18828)「中性子非弾性散乱によるアモルファス界面の分子選択的なフォノンスペクトロスコピー」の助成を受けたものです。(中川 洋)
●参考文献
Nakagawa, H. et al., Universality and Structural Implications of the Boson Peak in Proteins, Biophysical Journal, vol.117, issue 2, 2019, p.229–238.