2020-06-26 理化学研究所
理化学研究所(理研)放射光科学研究センター利用技術開拓研究部門生体機構研究グループの高場圭章特別研究員、米倉功治グループディレクター、XFEL研究開発部門ビームライン研究開発グループイメージング開発チームの眞木さおり研究員の研究チームは、生体分子、薬剤、高分子材料などの微小な結晶から電子線回折[1]を半自動で測定するシステムを開発しました。
本研究成果は、創薬や新しい素材の開発に本格利用されると期待できます。
微小結晶や薄い結晶から分子の立体構造を調べる場合、X線結晶構造解析[2]では、大型放射光施設「SPring-8[3]」やX線自由電子レーザー施設「SACLA[4]」の強力なX線を用いても有用な情報を得られないことがあります。一方、電子線はX線より十万倍も強く試料に散乱されるため、多くの場合、微小で薄い結晶からでも高い空間分解能[5]で回折点を観測できます。この特徴を利用した電子線三次元結晶構造解析法[6]は、低・中分子量の有機化合物からタンパク質などの生体高分子の構造解析に大きな可能性を秘めた技術です。しかし、電子顕微鏡を常時操作しながら測定を行うため、時間と手間がかかるという課題がありました。
今回、研究チームはクライオ電子顕微鏡[7]を用いて、多数の微小で薄い結晶から電子線回折を半自動で測定するシステムを開発し、これまで難しかった分子においても高効率かつ高精度の構造決定を可能にしました。
本研究は、科学雑誌『Journal of Structural Biology』のオンライン版(6月13日付)に掲載されました。
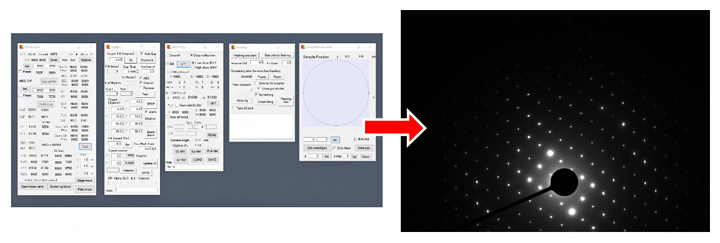
開発したシステム(左)とそれを用いて測定した機能性材料の回折パターン(右)
背景
生体分子、薬剤、高分子材料などの機能を明らかにするためには、立体構造の解明が重要です。分子の立体構造の決定には、主にX線結晶構造解析やクライオ電子顕微鏡法が用いられます。
X線結晶構造解析では、試料の結晶に「SPring-8」などの放射光施設で得られる強力なX線を照射し、得られた回折パターンから分子構造を決定します。クライオ電子顕微鏡を用いた単粒子解析[8]では、急速凍結したタンパク質溶液の電子顕微鏡像から、コンピュータで分子の立体構造を再構成します。この手法では、手間のかかる試料の結晶化を必要とせず、生理的な溶液環境下のタンパク質の立体構造を明らかにできるという利点があります。近年の急速な技術革新によって空間分解能が格段に改善されたことから、2017年のノーベル化学賞の受賞対象となりました。しかし、得られる像のコントラストが悪いため、分子量がある程度大きな試料にしか適用できないという課題があります。
このような背景から、分子量がそれほど大きくないタンパク質や有機化合物の構造を解析するには、試料を結晶化する必要があることに変わりはありません。ところが、結晶作製は難しい場合が多く、微小な結晶やごく薄い結晶しか得られないことがよくあります。このような結晶はX線回折[1]の測定には使用できません。一方、電子線は、X線より10万倍も強く試料に散乱されるため、結晶性が良ければ、微小で薄い結晶からでも、高い空間分解能で回折点を観測できます。
この特徴を利用した「電子線三次元結晶構造解析」(3D ED /マイクロEDとも呼ばれる)は、低分子量のタンパク質や有機化合物などの構造解析に大きな可能性を秘めていることから、2018年Science誌のBreakthrough of the yearの一つに選ばれるなど、注目を集めています。米倉功治グループディレクターは、この解析法の技術開発に初期の段階から寄与してきました注1-2)。しかし、電子顕微鏡を常時操作しながらデータ測定を進めなければならないため、時間と手間がかかるという難点がありました。
注1)2015年2月23日プレスリリース「微小で薄いタンパク質結晶の電子線構造解析」
注2)2016年8月25日プレスリリース「生体分子の電荷分布の高精度解析法」
研究手法と成果
近年、データの自動測定の重要性が増し、特に多数の画像データを取得するクライオ電子顕微鏡の単粒子解析では、必須の技術です。今回、研究チームは、日本電子株式会社(JEOL)の高性能のクライオ電子顕微鏡CRYO ARM 300および汎用の電子顕微鏡を用いて、電子線回折の自動測定システムの開発に取り組みました。
研究チームは2019年にクライオ電子顕微鏡CRYO ARM 300を用いて、世界最高精度の構造解析を実現しました注3)。まず、その際に開発した電子顕微鏡のデータ測定支援と回折データ測定のための統合プログラムParallEM(図1)を自動測定用に高度化しました。そして、単粒子解析の画像データの自動測定ソフトウェアとして定評のあるSerialEMと組み合わせ、効率の良いシステムを完成させました(図2)。
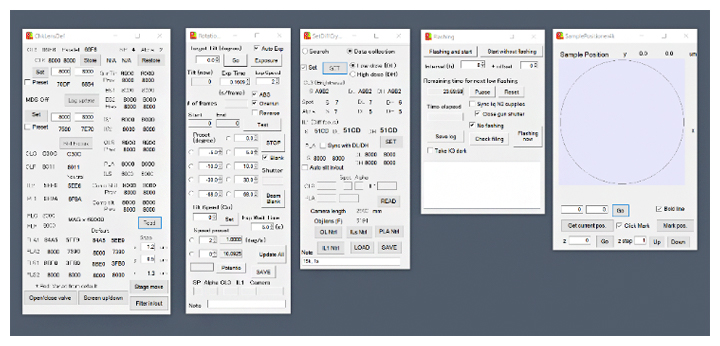
図1 電子顕微鏡のデータ測定支援と回折データ測定のための統合プログラムParallEM
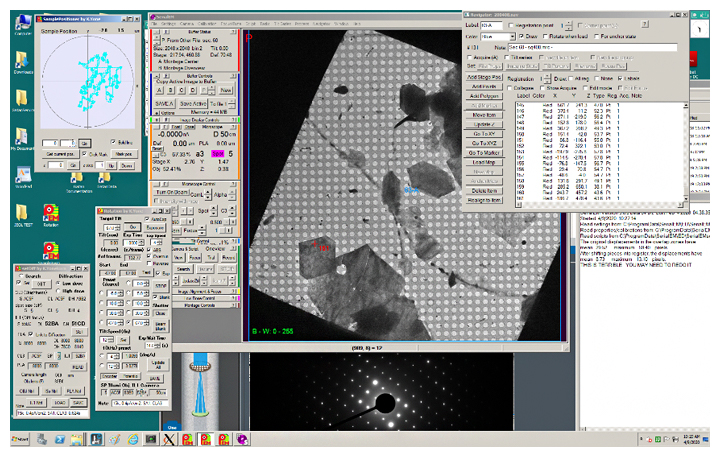
図2 開発したシステムを使った電子線回折の自動測定
結晶の電子線回折データから分子の立体構造を得るには、三次元空間に分布する回折データを、結晶を回転させることで漏れなく取得する必要があります。しかし多くの場合、個々の結晶からは限られた範囲のデータしか取得できません。また、結晶ごとの品質の違い、低い対称性の結晶、微小結晶からの信号は相対的に低いことなど解析を難しくする問題もあります。そこで、多くの結晶データからの情報を集めて補うことが、高精度での解析に重要になります。
今回開発したシステムにより、多くの微小結晶から回折データの回転測定を精度良く半自動で行うことが可能になりました(図3)。試料に合わせた最適な測定条件の調整も容易で、データごとに測定条件が記録に残されます。また、長時間測定に必要な液体窒素の供給や電子銃の定期的な活性化にも対応しており、撮影開始後は、人が管理することなく完全に自動で撮影を続けることができます。そして、本システムを用いて、多くの重要な機能を持つ分子の構造を高効率かつ高精度で解析することに成功しました。

図3 機能性材料の微小結晶からの電子線回折パターン
1オングストローム(Å、1Åは100億分の1メートル)の分解能を超える回折点が観察できる。
注3)2019年5月21日プレスリリース「タンパク質やその複合体の高分解能・高精度解析に成功」
今後の期待
本研究では、微小で薄い多数の結晶からクライオ電子顕微鏡で電子線回折を半自動で測定するシステムを開発しました。これまで難しかった重要な分子の構造を高効率かつ高精度で解析できるようになったことで、今後、創薬や新しい素材開発などに本格利用されると期待できます。
また、本システムは汎用的な電子顕微鏡でも利用できることから、多くの大学、共用施設、企業などで利用できるように、開発したプログラムと利用手順を公開しました。より高い精度の解析が必要な場合は、放射光科学研究センターの高性能機器を用いて精密構造を取得することが可能となっています。
補足説明
1.電子線回折、X線回折
電子線やX線が結晶性の試料に散乱され、干渉して回折を示す現象のこと。分子の並びを反映した規則的な回折点の並びなどの特徴的なパターンが観測される。
2.X線結晶構造解析
生体分子の立体構造を決めるのに使われる一般的な手法。精製したタンパク質試料に塩、添加化合物の種類、濃度、pH、温度などの条件を探索して、分子が規則正しく並んだ結晶を作製する。得られた結晶にSPring-8などの放射光施設の強力なX線を照射し、散乱されて得られた回折パターンの強度情報から、立体構造を計算し、原子モデルを構築する。この手法では、数マイクロメートル~百マイクロメートル(μm、1μmは100万分の1メートル)サイズの良質な結晶を必要とするが、結晶化が難しい試料も多い。
3.SPring-8
理研が所有する、兵庫県の播磨科学公園都市にある世界最高性能の大型放射光施設。SPring-8の名前はSuper Photon ring-8GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細く強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得られるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。タンパク質の結晶構造解析の分野でも、大きな成果を上げている。
4.SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本で初めてのX線領域のパルスレーザー(XFEL)施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。2011年6月に最初のX線レーザーを発振、2012年3月から供用を開始した。
5.空間分解能
どのくらい細かくものを「見る」ことができるかの指標。空間分解能の値が小さい(分解能が高い)ほど、物質をより精細に観測できる。原子の大きさは、1オングストローム(Å、1Åは100億分の1メートル)程度で、個々の原子の解像には、1Å程度の空間分解能が必要になる。
6.電子線三次元結晶構造解析法
試料の微小で薄い結晶に電子線を照射して、その回折パターンから三次元の立体構造を決定する手法。これまで、電子線では、タンパク質が二次元に一層並んだ二次元結晶を対象としており、三次元の結晶への応用は難しかった。
7.クライオ電子顕微鏡
タンパク質などの生体分子を、水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料は氷中に保持でき、また、冷却することで電子線の照射による損傷を減らせる。
8.単粒子解析
電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法。結晶を作製しなくても分子の構造が得られる。技術革新により、理想的な試料ではX線結晶構造解析に勝る空間分解能で構造が決定できるようになった。2017年のノーベル化学賞の受賞者の一人、Joachim Frankらにより単粒子解析法の基礎が作られた。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金挑戦的萌芽研究「電子線結晶構造解析によるクーロンポテンシャルの可視化(研究代表者:米倉功治)」、同基盤研究(B)「イオン駆動力供給体の電子線とX線による作動機構の解明(研究代表者:米倉功治)」、日本医療研究開発機構(AMED) 医療研究開発革新基盤創成事業(CiCLE)「タンパク質構造解析のハイスループット化へ向けた装置開発」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「実験・計算・データ科学融合による塗布型電子材料の開発」などの支援を受けて行われました。
原論文情報
Kiyofumi Takaba, Saori Maki-Yonekura, and Koji Yonekura, “Collecting large datasets of rotational electron diffraction with ParallEM and SerialEM”, Journal of Structural Biology, 10.1016/j.jsb.2020.107549![]()
発表者
理化学研究所
放射光科学研究センター 利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治(よねくら こうじ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 理研-JEOL連携センター 次世代電子顕微鏡開発連携ユニット ユニットリーダー)
特別研究員 高場 圭章(たかば きよふみ)
XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
研究員 眞木 さおり(まき さおり)
報道担当
理化学研究所 広報室 報道担当



