「治す」と「みる」2つの機能をもつ光温熱材として、がん光温熱療法への応用に期待
2020-06-08 量子科学技術研究開発機構
発表のポイント
- 近赤外レーザー1)照射で効率的に発熱し、生体への安全性の高い光温熱材として黒リン(以下、BP)2) と銅(以下、Cu2+)からなるナノ薬剤3)を開発した。
- このナノ薬剤を悪性黒色腫4)モデルマウスに投与して近赤外レーザーを照射した結果、腫瘍の増殖が著しく抑えられた。
- このナノ薬剤は光温熱療法5)の光温熱材6)として応用できるだけでなく、Cu2+を放射性同位体の64Cu2+に置き替えて、治療前や後のPET7)撮影に利用することにより、効果の予測や客観的な評価にも役立つと期待される。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子医学・医療部門 放射線医学総合研究所 先進核医学基盤研究部 胡寛博士研究員、張明栄部長らは、光温熱療法に用いる光温熱材としてCu2+とBPからなるナノ薬剤を開発しました。このナノ薬剤を悪性黒色腫モデルマウスに投与後、近赤外レーザーの照射により、腫瘍の増殖を著しく抑えられることを明らかにしました。
がんの三大療法として手術療法、化学療法、放射線療法が知られていますが、安全で患者への負担が少ない、第四の治療法候補の一つとして光温熱療法が注目を集めています。光温熱療法では、がん細胞が正常細胞に比べて相対的に熱に弱い性質を利用し、光を当てると発熱する光温熱材を投与してがん細胞に集積させ、生体深部まで透過できる近赤外光を照射し、光温熱材から放出される熱でがん細胞を死滅させます。
この治療法の実用化のため、(1)近赤外レーザーを吸収して効率良く安定的に発熱し、(2)生体への安全性向上のため生体内で速やかに分解される光温熱材が望まれています。しかし、2つの性質を両立した光温熱材は研究途上です。
本研究では、生命維持活動に必須な元素であるリンと銅に着目し、BPからなるBPナノシート(以下、BPNS)8)にCu2+を組み合わせ、その表面を、多くのがん細胞と強く結合できる低分子環状ペプチドで加工したナノ薬剤(BP@Cu@PEG-RGD)を開発しました。このナノ薬剤に近赤外レーザー照射したところ、優れた光発熱効果を示しました。また、このナノ薬剤を悪性黒色腫モデルマウスに投与して近赤外レーザーを照射した結果、未投与マウスに比べて、腫瘍の体積が10%と著しく増殖が抑えられました。一方、体重が減少することは無く、顕著な副作用は見られませんでした。
さらにCu2+を放射性同位体の64Cu2+に置き替えた放射性薬剤であるBP@64Cu@PEG-RGDを投与して撮影したPET画像から、正確に腫瘍体積を測定できました。
以上の結果から、今回開発したナノ薬剤は近赤外レーザー照射により優れたがん細胞殺傷効果を発揮し、生体への安全性が高い光温熱材であることがわかりました。また、放射性薬剤として用いることによりその集積を画像化でき、治療の客観的な評価にも利用できる可能性を示しました。
今後、薬剤のさらなる最適化を行い、臨床への応用を目指していきたいと考えています。
この成果は、インパクトの大きい論文が数多く発表されている総合科学誌「Nature Communications」2020年6月8日(月)18:00(日本時間)にオンライン掲載されます。
研究の背景と目的
低侵襲で効率的ながんの治療法として、光温熱剤を投与して腫瘍に集積させ、近赤外レーザーを照射して光温熱剤から熱を放出させてがん細胞を死滅させる光温熱療法が注目されています。光温熱剤として金ナノロッドなどのナノ材料が知られています。光熱効果に優れる点は良い部分ですが、生体内での分解が遅いため生体への安全性が懸念されています。
また、安全性を高めるには、生体内で早く分解される方が良いが、結果として治療に必要な光熱効果が損なわれてしまう場合がしばしばあります。このため、優れた光熱効果(すなわち、高い光熱変換効率および/または光熱安定性)を有し、生体内で速やかに分解される光温熱剤の開発が、光温熱療法の臨床での使用を加速する上で課題となっています。
今回、我々は、効率的な発熱性と生体内分解能力を備えた光温熱剤を構成する材料として、生命活動の維持に必須な元素の一つであるリンの一種、BPに着目しました。BPは熱交換効率が高く、酸化還元反応により容易に分解されることから、近年、光温熱剤の素材候補として有力視されています。
そこで、BPからなる二次元ナノ材料BPNSに、生体において酸化還元酵素の補因子として機能するCu2+を組み合わせることで、光熱効果と生体への安全性が高い光温熱材ができると考えナノ薬剤(BP@Cu@PEG-RGD)を開発しました。また、その薬剤を、悪性黒色腫モデルマウスに投与して、近赤外レーザーを照射し、治療効果を確認しました。さらに、Cu2+を放射性同位体元素64Cu2+で置き換えたBP@64Cu@PEG-RGDを用いて、PETによる治療効果の評価が可能か検討しました。
研究の手法と成果
1. BP @ Cuナノ薬剤の合成と特性評価
BPNSとCu2+と混合させシート状のBP@Cuを合成し、生体安定性を高めるためにBP@Cuをポリエチレングリコール(PEG)で修飾しました。さらに、がん細胞と強く結合する環状RGDペプチド9)でコーティングし、ナノ薬剤BP@Cu@PEG-RGDを作製しました(図1)。
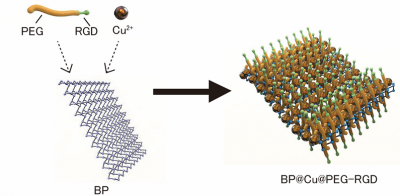
図1. ナノ薬剤BP@Cu@PEG-RGDのイメージ図(ナノシートの大きさは約100 nm角。
1 nm=0.000001 mm)
BPNS および BP@Cu@PEG-RGDの 溶液それぞれに、近赤外レーザーを照射した結果、BP@Cu@PEG-RGDはBPNSよりも高い光熱性能を有していることが確認できました(図2)。
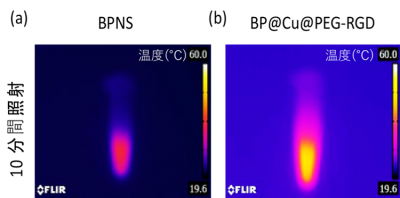
図2. (a) BPNS と (b) BP@Cu@PEG-RGDの 溶液、それぞれに近赤外レーザー(波長808 nm)を10分間照射した後の近赤外画像
また、Cu2+との組み合わせにより、BP@Cu@PEG-RGDはがん細胞の殺傷能力の高い活性酸素(ヒドロキシルラジカルなど)を生成することがわかりました(図3)。

図3. 黒色腫がん細胞に(a) BPNS または(b) BP@Cu@PEG-RGDを添加した後の黒色腫がん細胞内の活性酸素(ヒドロキシルラジカルなど)の測定結果(緑蛍光は活性酸素)
これらのことから、BP@Cu@PEG-RGDは、高い光熱性能と活性酸素生成能の相乗効果により、がん細胞の殺傷効果が高く、生体への安全性の高い光温熱材であると考えられました。
2. 抗腫瘍治療効果の評価
6週齢のマウスに黒色がん癌細胞(B16F10)を皮下注射し、7日間腫瘍を増殖させた担癌マウス作製し、腫瘍モデルとしました。
腫瘍を増殖させた後の担癌マウスに、1、3、5、7日目に計4回光温熱治療を行いました。治療の各回において、BP@Cu@PEG-RGDを尾静脈から投与し、投与の24時間後、腫瘍全体に近赤レーザー(波長808 nm、1W/cm2)を2分間照射しました(図4)。
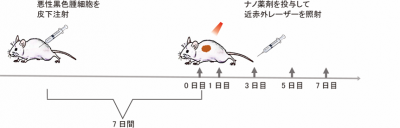
図4.腫瘍モデルマウスを用いたBP@Cu@PEG-RGDによる光温熱治療実験(対照群には生理食塩水を投与。治療群、対照群それぞれn=6)
近赤外レーザー照射後、BP@Cu@PEG-RGDを投与した担癌マウスでは腫瘍の温度が5分以内に急速に上昇して、最高56℃に達し、がん細胞の殺傷に十分な発熱が確認できました。一方、生理食塩水を投与した担癌マウスでは腫瘍の温度は32℃でした(図5)。
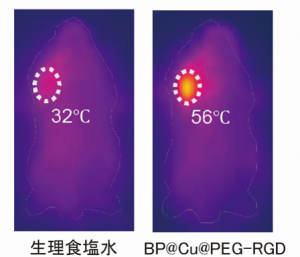
図5. 生理食塩水またはBP@Cu@PEG-RGDを投与した担癌マウスに、近赤外レーザーを2分間照射した後の近赤外画像
光温熱治療後、腫瘍体積を実測したところ、BP@Cu@PEG-RGDを投与して治療をした担癌マウスのすべての個体で、明らかに腫瘍の増殖が抑制されました。抑制効果は顕著であり、対照群に比べて腫瘍の体積が約10%まで減少しました(図6)。また、両群ともに体重は異常なく着実に増加し、死亡例もなく、顕著な有害な副作用は認められませんでした。
これらのことから、BP@Cu@PEG-RGDは近赤外レーザー照射により優れたがん細胞殺傷効果を発揮する、生体への安全性が高い光温熱材であることがわかりました。
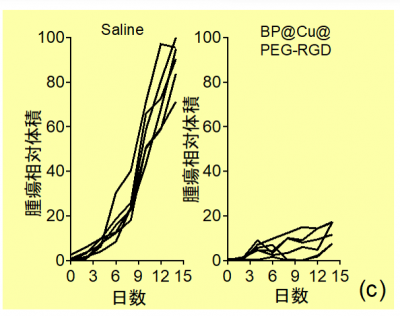
図6.生理食塩水またはBP@Cu@PEG-RGDを投与した担癌マウスに光温熱治療を行った後の腫瘍体積の変化(対照群の14日目の腫瘍体積の平均値との比較)
3. PETによる治療効果の評価
BP@Cu@PEG-RGD のCu2+を放射性元素64Cu2+で置き換えた放射性薬剤であるBP@64Cu@PEG-RGDを作製しました。光温熱治療開始から2週間後にBP@64Cu@PEG-RGDを投与してPETで撮影しました(図7左)。PET画像から腫瘍体積を測定して、実測した腫瘍体積と比べたところ、両者が完全に一致しました(図7右)。
臨床では、腫瘍が体深部にあり体積の実測をできない場合がほとんどですが、BP@64Cu@PEG-RGDを投与して撮影したPET画像から腫瘍体積を正確に計測することができると考えられます。
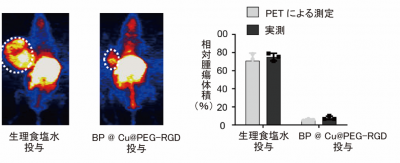
図7.(左)生理食塩水またはBP @ Cu@PEG-RGDを投与して光温熱治療を開始した日から2週間後に、BP@64Cu@PEG-RGDを投与して撮影したPET画像、(右)PET撮影時に実測した腫瘍体積と、PETの3D画像から測定した腫瘍体積の比較(対照群の14日目の腫瘍体積の平均値との比較)
Cu2+と放射性元素64Cu2+の化学的な性質は変わりません。したがって、BP@64Cu@PEG-RGD は光温熱治療の光温熱材として利用できるだけでなく、PET撮影に用いることにより、治療効果の客観的な評価や腫瘍の進行のモニタリングにも利用できる可能性があります。また、治療前にPET撮影を行い、腫瘍にBP@64Cu@PEG-RGDが集積しているかどうかを確認することにより、光温熱治療の効果を予測することにも役立つ可能性もあります。
今後の展開
今回の研究では、BPとCu2+を組み合わせる新しい戦略を利用して、近赤外レーザー照射で効率的に発熱し、生体内分解能力を備えるナノ薬剤BP @ Cu@PEG-RGD を開発することに成功しました。この薬剤のベースである、BPNSは、今回修飾に用いたRGDとは別のペプチドで修飾する、抗体や抗がん剤と組み合わせるなどによって、より効果の高い治療法を開発するための基盤的な素材になると期待されます。
今後は臨床への応用を目指して、BPNSの品質を均一化するなど、最適化を行っていきます。
用語解説
1) 近赤外レーザー
レーザーとは、光を増幅して放射するレーザー装置、またはその光のこと。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができます。特に、700~1500 nm(1400~1480 nmの水の吸収帯を除く)の近赤外領域の波長の光は皮下まで到達し、生体透過性が高いことが知られています。
2) 黒リン(BP:Black Phosphorus)
リンの同素体の一つ。BPは近赤外光を照射すると発熱します。
3) ナノ薬剤
高分子化学やナノ技術等を用いて、10~100 nmサイズのサイズで作製された治療薬や診断薬。
EPR(Enhanced permeation and retention)効果等により、腫瘍に集積します。
4) 悪性黒色腫
皮膚、眼窩内組織、口腔粘膜上皮などに発生するメラノサイト由来で転移しやすく、予後不良の悪性腫瘍です。正確な発生原因は不明ですが、表皮基底層部に存在するメラノサイトの悪性化によって発症します。また、皮膚に発生する悪性黒色腫は紫外線曝露と、足底に発生するものは機械的刺激と関連性が深いと考えられます。
5) 光温熱療法(PTT:Photothermal Therapy)
光温熱材を投与してがんに集積させ、外部からがんに光(近赤外レーザーなど)を照射することにより光温熱材が発熱します。その熱によりがん細胞を死滅させる治療法。
6) 光温熱剤(PTA:photothermal agent)
光温熱療法に用いられる薬剤で、光を照射すると発熱する性質があります。
7) PET(Positron Emission Tomography)
陽電子断層撮像法の略称。身体の中の生体分子の働きを見ることができる画像診断法の一種。特定の放射性同位体で標識した放射性薬剤を投与し、その薬剤から放射される陽電子に起因するガンマ線を検出することによって、生体内の分子の分布や量、時間変化を測定できます。
8) BPナノシート(BPNS:Black Phosphorus Nanosheet)
BPからなるナノサイズのシート状の構造体。シート状であるため、BP結晶に比べて表面積が大きくなり、多量の分子を修飾することができます。また、吸収波長が赤方に移動するため、光熱転換効果が現れます。
9) 環状RGDペプチド
アルギニン(R)-グリシン(G)-アスパラギン酸(D)のアミノ酸が含有し、ペプチド結合により環状につながった分子。
論文について
Marriage of black phosphorus and Cu2+ as effective photothermal agents for PET-guided combination cancer therapy
Kuan Hu1, Lin Xie1, Yiding Zhang1, Masayuki Hanyu1, Zhimin Yang1,2, Kotaro Nagatsu1, Hisashi Suzuki1, Jiang Ouyang3, Xiaoyuan Ji3, Junjie Wei2, Hao Xu2, Omid C. Farokhzad3, Steven H. Liang4, Lu Wang2, Wei Tao3, Ming-Rong Zhang1.
1. Department of Advanced Nuclear Medicine Sciences, National Institute of Radiological Sciences, National Institutes for Quantum and Radiological Science and Technology, Chiba, 2638555, Japan;
2. Department of Nuclear Medicine, PET/CT-MRI Center, The First Affiliated Hospital of Jinan University, Guangzhou, 510630, China;
3. Center for Nanomedicine and Department of Anesthesiology, Brigham and Women’s Hospital, Harvard Medical School, Boston, 02115, USA;
4. Division of Nuclear Medicine and Molecular Imaging, Massachusetts General Hospital, Harvard Medical School, Boston, 02114, USA.



