細胞丸ごと、内部構造を非侵襲的に可視化
2018-10-26 理化学研究所
理化学研究所(理研)放射光科学研究センター生命系放射光利用システム開発チームの中迫雅由客員主管研究員、小林周基礎科学特別研究員、生体機構研究グループの高山裕貴客員研究員らの共同研究チーム※は、細胞1個の内部構造を非侵襲的に(細胞を傷つけずに)可視化できる「低温X線回折イメージング・トモグラフィー[1]」実験装置を開発し、その測定・解析方法を確立しました。
本研究成果は、これまで他のイメージング手法では難しかった細胞の非修飾・非侵襲を実現し、細胞をはじめとする非結晶粒子の三次元構造解析に新たな基軸と展開を与えると期待できます。
X線の透過性を利用する「X線回折イメージング法」は、細胞を非修飾・非侵襲的に観察できる可能性が示されてきましたが、放射線損傷[2]などの問題がありました。今回、共同研究チームは、試料の放射線損傷を大幅に低減しながら、水和凍結試料の三次元構造を100ナノメートル(nm、1nmは10億分の1メートル)程度の解像度で可視化する、低温X線回折実験技術[3]と水和凍結試料作製技術を開発しました。実際に、開発した装置を用いてX線回折イメージング・トモグラフィー実験を行った結果、大きさが約6マイクロメートル(μm、1μmは100万分の1メートル)の原始紅藻[4]や出芽酵母[5]細胞の三次元構造の可視化に成功しました。今後、低温X線回折イメージング・トモグラフィーは蛍光顕微鏡[6]、透過型電子顕微鏡[7]と相補的な第三の顕微鏡として機能し、“細胞丸ごと”の高解像度イメージングが可能になると考えられます。
本研究は、英国の科学雑誌『Journal of Synchrotron Radiation』のオンライン版(10月23日付け)に掲載されました。
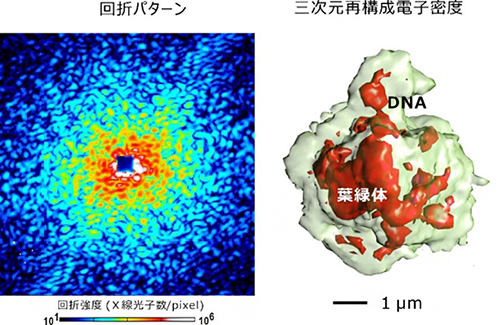
図 原始紅藻細胞からのX線回折パターン(左)と三次元再構成された電子密度(右)
※共同研究チーム
理化学研究所 放射光科学研究センター
利用システム開発研究部門
生物系ビームライン基盤グループ 生命系放射光利用システム開発チーム
基礎科学特別研究員 小林 周 (こばやし あまね)
客員研究員 岡島 公司 (おかじま こうじ)
(慶應義塾大学 理工学部 特任助教)
研修生 大出 真央 (おおいで まお)
(慶應義塾大学 理工学研究科)
研修生 山本 隆寛 (やまもと たかひろ)
(慶應義塾大学 理工学研究科)
研修生(研究当時) 関口 優希 (せきぐち ゆうき)
(慶應義塾大学 理工学研究科)
客員研究員 苙口 友隆 (おろぐち ともたか)
(慶應義塾大学 理工学部 専任講師)
客員主管研究員 中迫 雅由 (なかさこ まさよし)
(慶應義塾大学 理工学部 教授)
チームリーダー 山本 雅貴 (やまもと まさき)
物理・化学系ビームライン基盤グループ 放射光イメージング利用システム開発チーム
チームリーダー 香村 芳樹 (こうむら よしき)
利用技術開拓研究部門
生体機構研究グループ
客員研究員 高山 裕貴 (たかやま ゆうき)
(兵庫県立大学 物質理学研究科 助教)
株式会社 理学相原精機
技術部
営業課係長 星 貴彦 (ほし たかひこ)
設計課主任 鳥塚 康史 (とりづか やすふみ)
※研究支援
本研究は、文部科学省X線自由電子レーザー施設重点戦略課題推進事業「SACLAにおける低温X線回折イメージング実験の展開と標準化(研究代表者:中迫雅由)」、日本学術振興会(JSPS)科学研究費補助金 基盤研究A「コヒーレントX線回折による酵母核内の核酸分布イメージング(研究代表者:中迫雅由)」および、JSPS特別研究員奨励費「コヒーレントX線回折イメージングによるソフトマター空間階層構造可視化技術の開発(研究代表者:小林周)」の支援を受けて実施されました。
背景
細胞生物学における目標の一つは、生命現象をもたらす細胞構成要素の立体構造変化や相互作用変化を可視化することです。そのためにこれまで、マイクロメートル(μm、1μmは100万分の1メートル)サイズの細胞の内部構造のイメージングには、「蛍光顕微鏡」、「超解像顕微鏡[8]」、「透過型電子顕微鏡」、「収束イオンビームと走査型電子顕微鏡を組み合わせた方法[9]」、「軟X線顕微鏡[10]」などの手法が用いられてきました。
蛍光顕微鏡や超解像顕微鏡では、浅い焦点深度で蛍光物質で標識された生体分子の動態のみが見えます。また、蛍光物質の励起に用いられるレーザー光による試料損傷が無視できないという問題があります。透過型電子顕微鏡では、電子と物質の相互作用が強いことから厚さ100ナノメートル(nm、1nmは10億分の1メートル)以上の試料の場合は内部構造を観察できないため、薬剤固定・染色した細胞や凍結した細胞を薄片化して観察する必要があります。収束イオンビームと走査型電子顕微鏡を組み合わせた方法では、細胞試料を樹脂で固め、重金属化合物で染色した後、イオンビームで試料を削りながら走査型電子顕微鏡で観察します。唯一、非侵襲的に(細胞を傷つけずに)細胞を観察できる軟X線顕微鏡では、物質のX線に対する吸収コントラストを見ているだけで、直接物質分布を観察できるわけではないという問題があります。このように、これまで、細胞内の物質分布を非修飾・非侵襲的に直接高解像度観察することは難しい状況でした。
一方で、X線の透過性を利用する「X線回折イメージング法」は、大きな細胞を数十nmの解像度で観察できる可能性が示されています。しかし、室温真空中または室温湿潤環境において、化学固定あるいは乾燥した生物試料の測定が行われましたが、放射線損傷や試料調製が難しいなどの問題や、観察結果を生物学的に意味のあるものと考えにくいという課題がありました。
研究手法と成果
X線回折イメージング法では、細胞などの非結晶試料粒子に波面のそろった(空間コヒーレンスの高い)X線[11]を照射して回折パターンを取得します。得られた回折パターンに位相回復アルゴリズム[12]を用いると、それぞれの粒子のX線入射方向に対する投影電子密度が得られます。
試料の三次元電子密度を再構成するには、試料粒子にさまざまな方向からX線を入射し、各入射方向での回折パターンから投影電子密度図を得た後、それらに対してX線CT(コンピューティング・トモグラフィー)で用いられるような画像工学で開発されたバックプロジェクション[13]と呼ばれるアルゴリズムを用います。このような三次元再構成のための実験・解析を「X線回折イメージング・トモグラフィー」と呼びます(図1左)。
トモグラフィー実験では多数回のX線露光が必要なことから、試料の放射線損傷を低減するために、水和凍結状態に保持された細胞試料の温度を液体窒素温度(-196℃)程度に維持することが不可欠です。さらに、低温に保たれた試料ステージを精密に回転させる必要があります。
試料を低温保持するには低温ポット[14]を用います。共同研究チームは、試料を入射X線ビームに対して自在に回転させるために、液体窒素供給パイプや窒素ガス排気パイプを“蚊取り線香”のように配置することで、±170度の回転が無理なくできる低温ポットを開発しました(図1右)。この低温ポットを、X線自由電子レーザー(XFEL)[15]施設「SACLA[16]」と大型放射光施設「SPring-8」[17]両方での利用を想定して試作された汎用低温試料照射装置「壽壱号」[18]に搭載し、さらにトモグラフィー実験用の制御ソフトウェアを開発しました。「壽壱号」では、湿潤環境下で厚さ100nmの窒化シリコン薄膜上に細胞を載せ、それを-188℃程度に保たれた液体エタンによって急速凍結することで、水和凍結試料を作製します。凍結試料は液体窒素温度に保存され、温度上昇や着霜を防ぐ工夫を施したキャリヤーと搬送ロボットによって低温ポットに運ばれます。
図2に、SPring-8で行った低温X線回折イメージング・トモグラフィー実験の様子を示します。実験では、試料上流2mに設置した直径38μmのピンホールを用いて、波面のそろったX線を取り出します。そのX線束を試料に照射し、試料下流5mに置いた検出器によってX線回折パターンを記録します。
共同研究チームは、装置の性能やパフォーマンスを調べるために、6μm程度の大きさを持つ原始紅藻シゾン(Cyanidioschyzon merolae)細胞や出芽酵母細胞を用いて、低温X線回折イメージング・トモグラフィー実験を行いました。試料を1.5度回転させるごとに、試料位置を精密に調整し、60秒間の露光で50nmの分解能の回折パターンを記録します。これを繰り返すことで、三次元再構成に必要なデータが収集されます(図3左)。得られた各回折パターンから、X線入射方向に対する細胞の投影電子密度を取得し、バックプロジェクションにより三次元電子密度を再構成しました。
その結果、得られた三次元電子密度図には、DNAの凝集体や葉緑体を見いだすことができました(図3右)。シゾン細胞の蛍光顕微鏡像や染色・薄片化試料の電子顕微鏡像は既に知られていますが、今回得られた電子密度図では、それらよりもDNAはよりコンパクトに集合しており、葉緑体も広域に広がっているわけではないことが明らかになりました。このような違いは、従来法で行われている薬剤の導入や細胞の加工に起因すると考えられます。
今後の期待
現在、低温X線回折イメージング・トモグラフィー実験では、1日で水和凍結細胞1個の三次元構造解析データを収集でき、細胞周期[19]の各段階での構造解析を実施することで、細胞個々の特性や細胞周期に応じた物質分布の変化を知ることができます。一方、XFELを用いるX線回折イメージング実験注1)では、大量の細胞試料の投影電子密度を得ることができ、細胞の多様性を知ることができます。今回の開発は、シンクロトロン放射光とXFELを相補的に利用することで、細胞の個性と多様性を見ることにつながり、他のイメージング手法では成しえない非侵襲的イメージングの大きな進展につながることが期待できます。
本研究は、低温X線回折イメージング法の有用性をさらに高めたものであり、今後、本手法が細胞イメージングの重要な柱の一つとなるだけでなく、非結晶金属ナノ材料試料注2)の構造研究にも裾野を広げていくと期待できます。
注1)2016年5月18日SPring-8プレスリリース「X線自由電子レーザーによる非結晶試料からの高効率回折データ収集装置を実用化」
注2)2018年7月31日プレスリリース「SACLAにより銅キューブ粒子の内部構造変化を可視化」
原論文情報
Amane Kobayashi, Yuki Takayama, Koji Okajima, Mao Oide, Takahiro Yamamoto, Yuki Sekiguchi, Tomotaka Oroguchi, Masayoshi Nakasako, Yoshiki Kohmura, Masaki Yamamoto, Takahiko Hoshi, and Yasufumi Torizuka, “Diffraction apparatus and procedure in tomography X-ray diffraction imaging for biological cells at cryogenic temperature using synchrotron X-ray radiation”, Journal of Synchrotron Radiation, 10.1107/S1600577518012687
発表者
理化学研究所
放射光科学研究センター 利用システム開発研究部門 生物系ビームライン基盤グループ 生命系放射光利用システム開発チーム
客員主管研究員 中迫 雅由(なかさこ まさよし)
(慶應義塾大学 理工学部 教授)
基礎科学特別研究員 小林 周(こばやし あまね)
放射光科学研究センター 利用技術開拓研究部門 生体機構研究グループ
客員研究員 高山 裕貴(たかやま ゆうき)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 低温X線回折イメージング・トモグラフィー
- X線回折イメージング法は、干渉性の優れたX線を試料に照射した際に起こるX線の散乱現象を利用するイメージング手法のこと。トモグラフィーは、回転ステージによってX線入射方向に対する試料の配向を調整し、配向ごとの回折パターンを記録して三次元構造を可視化する手法のこと。水和環境が必須な細胞試料を、-196℃の液体窒素温度程度の低温に冷やすことによって、放射線損傷を低減させることが可能である。これを利用して、金属ナノ材料粒子や細胞などの非結晶試料粒子の内部構造を可視化できる。
-
- 放射線損傷
- X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。
-
- 低温X線回折実験技術
- 試料を極低温に保った状態でX線を照射し、回折パターンを記録する実験技術。長時間低温を保つこと、室内の空気中の水分子が付着しないようにすること、入射X線ビームの照射領域に対して試料の振動を十分に抑えることが要求される。
-
- 原始紅藻
- 核、ミトコンドリア、葉緑体を備えた真核生物の源流に位置する生物である。イタリアの火山にある強酸性温泉で発見されたシゾン(Cyanidioschyzon merolae)などがその代表として知られる。
-
- 出芽酵母
- 醸造に用いられる酵母であり、生物学的諸性質がヒトや高等植物に似ていることから、真核細胞生物のモデル生物として利用されている。
-
- 蛍光顕微鏡
- 試料の観察対象とする組織を蛍光を発する物質で染め上げ、その蛍光・燐光の形や動態を光学顕微鏡で観察する手法。組織ごとに蛍光物質を変えれば複数の組織の位置関係を同時に観察することが可能だが、全ての組織を染め上げることは極めて難しい。
-
- 透過型電子顕微鏡
- 通常の光学顕微鏡では可視光を試料に当てて観察するのに対し、電子顕微鏡では電子線を当てて観察する。電子線の波長は可視光よりもはるかに短いため、理論上0.1nm程度の分解能が得られ、生体分子やその複合体の構造解析に用いられる。ただし、電子と物質の相互作用が強いことがあだとなって、厚みのある試料を観察できない。
-
- 超解像顕微鏡
- 光は波としての性質を示し回折現象を起こすため、光学顕微鏡で観察できる空間分解能は回折によって制限され(回折限界)、観察に用いる光の波長の半分程度であることが理論的に示されていた。近年、蛍光分子の特徴を巧みに利用することで、回折限界を超えた高い空間分解能を達成する手法が開発され、これを超解像蛍光顕微鏡法と呼ぶ。
-
- 収束イオンビームと走査型電子顕微鏡を組み合わせた方法
- 細胞を接着剤のような液体で固定し、重金属で固定した試料を用いる。試料に収束イオンビームを照射して表面を削り、その表面を走査型電子顕微鏡で観察する。重金属を強く吸着した領域の構造のみを高いコントラストで可視化できる。
-
- 軟X線顕微鏡
- 「水の窓」と呼ばれる波長領域(2.28~4.36nm)のX線と、レンズに相当するゾーンプレートを用いるイメージング手法であり、細胞内物質のX線吸収の違いを可視化できる。
-
- 波面のそろった(空間コヒーレンスの高い)X線
- ある空間内に複数の光波が存在するとき、波同士の山と山もしくは谷と谷が重なれば、それぞれ山もしくは谷は大きくなる。逆に、山と谷が重なる場合には打ち消される。このような光波の干渉の具合を空間コヒーレンスという。
-
- 位相回復アルゴリズム
- 回折パターンは、試料で回折されたX線の振幅情報のみを反映したもので、正しい像を再生するためには位相情報が必要になる。振幅情報から位相情報を取得する手順のこと。
-
- バックプロジェクション
- 三次元電子密度を再構成するアルゴリズム。さまざまな角度で得られた粒子の投影像から、元の立体像を再現する。
-
- 低温ポット
- 低温物理学で開発されたデバイスの一つ。液体窒素や液体ヘリウム用貯留槽を内部に持ち、それら冷媒は細管から供給される。貯留槽を負圧(圧力が低い状態)にすることで、蒸発冷却効果が生じ、常圧下の冷媒沸点よりも低い温度に到達できる。振動が生じないので、微小試料へのX線照射が不可欠なX線回折イメージングに適している。
-
- X線自由電子レーザー(XFEL)
- X線領域におけるレーザーのこと。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とする。ほぼ完全な空間コヒーレント光であり、数フェムト秒(1フェムト秒は1,000兆分の1秒)の超短パルス光である。XFELはX-ray Free Electron Laserの略。
-
- X線自由電子レーザー施設「SACLA」
- 理化学研究所と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始され、利用実験が行われている。諸外国と比べて数分の一というコンパクトな施設の規模にも関わらず、0.1nm以下という世界最短波長のレーザーの生成能力を持つ。
-
- 大型放射光施設「SPring-8」
- 理研が所有する、兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
-
- 汎用低温試料照射装置「壽壱号」
- SACLAやSPring-8での低温X線回折イメージング実験のために慶應義塾大学で開発されたプロトタイプ回折装置。ことぶきいちごうと読む。試料の並進回転を行うステージ上に低温ポットを備えて、66~70K(-207~-200℃)の低温で回折実験を行うことができ、低温凍結試料の搬送のために、ロードロック・チャンバーと搬送ロボットを搭載している。
-
- 細胞周期
- 細胞は、分裂を繰り返して増殖するが、この細胞分裂のサイクルを細胞周期と呼ぶ。細胞周期は、間期とM期に分けられる。分裂が起こるM(Mitosis)期と、間期は、DNAの複製が起こるS(Synthesis)期、それぞれの間をつなぐG1(Gap1)期、G2(Gap2)期からなり、サイクルはG1→S→G2→M→G1→…の順に進む。
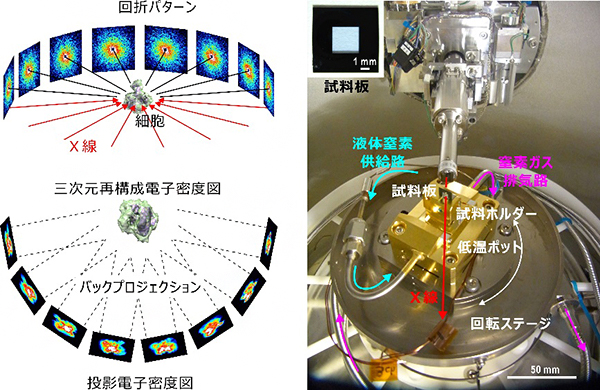
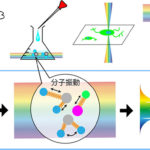
図1 X線回折イメージング・トモグラフィー実験の概要と低温X線回折装置「壽壱号」内の低温ステージ
左: 試料の細胞にさまざまな方向からX線を照射し、それぞれの回折パターンを得る。回折パターンから得られる各投影電子密度に対しバックプロジェクションというアルゴリズムを用いると、三次元再構成電子密度図が得られる。
右: 中心の低温ポットへの液体窒素供給パイプや窒素ガス排気パイプが“蚊取り線香”のように配置されている(水色、ピンク色)。これにより、試料ステージは±170度スムースに回転する。

図2 SPring-8におけるX線回折イメージング・トモグラフィー実験
上流(左側)から、ピンホール、低温試料固定照射装置「壽壱号」、真空パス、ビームストップ、検出器の順に配置し、試料を装置内の低温ポットに搬送してX線ビーム軸上に配置した後は、ほぼ自動でデータ収集が行える。
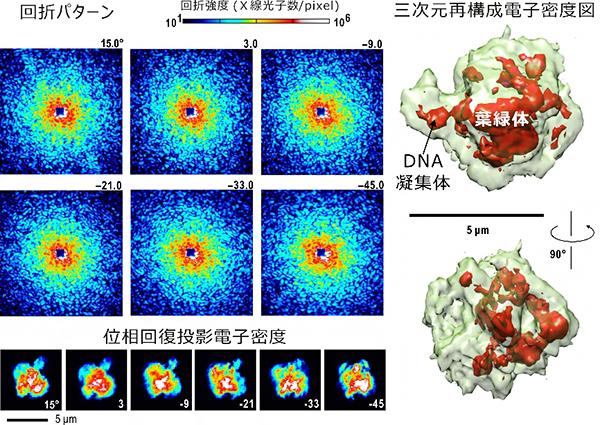
図3 可視化された原始紅藻の三次元電子密度分布
左:原始紅藻シゾン細胞からのX線回折パターン。入射X線ビームに対して異なる配向角度で得られた6枚の典型的パターンを示す。各回折パターンから、位相回復アルゴリズムで得られた投影電子密度図を下に示した。回折パターンの右上、位相回復投影電子密度図の右下に書かれた数字は、入射X線ビームに対する試料の相対的な角度を示す。
右:トモグラフィー実験データから得られたシゾン細胞の三次元再構成電子密度図。緑は、電子密度のレベルを低くして描いた細胞の概形、赤は、DNA凝集体や葉緑体など、電子密度の高い部分を示す。