2021-04-27 理化学研究所
理化学研究所(理研)生命機能科学研究センター集積バイオデバイス研究チームの船野俊一研究員(研究当時)、太田亘俊研究員、田中陽チームリーダーの研究チームは、中性洗剤での表面洗浄とバインダークリップによる加圧だけで繰り返し着脱できるガラス基板の接着法を開発し、区画培養した細胞を回収できるマイクロ流体デバイス[1]の作製に応用しました。
本接着法は、細胞に傷害をほとんど与えないこと、また操作が安全で簡便なため、生物材料を扱うさまざまなガラス製マイクロ流体デバイスの作製に応用できることから、今後、生物学・化学分野における実験効率の向上に貢献すると期待できます。
従来、ガラス製マイクロ流体デバイスを作製するには、化学薬品を用いた洗浄や高温加熱による接着などの工程が必要でした。また、一度接着したガラス基板同士を剥離して再使用することは困難でした。
今回、研究チームは、ガラス基板を中性洗剤で洗浄した後、少量の水を接着剤代わりにしてガラス基板を接着させる手法を開発しました。その結果、耐圧性能は従来法に劣らず、何度も着脱可能なガラス製マイクロ流体デバイスの作製に成功しました。
本研究成果は、科学雑誌『Lab on a Chip』への掲載に先立ち、オンライン版(4月27日付:日本時間4月27日)に掲載されます。
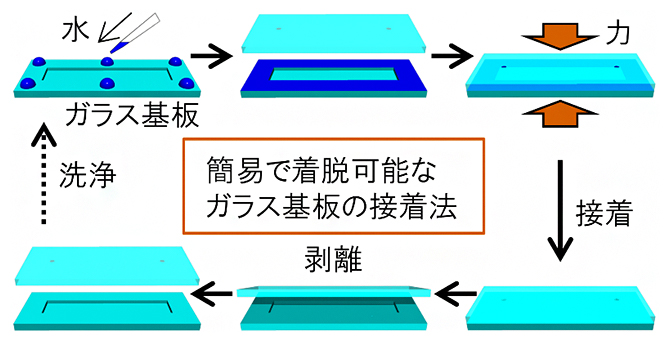
開発した何度も着脱可能なガラス基板の接着法
背景
半導体集積回路の製造に使われる微細加工技術を応用したマイクロ流体デバイスは、手のひらサイズの基板上に指紋サイズの極めて微細な流路を集積した器具です。このデバイスを用いると、少量の細胞や試薬で実験ができることから、生物学・化学分野での実験効率の向上が期待できます。
なかでも、2枚のガラス基板を接着して作製するガラス製マイクロ流体デバイスは、ポリマー製デバイスに比べて、剛性、光学的透明性、熱的安定性、有機溶媒に対する化学的安定性などの面で優れています。しかし、従来のガラス製マイクロ流体デバイスの作製には、濃硫酸などの危険な化学薬品を用いる洗浄や酸素プラズマ[2]での清浄、400℃以上の加熱を必要とします。そのため、ポリマー製デバイスほど手軽には作製や使用ができないという欠点がありました。
研究チームらは2017年に、ガラス基板を化学薬品で洗浄し、細胞や生体分子を所定位置に定着させた後、ガラス基板を常温で加圧し、貼り合わせて流路を形成する手法を開発しました注1)。この手法を用いれば、複数種類の細胞や生体分子を1本のマイクロ流路内に機能を維持したまま区画培養することができます。しかし、一度接着したガラス基板同士を剥離することは困難なため、培養後の細胞を回収したり、ガラス基板を再使用することはできませんでした。
注1)2017年9月28日プレスリリース「微細な流路への細胞パッケージング」
研究手法と成果
今回、研究チームは、ガラス基板を中性洗剤で洗浄した後、少量の水を接着剤代わりにし、室温でバインダークリップを使って固定することで、2枚のガラス基板を接着する手法を考案しました(図1)。この手法で接着したガラス基板は、カミソリの刃で剥離すれば繰り返し使うことができます(図1)。
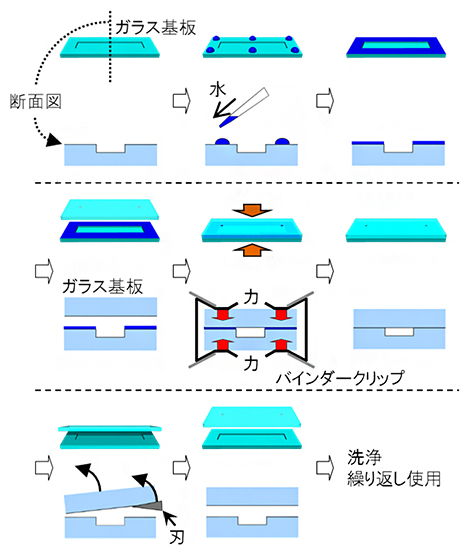
図1 開発した何度も着脱可能なガラス基板の接着法
中性洗剤で洗浄されたガラス基板に接着剤代わりの水を滴下し(上段)、1対のガラス基板を室温でバインダークリップを使って固定する(中段)。使用後はカミソリの刃で剥離し、繰り返し使用できる(下段)。
まず、開発した接着法の性能評価を行いました。ガラス表面の化学状態は、大きくSiOHとSiOの二つに分けられ、相対するガラス表面にあるSiOHが脱水によってSi-O-Si共有結合を形成することで、ガラスとガラスは接着すると考えられています。従って、ガラス表面におけるSiOHがSiOに比べて多いほど、つまりSiOH/SiO比が大きいほど、ガラス同士がより強く接着すると考えられます。
そこで、さまざまな洗浄・清浄処理方法におけるガラス表面のSiOH/SiO比を調べるため、各状態のガラス表面を2次中性粒子質量分析法[3]を用いて測定しました(図2a)。その結果、水だけで洗浄したガラス表面が最も高いSiOH/SiO値(0.74)を示したのに対し、洗浄なしのガラスは最も低い値(0.38)を示しました。これらの値は、ガラス表面にSiOHを形成するには水和が重要であることを意味しています。また、中性洗剤で洗浄したガラスの値は0.66だったことから、洗浄水に含まれる化学物質は水和を阻害すると考えられます。
ただし、この結果だけを基に、水だけでの洗浄が最適と判断するには不十分です。接着の性能はガラス表面に付着した粒子にも強く影響されるため、その粒子を取り除けているかを検証する必要があります。
そこで、接着状態の評価として、本手法で作製したガラス製マイクロ流体デバイスがどの程度の面積割合で接着しているかを調べました。すると、中性洗剤で洗浄した場合は98.1%の部分が接着していた一方、水だけで洗浄した場合は90.8%と接着面積の割合が低下しました(図2b, c)。この結果から、中性洗剤を用いることで、水だけで洗うよりも効果的にガラス表面に吸着した物質を除去できることが示されました。さらに、中性洗剤での洗浄、接着、剥離の操作を10回繰り返し、接着面積の変化を調べたところ、接着面積は大きく低下しないことが分かりました(図2d)。
さらに、本手法で作製したガラス製マイクロ流体デバイスが、どの程度の耐圧性能を持つかを検証しました。中性洗剤で洗浄した後、バインダークリップで6時間、常温で固定すると、耐圧はほぼ600キロパスカル[4](kPa)(今回の試験システムの上限値)に達することが分かりました(図2e)。この耐圧性能は、化学薬品での洗浄と高温加熱を必要とする従来法で作製したデバイスと同等でした。マイクロ流体デバイスに細胞や生体分子を定着させる実験は、100kPa以下の耐圧で行うことがほとんどであることから、本手法で作製したデバイスが実験に必要な耐圧性能を十分に持つことが示されました。また、中性洗剤での洗浄、接着、剥離の操作を繰り返し、耐圧性能への影響を調べたところ、バインダークリップでの固定時間が6時間の場合、10回以上繰り返しても耐圧は600kPaからほぼ変化しないことが分かりました(図2f)。以上の結果から、本接着法がガラス製マイクロ流体デバイスの繰り返しの使用を可能とすることを示しました。
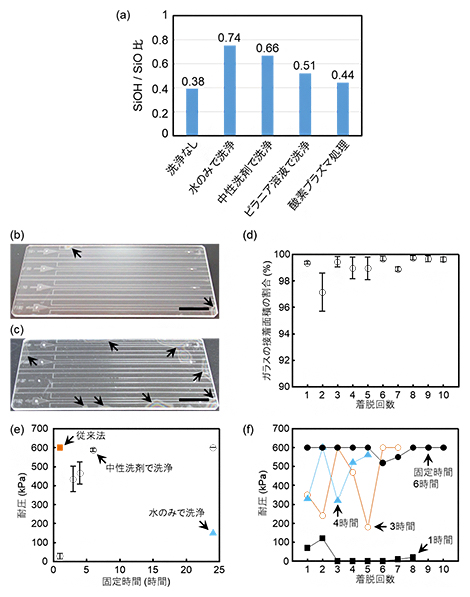
図2 開発した接着法の評価
(a)2次中性粒子質量分析で測定した各表面状態におけるSiOH/SiO比。水だけでの洗浄が最も大きなSiOH/SiO比を示した。なお、ピラニア溶液とは濃硫酸と過酸化水素水の混合溶液のこと。
(b)接着面積の評価。中性洗剤で洗浄後に作製されたマイクロ流体デバイスの写真。矢印の先の縞模様部分が接着していない領域、黒線は1cmを示す。以下同様。
(c)接着面積の評価。水だけで洗浄後に作製されたマイクロ流体デバイスの写真。
(d)着脱回数に伴う接着面積割合の変化。10回繰り返してもほとんど変化しなかった。
(e)耐圧性能の評価。作製工程中におけるバインダークリップでの固定時間と耐圧の関係。比較として水だけで洗浄した場合と従来法での耐圧も表示した。6時間の固定で、従来法と同等の耐圧性能を示した。
(f)着脱回数に伴う耐圧の変化。各固定時間での変化を表示した。固定時間が6時間の場合、10回以上着脱を繰り返しても耐圧は600kPaからほぼ変化しないことが分かった。
次に、開発した接着法で作製されたガラス製マイクロ流体デバイスを使用して、マイクロ流路内への細胞の封入とその取り出しを試しました。当初、接着剤の代わりに水を使用するため、この水と混ざってマイクロ流路へ液体を封入することは難しいという懸念がありました。この課題を解決するため、以前研究チームらが開発した、低温での接着方法や表面フッ素コーティング区画方法を組み合わせました注1-2)。具体的には、マイクロ流路内の細胞定着位置とガラスの接着に使用する領域以外の部分にフッ素コーティングを施し、細胞懸濁液と接着剤代わりの水が接触しないようにしました。
実際に、従来法ではマイクロ流路内での取り扱いが難しかった細胞の封入を試みたところ、複数種類の細胞を1本のマイクロ流路内で10日間培養できることが示されました(図3)。また、筋芽細胞[5](細胞名:C2C12)においては、その特徴通り10日間で筋管[5]への分化が確認できました。
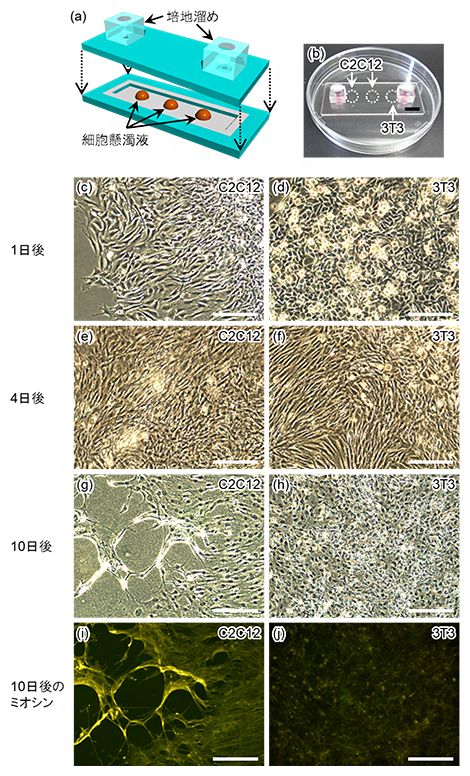
図3 開発した接着法を用いたマイクロ流路内への細胞の封入
(a) 使用したマイクロ流体デバイスの図。幅約1cm,深さ約100マイクロメートル(μm、1μmは1,000分の1mm)の溝に、細胞吸着領域として直径約5mmの区画を形成し、そこに細胞懸濁液を滴下して細胞を吸着させた。
(b) 作製されたマイクロ流体デバイスの外観写真。黒線は1cmを示す。
(c-h) 各細胞種における各培養日数後の顕微鏡写真。デバイスから取り出さずにそのまま撮影した。写真右上は細胞名。C2C12はマウス筋芽細胞、3T3はマウス胎児線維芽細胞。スケールバーは200μmを示す。以下同様。
(i-j) 各細胞種における培養10日後のミオシン(筋肉を構成するタンパク質の一種)の蛍光写真。
また、マイクロ流路からの細胞の取り出しを試みました。マイクロ流路内で複数種類の細胞を4日間培養し、接着している2枚のガラス基板間にカミソリの刃を当て押し込み、ガラス基板を剥離しました。続いて、ガラス基板上の細胞を酵素処理によって剥がし、マイクロピペットで回収し、培養皿に移し替えました。その結果、細胞は培養皿に移し替えられてから少なくとも10日間生き続けることを確認しました(図4)。

図4 マイクロ流路内からの細胞の取り出し
(a) 作製されたマイクロ流体デバイスの外観写真。
(b-d) 各細胞種における培養4日後の顕微鏡写真。写真右上は細胞名。C2C12はマウス筋芽細胞、3T3はマウス胎児線維芽細胞、HeLaはヒトがん細胞。スケールバーは200μmを示す。以下同様。
(e-g) マイクロ流路内から取り出した各細胞種を移し替えた培養皿の外観写真。
(h-j) 各細胞種における培養皿に移し替えてから10日後の顕微鏡写真。
以上の結果から、本手法で作製されたガラス製マイクロ流体デバイス内に細胞を封入し、培養後の細胞を回収できることを立証しました。
注2)2016年10月11日プレスリリース「簡単手順で長期安定的な細胞の区画培養」
今後の期待
本研究では、ガラス基板を中性洗剤で洗浄し、その後少量の水を接着剤代わりにし、室温でバインダークリップを使って固定し接着する手法を開発しました。本手法は、高温加熱によって接着していた従来法に劣らない耐圧性能を持ち、何度も着脱可能なガラス製マイクロ流体デバイスの作製を実現しました。
本手法によるガラス製マイクロ流体デバイスは、作製時に特別な装置や危険な薬品が不要であり、封入した細胞などを培養後に取り出せることから、研究室における高効率な化学薬品や生体物質の合成システムとしての利用や、分析対象物の回収現場において封入と分析を行うポータブルシステムとしての利用ができます。そのため、今までマイクロ流体デバイスが使われていなかった分野への波及はもちろん、既存のデバイスを使用している分野においてもより広く普及することが期待できます。
また、化学薬品での洗浄、接着剤、高温加熱に頼らずガラスとガラスを接着させる方法は他に例がありません。本研究で開発した手法は、平滑な表面を持つガラス同士であれば接着させることができるため、マイクロ流体デバイスに限らず、微細な構造を持つガラス器具やデバイスを接着・補修する方法として、さまざまな産業用途への展開が見込まれます。
補足説明
1.マイクロ流体デバイス
内部に幅、深さ数十から数百マイクロメートル(μm、1μmは1,000分の1mm)の流路を持つデバイス。材質は主にガラスやポリマー(プラスチックやゴムの総称)で、大きさはスライドガラス程度で数センチメートル角のものが主流である。
2.酸素プラズマ
酸素分子から発生させたプラズマのこと。酸素プラズマは基材表面に作用して、表面上にある有機物質を分解したり、表面に親水性機能を付与したりする。
3.2次中性粒子質量分析法
試料中、特に試料表面付近に存在する元素を測定する手法。試料にイオンビーム(発生させたイオン(電荷を帯びた原子や分子)を加速して生じたイオンの流れ)を照射して、試料から飛散した粒子にレーザーを照射し粒子をイオン化させ、そのイオンを質量分析する。
4.パスカル(Pa)
圧力の単位。1Paは1平方メートルの面積に1ニュートン(N)(ニュートンは力の単位。1Nの力は約100グラムの物体に働く重力に等しい。)の力が作用する圧力と定められている。100kPa(キロパスカル)は10万Paであり、およそ1気圧に相当する。
5.筋芽細胞、筋管
筋肉の形成において、筋線維の元になる筋芽細胞が多数融合して筋管(多数の核を含む)ができ、その中で筋収縮に必要なミオシンなどのタンパク質が作られる。筋管がさらに成長すると筋線維になる。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「細胞の3次元パターニングによるオンチップ心臓創成(研究代表者:田中陽)」および理化学研究所エンジニアリング・ネットワーク事業による支援を受けて行われました。
また、大阪大学大学院理学研究科の河井洋輔助教、三宅ゆみ博士から2次中性粒子質量分析に関する技術支援を受けました。
原論文情報
Shunichi Funano, Nobutoshi Ota, Yo Tanaka, “A simple and reversible glass-glass bonding method to construct a microfluidic device and its application for cell recovery”, Lab on a Chip, 10.1039/d1lc00058f
発表者
理化学研究所
生命機能科学研究センター 集積バイオデバイス研究チーム
研究員(研究当時) 船野 俊一(ふなの しゅんいち)
研究員 太田 亘俊(おおた のぶとし)
チームリーダー 田中 陽(たなか よう)
報道担当
理化学研究所 広報室 報道担当
生命機能科学研究センターに関する問い合わせ
理化学研究所 生命機能科学研究センター センター長室 報道担当
川野 武弘(かわの たけひろ)