2021-03-23 東京大学
発表のポイント
- X線自由電子レーザー(注1) を用いて、光受容タンパク質であるチャネルロドプシンの構造変化を捉えることに成功した。
- 光受容タンパク質であるチャネルロドプシンの光照射による動きを世界で初めて観測し、陽イオン輸送の分子基盤を解明することに成功した。
- 光受容タンパク質であるチャネルロドプシンのイオン透過の仕組みを明らかにして、チャネルロドプシンを用いた分子ツールの改良のための基盤情報を提供した。
発表概要
多くの生物は光を受容するためのタンパク質を有しています。その中でも藻類が持つ光受容タンパク質であるチャネルロドプシン(ChR)は、光を吸収することでタンパク質が構造変化を起こし、陽イオンを通すようになります。ChRは神経細胞を光照射によりコントロールする技術のメインツールとして用いられています。この技術は基礎研究だけでなく、医療応用も含めたさまざまな分野で利用されており、ChRの注目度は近年非常に高くなっています。しかしながら、ChRの分子基盤に関しては未解明な部分が多く、特に光を受容することによって生じる構造変化に関してはこれまでに詳細な報告がされていませんでした。
今回、東京大学大学院理学系研究科の濡木理教授らのグループは、国内外の複数の研究室との共同研究の下、X線自由電子レーザー施設SACLAを用いて時分割結晶構造解析(注2) を行い、ChRが光照射によってどのような構造変化をしているのかを捉えることに成功しました。この結果からChRが励起光照射を受けて、陽イオンを通すようになるまでの過程が明らかになりました。この研究結果により、今後、光受容タンパク質のダイナミクスに関する研究が進展していくことが期待されます。
本研究の成果は、英国時間3月23日(午前8時)にオンライン科学雑誌eLife誌に掲載されました。
発表内容
多くの生物は光受容のためのタンパク質を有し、その中でもレチナール分子を発色団とするロドプシンはバクテリアからヒトまで広く保存されている膜タンパク質です。ロドプシンは7本の膜貫通ヘリックス(注3) から構成され、そのうちの7本目の膜貫通ヘリックスに位置しているリジン残基にレチナールが結合しています。
ロドプシンの中でも藻類のもつチャネルロドプシン(ChR:channelrhodopsin)は光を受容することでレチナールが異性化し、この異性化をきっかけとして複数の中間体を経由しながら構造変化を生じて、最終的にはイオン透過経路を形成することで陽イオンを輸送します。ChRを神経細胞に発現させることで、光照射によって神経細胞の活動をコントロールする技術は光遺伝学と呼ばれており、神経学や医学など、幅広い分野で主要な研究手法となっています。
このようにChRを用いた応用研究が行われる一方で、その分子基盤に関する理解は進んでいませんでした。先行研究によりいくつかのChRの立体構造が報告され、ChRのイオン透過経路やイオン選択性などの基礎的な情報が明らかになったものの、いまだに多くの不明な点が残っています。特に、光照射後にどのような構造変化を生じてイオン透過経路が形成されるのかに関してはほとんどわかっていませんでした。
近年、X線自由電子レーザー(XFEL)と呼ばれる技術の登場によって、分子の構造変化を詳細に明らかにできる方法が開発されました。この方法では、結晶化したタンパク質に光照射などの刺激を与え、同期させたXFELにより回折データを収集することで刺激を受けたタンパク質の構造変化を捉えることができます。この方法は時分割シリアルフェムト秒結晶構造解析(TR-SFX:Time-Resolved Serial Femtosecond X-ray crystallography)と呼ばれており、タンパク質の微細な構造変化を高い時間分解能で捉えることができる手法として用いられるようになっています(図1)。
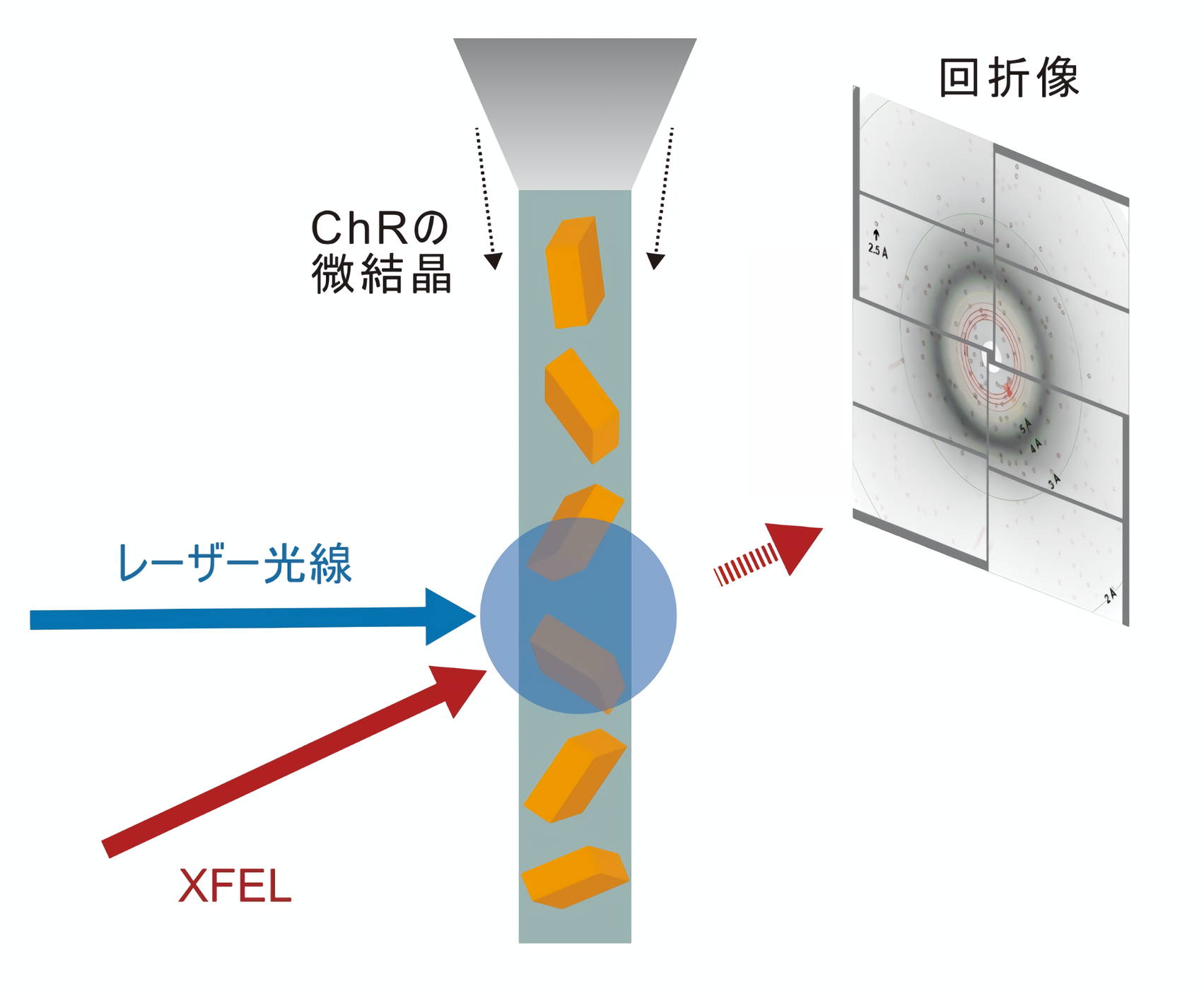
図1:時分割結晶構造解析の概要図。
今回、東京大学大学院理学系研究科の濡木理教授らのグループは、国内外の複数の研究室との共同研究を行い、国内のX線自由電子レーザー施設SACLA(注4) にてTR-SFX測定を行いました。その結果、光照射によりChRが開状態になる過程の構造変化の一端を捉えることに成功しました(動画1)。
動画1:照射によって引き起こされたChR内部の構造変化。
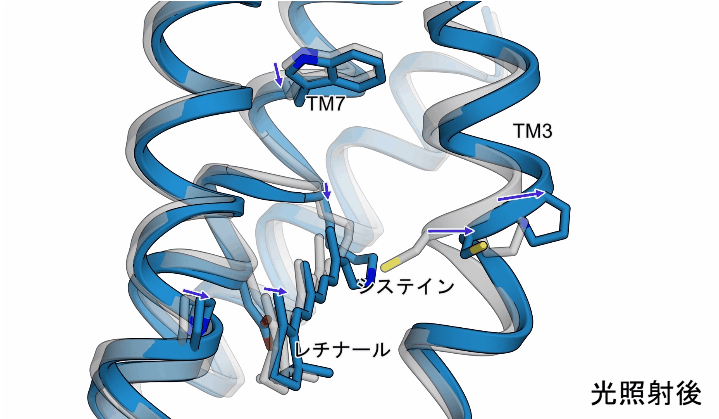
光照射によって、異性化したレチナールにねじれるような動きが生じることで、ChR内部のシステインと呼ばれるアミノ酸を押し出すような動きが生じ、このシステインを含む3本目の膜貫通ヘリックス(TM3)が外側へと押し出されるような動きが観測されました。また、これらの動きに加えて、レチナールが結合した7本目の膜貫通ヘリックスにも構造変化が生じることもわかりました(図2)。
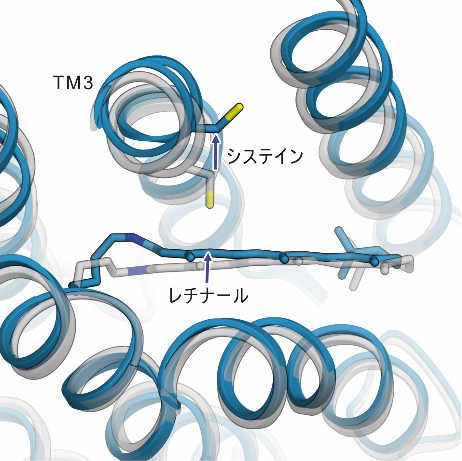
図2:今回観測されたChRの構造変化の様子。図のグレーの構造は初期状態を示し、ブルーの構造は光照射後の構造を示しています。
今回明らかにした構造変化は、実際にはイオン流入が起こるより早いタイミングで起こるものではありますが、これらの膜貫通ヘリックスはイオン透過経路を形成すると考えられていることから、観察された構造変化によってゲートを形成する相互作用が壊れることでイオン流入が引き起こされると考えられます(図3)。
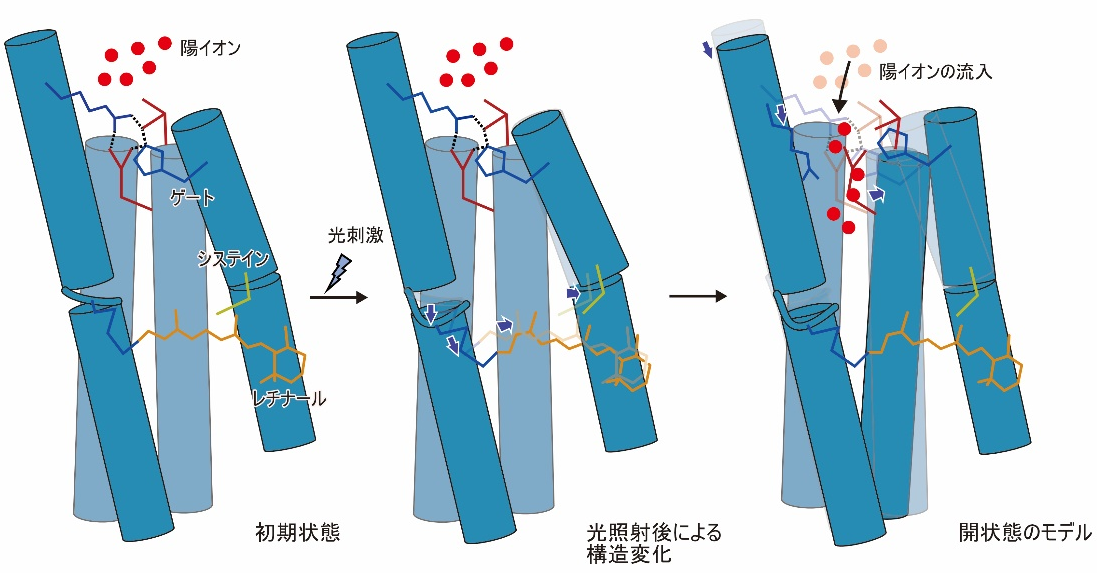
図3:今回観測された構造変化と、開状態のモデル図。
本研究は、光受容タンパク質であるチャネルロドプシンを含むロドプシンタンパク質におけるダイナミクスを高分解能で解明した数少ない研究です。また、チャネルロドプシンにおけるイオン流入の分子機構の一端を解明したことで、光遺伝学に関する新たなツール開発などへとつながることも期待されます。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(課題番号:16H06294 研究開発代表者:濡木 理)および特別研究員奨励費「時分割測定を用いたチャネルロドプシンの開状態遷移メカニズムの解明」(課題番号:18J21256特別研究員:小田 和正)および文部科学省X線自由電子レーザー重点戦略研究課題「創薬ターゲット蛋白質の迅速構造解析法の開発」(研究代表者:岩田 想)の一環で行われました。
また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
発表雑誌
- 雑誌名
eLife論文タイトル
Time-resolved serial femtosecond crystallography reveals early structural changes in channelrhodopsin著者
Kazumasa Oda, Takashi Nomura, Takanori Nakane, Keitaro Yamashita, Keiichi Inoue, Shota Ito, Johannes Vierock, Kunio Hirata, Andrés D. Maturana, Kota Katayama, Tatsuya Ikuta, Itsuki Ishigami, Tamaki Izume, Rie Umeda, Ryuun Eguma, Satomi Oishi, Go Kasuya, Takafumi Kato, Tsukasa Kusakizako, Wataru Shihoya, Hiroto Shimada, Tomoyuki Takatsuji, Mizuki Takemoto, Reiya Taniguchi, Atsuhiro Tomita, Ryouki Nakamura, Masahiro Fukuda, Hirotake Miyauchi, Yongchan Lee, Eriko Nango, Tomoyuki Tanaka, Rie Tanaka, Michihiro Sugawara, Tetsunari Kimura, Tatsuro Shimamura, Takaaki Fujiwara, Yasuaki Yamanaka, Shigeki Owada, Yasumasa Joti, Kensuke Tono, Ryuichiro Ishitani, Shigehiko Hayashi, Hideki Kandori, Peter Hegemann, So Iwata, Minoru Kubo*, Tomohiro Nishizawa*, Osamu Nureki*DOI番号
10.7554/eLife.62389
小田 和正(生物科学専攻 博士課程3年)
西澤 知宏(生物科学専攻 准教授)
濡木 理(生物科学専攻 教授)
久保 稔(兵庫県立大学大学院生命理学研究科 教授)
野村 高志(理化学研究所 放射光科学研究センター 特別研究員(研究当時)/同脳神経科学研究センター 基礎科学特別研究員)
南後 恵理子(理化学研究所 放射光科学研究センター 客員研究員/ 東北大学多元物質科学研究所 教授)
岩田 想(理化学研究所 放射光科学研究センター グループディレクター/ 京都大学大学院医学研究科 教授)
用語解説
注1 X線自由電子レーザー(X-ray Free Electron Laser:XFEL)
通常の放射光施設で用いられるX線と比べて非常に高輝度で位相の揃った、数フェムト秒(1フェムト秒は1,000兆分の1秒)のX線パルスレーザー。非常に短い時間で回折測定を行うことができるため、測定時にX線による損傷を受ける前の構造を見られることに加えて、時分割結晶構造解析のような測定にも用いられる。
注2 時分割結晶構造解析
励起光のような特定の刺激をタンパク質結晶に与え、一定の遅延時間をもって同期させたX線自由電子レーザーによる測定を行うことで、結晶内でのタンパク質構造変化を明らかにする手法。
注3 膜貫通ヘリックス
細胞膜中に存在している膜貫通タンパク質の多くで、細胞膜を貫通する部位はαヘリックスと呼ばれる二次構造を作っており、そのヘリックスは膜貫通ヘリックスと呼ばれる。
注4 X線自由電子レーザー施設SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAser の頭文字を取ってSACLAと命名された。SACLAでは、2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始され、利用実験が行われている。諸外国と比べて数分の一というコンパクトな施設の規模にもかかわらず、 0.1 nm以下という世界最短波長クラスのレーザーの生成能力を持つ。