2022-02-24 広島大学,東京大学
- 15年近く論争となっていた水の軟X線発光スペクトルの温度依存性や同位体依存性を理論的に再現することに成功
- 軟X線発光分光に特有の散乱過程によって水の構造とその変化を強調して観測できることが判明
- 様々な環境における水の構造とその役割を分子レベルで理解するための理論的裏付けが可能に
広島大学大学院先進理工系科学研究科の高橋修准教授、ルンド大学MAX IV研究所の徳島高研究員、東京大学物性研究所 附属極限コヒーレント光科学研究センターの原田慈久教授の国際共同研究チームは、水の軟X線発光スペクトルを理論的に計算し、その温度依存性および同位体依存性を正しく説明することに成功しました。本研究は米国の物理学雑誌「Physical Review Letters」オンライン版に2月25日に掲載される予定です。
発表論文
発表雑誌: Physical Review Letters
論文タイトル:Interpretation of the x-ray emission spectra of liquid water through temperature and isotope dependence
著者:Osamu Takahashi, Ryosuke Yamamura, Takashi Tokushima, Yoshihisa Harada
DOI:10.1103/PhysRevLett.128.086002
背景
水は我々が生命活動をする上で欠かせない物質の1つです。面白いことに水は非常にありふれた物質であるにもかかわらず、類似の構造をもつ分子と比べ異常な性質を示すことがよく知られています。一方、液体の水の構造については100年以上の論争があり、いまだに議論が絶えません。長年にわたって液体はランダムに水素結合(※1)が歪んでいるとする連続体モデルが優勢でしたが、微小なスケールでは2種類の不均一構造が存在し、一方は氷に似た構造、もう一方は水素結合が歪んだ構造に分けることができるという2状態モデル(※2)が正しいとする研究も数多く存在していますいます。本研究チームは15年ほど前に各種X線分光法を用いた水の研究を開始し、2状態モデルとしての水の解釈がもっとも確からしいことを示してきました。しかし、同じ軟X線発光分光法(※3)で得られた同様のスペクトルを、2状態モデルで解釈する研究者と連続帯モデルで解釈する研究者の間で議論が絶えず、結論は出ていませんでした。軟X線発光が複雑な散乱過程に由来するため、実験で得られたスペクトルからそのまま構造を決定することが困難だったのです。したがって、軟X線発光スペクトルを理論的に再現することが議論を収束させるカギであり、急務となっていました。
研究成果の内容
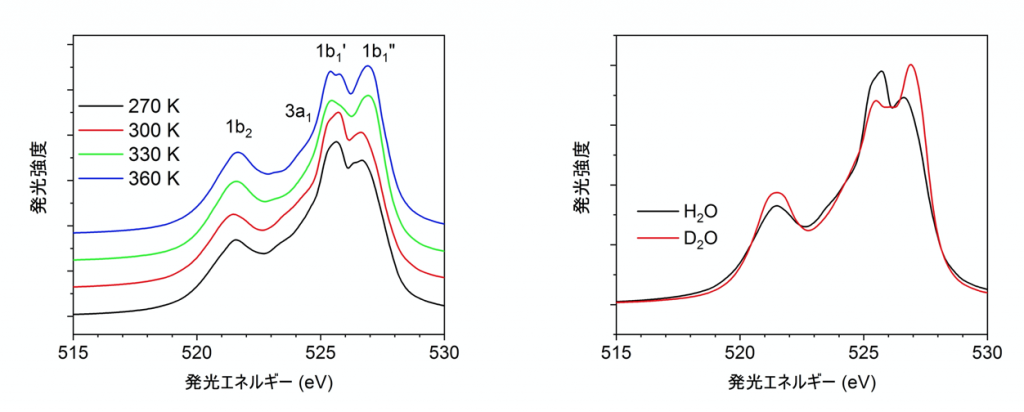
液体の水の軟X線発光スペクトルを理論的に再現するために、本研究ではまず分子動力学法(※4)に基づいたコンピューターシミュレーションで様々な温度の水の分子レベルのモデル構造を構築しました。得られたモデル構造から部分的な構造を多数切り取り、分子中の電子の挙動を計算する密度汎関数法(※5)に基づく第一原理理論計算(※6)を用いて軟X線発光スペクトルの計算を行いました。今回の研究では、実験で観測されている主要な2つのピークを理論的に再現することに成功しました。さらに、これら2つのピーク強度の温度依存性、同位体依存性(※7)を再現することに初めて成功しました(図1)。
図1:(左) 理論計算によるいくつかの温度に対する水の軟X線発光スペクトル。2つの1b1状態はそれぞれ1b1’、1b1”と記しており、温度が上昇するにつれて1b1”の方が相対的に高くなっていることがわかる。(右)理論計算による300 Kにおける水(H2O)と、重水(D2O)の軟X線発光スペクトル。D2Oの方が1b1”の強度が高い。
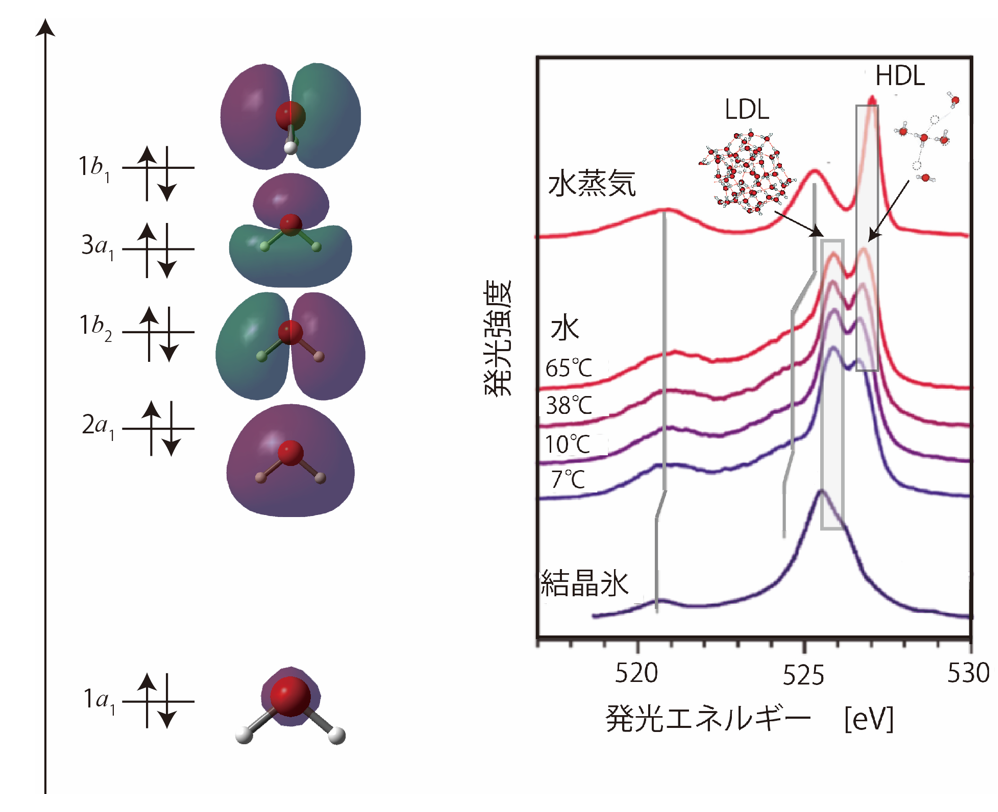
図2:(左)水の電子状態。(右)水の軟X線発光スペクトル。図1で示した1b1’、1b1”はそれぞれLDL、HDLとして帰属されている。(T. Tokushima et al., Chem. Phys. Lett., 460, 387(2008)を一部改変)
この2つのピークは、液体の構造を議論するカギとなる1b1状態と呼ばれる水分子の結合性分子軌道(※8)に由来するものです。実は分子軌道の電子を直接取り出して分析する光電子分光法では、液体の水の1b1状態は1つのピークとしてしか観測されないため、軟X線発光分光法で2つのピークが観測される理由をめぐって複数の解釈があり、混乱がありました。今回の研究によって、光電子分光法ではいくつかある水素結合様式における水のエネルギー準位が接近しているため区別が難しいのに対し、軟X線発光分光法では、軟X線照射後に発光が生じるまでに数フェムト秒(数10-15秒)の時間がかかり、その間に水素結合様式によって異なるスピードで水素原子が動くことから、2つの水素結合状態が明確に区別されることがわかりました。この原理に基づけば、水の温度を高くしたときに2つのピークのうち高エネルギー側のピークの割合が高くなり、かつ2つのピークの幅が広くなること、また水の水素を重水素に置換したときに高エネルギー側のピークが際立つことも説明することができます。
今回の研究によって得られたモデルは、軟X線発光スペクトルの解釈をめぐる15年来の論争を収束させるものです。つまり本研究は、軟X線発光スペクトルの2つのピークが本質的に異なる水素結合様式から出てくるものであり、2状態モデルによる解釈が妥当であることを示しています。
今後の展開
今回用いた手法は普遍的であり、様々な環境における水の構造論に応用できます。水の中に2つの水素結合様式があるということは、そのサイズや生成消滅の時間スケールに応じて異なる物性を持つ水の状態が共存することを意味しますので、純水だけでなく、界面、水溶液、高分子電解質中の水の構造とその機能に関する新たな議論も進むことが期待されます。例えば、界面の水の構造から人工血管などのバイオマテリアルや水処理膜の開発、電池の中の電解液の構造や新規電極材料の開発などに有用です。
本研究成果は、文部科学省科学研究費補助金 新学術領域(研究領域提案型)「水圏機能材料」 (No. JP19H05717) の助成のもとに行われました。
用語解説:
- ※1 水素結合
- 電気陰性度の大きな原子(O、Nなど)に共有結合で結びついた水素原子が、窒素、酸素、π電子系などの孤立電子対とつくる非共有結合性の引力的相互作用です。一般式ではX-H…Yと表すことができます。水素結合は配向性を有し、分子間力の基準となるファン・デル・ワールス半径より短い結合距離を示します。OH…Oのような静電力が支配的な比較的の強いものから、最近ではCH…O、CH…πのような分散力が支配的な弱いものまで広く水素結合として認められています。水の同族水素化物より高い沸点を示すなどいくつかの異常な性質は分子間の強い水素結合によって理解することができます。
- ※2 水の2状態モデル
- 上でも述べたように水の構造論は100年以上の歴史があります。大きく分けてレンドゲンによる2状態モデル、バーナル・ファウラーによる連続体モデルがあります。連続体モデルがずっと大勢を得ていましたが、21世紀に入り、X線分光によって液体においても分子を直接観測することが可能になり、2状態モデルが再び脚光を浴びるようになりました。低温における低密度アモルファス固体(LDA)、高密度アモルファス固体(HDA)を拡張する形で常温の水においても低密度液体(LDL)、高密度液体(HDL)の2状態間のゆらぎで理解できるという学説が活発になってきています。
- ※3 X線発光分光法
- 軟X線は波長が数十eVから2000eVの範囲の比較的波長の長いX線で、第2周期の元素であれば、内殻の1s軌道の電子を直接励起することができます。生成した内殻の空軌道は非常に不安定で、きわめて短時間の間(数fs、1 fs=10-15 秒)に価電子軌道から電子が埋められます。このときに余剰エネルギーとして放出される光を測定する分光法がX線発光分光法です。
- ※4 分子動力学法
- 計算機シミュレーションの一種で、ニュートンの運動方程式を数値的に解くことによって、相互作用する分子を記述する手法のことです。分子原子間のポテンシャルをあらかじめ求めておくことにより数千から数万分子(もしくはそれ以上)のシミュレーションが可能となり、マクロな物性の予測に有用です。
- ※5 密度汎関数法
- 量子力学の基本方程式であるシュレディンガー方程式を原子、分子、凝縮系などの多体電子系に対して系の電子状態を解くための手法の1つで、系のあらゆる物理量は電子密度の関数として一義的に決まる汎関数によって表現できる、という原理に基づいて定式化されています。化学で広く使われている分子軌道法に比べ計算のコストが比較的小さく、広く応用されていくことが期待されています。
- ※6 第一原理
- 原子分子を取り扱う場合、第一原理に基づき問題を解くとは原子分子の相互作用(電子、原子核間のクーロン相互作用)を出発点とし方程式を解くことです。原子分子のようなミクロの世界は量子力学に基づいており、基礎方程式はシュレディンガー方程式です。量子力学の黎明期には原子分子の相互作用を全て取り込んで方程式を解くことは難しく、ディラックは「物理の大部分と化学の全体を数学的に取り扱うために必要な基本的法則は完全にわかっている。これらの法則を適用すると複雑すぎて解くことのできない方程式に行き着いてしまうことだけが困難なのである。」という有名な言葉を残しています。現代ではコンピュータを駆使し、第一原理に基づきシュレディンガー方程式を解くことが可能になっています。
- ※7 温度依存性、同位体依存性
- 温度が高くなると、分子の動きが速くなります。また、同じ原子番号をもつ原子でも質量の異なる原子がいくつかあります。水素の場合は自然界に質量数1の水素と質量数2の重水素があります。ここでは水素の質量が2倍になることから原子の動きが遅くなります。測定されるスペクトルは分子の動き、質量の変化を直接反映しています。
- ※8 水の結合性軌道
- 水は5つの占有軌道を有し、エネルギーの低い順に1a1(酸素の1s軌道)、2a1(酸素の2s軌道)、1b2(OH結合軌道)、3a1(HOH面内の非結合性軌道)、1b1(HOH面外の非結合性軌道)と名前がつけられています(図2)。軟X線発光分光法では価電子軌道である1b1、3a1、1b1軌道から1a1軌道への遷移が観測できます。