2023-05-17 農研機構,千葉大学,東京工業大学
ポイント
農研機構は、千葉大学および東京工業大学と共同で、大気圧プラズマ1,2)の短時間照射により、ゲノム編集3)に必要な酵素を植物細胞に導入する新しい技術を開発しました。これまでの一般的なゲノム編集技術では外来DNAの導入が必要でしたが、本技術では外来DNAの除去が不要となるため、より簡便でかつさまざまな植物に活用できると考えられ、品種改良の新しいツールとなることが期待されます。
概要
農研機構の光原一朗グループ長、千葉大学の柳川由紀特任研究員および東京工業大学の沖野晃俊准教授らの研究グループは、約25°Cに低温制御した大気圧プラズマを照射することで、植物細胞にゲノム編集酵素(Cas9タンパク質とsgRNAの複合体)を導入し、植物をゲノム編集する技術を開発しました。
従来、植物のゲノム編集では、一時的に遺伝子組換え技術を用いて、酵素の遺伝子をDNAの形で導入していました。この技術ではゲノム編集を行った後、導入したゲノム編集酵素遺伝子は不要となるため、自家受粉や交配などにより次世代の植物を取得するなどの方法で、外来DNAを取り除く必要がありました。
今回開発した技術は、2017年に農研機構と東京工業大学で開発した、大気圧プラズマの照射により植物体に生体高分子を導入する技術を応用し、植物細胞にゲノム編集酵素(タンパク質-RNA複合体型)を導入したものです。この技術では、ゲノム編集酵素は遺伝子(DNA)の形で導入されず、タンパク質やRNAの形で植物細胞に直接導入されるため、これまでの一般的なゲノム編集技術で必要だった外来遺伝子の除去が不要となります。また、パーティクルガン法4)やエレクトロポレーション法5)といった技術に比べ、植物体の形を保ったままプラズマ照射した植物組織の細胞集団に広く酵素を導入できる利点があり、植物のゲノムをより効率的に改変することが可能となります。
本技術は、ライフサイクルの長い樹木や栄養繁殖性6)の作物など、これまでゲノム編集が困難だった植物における品種開発の新しいツールとして活用されることが期待されます。
関連情報
予算 : イノベーション創出強化研究推進事業「作物ゲノム編集におけるプラズマ革命への挑戦的研究」およびSIP「精密ゲノム編集技術による品種改良の効率化」、JSPS科研費19K22319、20K21296、22H00323、生体医歯工学共同研究拠点「一般共同研究B」
特許 : プラズマを用いてゲノム編集酵素を植物細胞内に導入する方法 (特開2021-078362)
問い合わせ先など
研究推進責任者 :
農研機構 生物機能利用研究部門 所長中島 信彦
研究担当者 :
同 作物ゲノム編集研究領域 グループ長光原 一朗
国立大学法人千葉大学 大学院園芸学研究院 特任研究員柳川 由紀
国立大学法人東京工業大学 科学技術創成研究院 准教授沖野 晃俊
広報担当者 :
農研機構 生物機能利用研究部門 研究推進部研究推進室笠嶋 めぐみ
国立大学法人千葉大学 企画部渉外企画課広報室
国立大学法人東京工業大学 総務部 広報課
詳細情報
開発の社会的背景と研究の経緯
ゲノム編集技術は、タンパク質やRNAから成るゲノム編集酵素を細胞内で働かせて、特定部位のゲノムDNAを改変する技術です。植物のゲノム編集では、細胞に外からタンパク質を導入することが難しく、多くの場合は遺伝子組換え技術を用いていったんゲノム編集酵素遺伝子をDNAの形で導入し、細胞内でゲノム編集酵素を合成させることでゲノム編集を行っています。ただし、目的の形質の植物が得られれば、導入したゲノム編集酵素遺伝子は不要となり、除去する必要があります。通常、自家受粉や交配などにより次世代の植物を取得しこれを選抜することで導入した遺伝子の除去が可能ですが、ライフサイクルの長い樹木や栄養繁殖性の作物では困難です。そのため、ゲノム編集酵素をタンパク質やRNAの形で直接導入してゲノム編集を行う技術の開発が求められています。
農研機構と東京工業大学はプラズマの生命工学分野への応用を目指し、2017年に「温度制御大気圧プラズマを用いて無傷の植物の細胞に外から生体高分子を導入する技術」(Yanagawa et al., 2017. https://doi.org/10.1371/journal.pone.0171942)を開発しました。この方法では、植物を低温(約25°C)に制御した大気圧プラズマで処理することで、少なくとも分子量400万Daまでの生体高分子であればタンパク質、RNA、DNAを問わず取り込ませることができます。これはプラズマ処理によって、一時的に細胞膜上の膜輸送システム(エンドサイトーシス)が亢進し、細胞外に存在する高分子が積極的に細胞内に取り込まれるためと考えられており、この取り込みは数時間継続することが確認されています。
本研究では、この技術を用いてタンパク質-RNA複合体型のゲノム編集酵素を植物細胞に導入し、ゲノム編集を行うことができることを示しました。
研究の内容・意義
1.モデル植物の作出
期待通りにゲノム編集酵素が植物細胞内に導入され、ゲノム編集が成功したかどうかを簡便に評価できるモデル植物を作出しました。はじめに、化学発光を触媒する酵素遺伝子に挿入変異を持つ遺伝子カセットを作成し、イネのカルス7)に導入しました。カセット内の遺伝子の挿入変異がゲノム編集によって改変されると、遺伝子が正常に機能し、当該植物による化学発光が検出できる仕組みとなっています。同様に、変異を持つ薬剤耐性遺伝子を利用したカセットを作成し、タバコ葉に導入し、薬剤耐性を指標にゲノム編集の成否を評価しました。
2.イネを用いたゲノム編集モデル実験
変異酵素遺伝子を持つイネのカルスにプラズマを照射した後、ゲノム編集酵素を含む溶液にイネカルスを浸すことで、ゲノム編集酵素を取り込ませました(図1)。処理したカルスを検出装置で撮影したところ、発光が検出された(黒色部分, 図2)ことから、変異酵素遺伝子がゲノム編集によって修復されたと考えられます。これらのカルスに含まれる遺伝子配列を解析し、ゲノム編集が成功したことを確認しました。
3.タバコを用いたゲノム編集モデル実験
変異薬剤耐性遺伝子を導入したタバコの葉片に、同様にプラズマを用いたゲノム編集酵素の導入を行ったところ、薬剤耐性カルスが出現すること、期待通りの塩基配列の編集を確認しました(図3)。 以上のことから、イネカルスあるいはタバコ葉をプラズマ処理することで細胞にゲノム編集酵素を導入でき、植物のゲノムを編集できることを上記のモデル植物を用いて確認しました。これらの結果から、大気圧プラズマ法は様々な植物種のゲノム編集に利用できることが期待されます。
4.大気圧プラズマ法のメリット
これまでに開発された生体高分子導入法は、植物組織や導入タンパク質に前処理を行う必要がある、RNAは導入できない、適用可能な植物種や組織に制約があるなどの点から、ゲノム編集酵素の導入法として制限がありました。比較的類似の技術として、パーティクルガンを用いて、ゲノム編集酵素を導入してゲノム編集を行う技術が開発されていますが、この方法ではゲノム編集酵素を吸着させた微粒子が撃ち込まれた一部の細胞にしかゲノム編集酵素が導入されません。一方で本研究の大気圧プラズマを利用した技術では、プラズマ照射したのちにゲノム編集酵素溶液に浸漬するという比較的単純な操作で、植物体に障害を与えることなく、植物体の形を保ったまま一定の範囲の細胞の集団にゲノム編集酵素を導入することができるため、これまでより効率的にゲノム編集を行うことが期待できます。
今後の予定・期待
この技術は、外来DNAの除去を必要としないゲノム編集技術として、様々な植物種、特に栄養繁殖性の作物の品種改良への利用が期待されます。今後は、この技術におけるゲノム編集効率を向上させ、実用作物の品種改良に応用できる技術をめざし、さらに開発を進めていきます。
用語の解説
- 1)プラズマ
- プラズマとは、気体を構成する分子が電離して、陽イオンと電子等に分かれて活性化している状態を指す。一般的には気体に高電圧を印加することで生成する。プラズマ中には、陽イオンと電子のほか、ラジカルなどの活性種が存在する。プラズマの例としては、自然界に見られるオーロラや稲妻があり、身近なものでは蛍光灯にも利用されている。最近では、半導体づくりのための微細加工や薄膜の合成、殺菌などにプラズマが用いられ、産業応用が進められている。
- 2)大気圧プラズマ
- 一般的には、プラズマは低気圧下で生成されるが、1気圧前後の大気圧下で発生させるプラズマのことを大気圧プラズマとよぶ。本研究では、東京工業大学で開発した温度制御プラズマ装置を用いて低温制御した約25°Cの大気圧プラズマを用いた。
- 3)ゲノム編集
- ゲノム編集酵素により生物が持つゲノムDNA上の特定の塩基配列を狙って改変する技術。ゲノム編集酵素はゲノムDNAの任意のターゲット塩基配列を認識して特異的に切断する。代表的なゲノム編集として、Cas9ヌクレアーゼとsgRNA (single-guide RNA; 一本鎖RNA)の融合物であるCRISPR-Cas9 (clustered regularly interspaced short palindromic repeats – CRISPR associated proteins)が知られている。
- 4)パーティクルガン(粒子銃)法
- 直径1ミクロン内外の微細な金属粒子にDNAやタンパク質などの生体高分子を吸着させたものを高速で打ち込むことで細胞内に導入する方法
- 5)エレクトロポレーション(電気穿孔)法
- 細胞に高電圧パルスを加えて細胞膜に一過的に小孔を生じさせることで、DNAやタンパク質などの生体高分子を細胞内に取り込ませる方法。植物では多くの場合、事前に細胞壁を除去して細胞膜が露出した単細胞であるプロトプラストを作成する必要がある。
- 6)栄養繁殖
- 種子からの繁殖に対して、挿し木、接ぎ木、株分け、塊茎などで繁殖させる方法。栄養繁殖で増殖させた植物は遺伝的に同一のクローンである。
- 7)カルス
- 各組織に分化していない細胞の塊。植物は、葉や根などの組織から未分化なカルスに変化し、逆にカルスから再び器官を形成させることができる。組織からカルスへの変化を脱分化、カルスから器官への再生を再分化と呼ぶ。
発表論文
Yuki Yanagawa, Yuma Suenaga, Yusuke Iijima, Masaki Endo, Naoko Sanada, Etsuko Katoh, Seiichi Toki, Akitoshi Okino, Ichiro Mitsuhara.(2023) Genome editing by introduction of Cas9/sgRNA into plant cells using temperature-controlled atmospheric pressure plasma. PLoS ONE 18: e0281767.
https://doi.org/10.1371/journal.pone.0281767
参考図
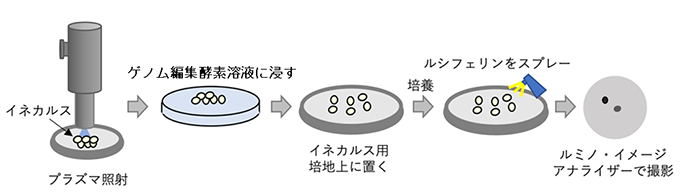
図1 イネカルスへのプラズマ照射によるゲノム編集酵素導入及びゲノム編集検出法
ゲノム編集が起こると化学発光を触媒する酵素遺伝子を導入したイネを作成し、このイネからカルスを誘導する。このイネから誘導したカルスを大気圧プラズマで処理したのち、ゲノム編集酵素を含む溶液に浸漬することで細胞内に入れて作用させる。イネカルスを一定期間培養したのち、酵素の基質を加え、化学発光の検出によってゲノム編集の成否を判定した。
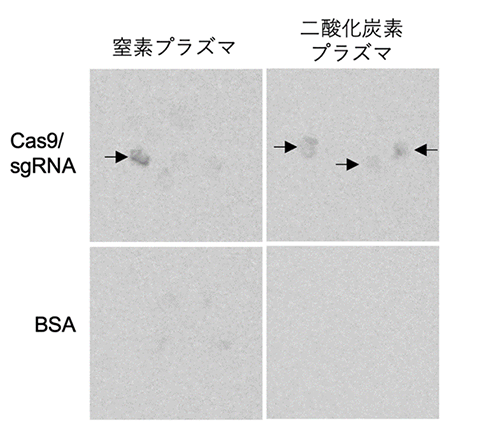
図2 ルミノ・イメージアナライザーで発光を検出
窒素ガス及び二酸化炭素ガスから生成させたプラズマ処理後、ゲノム編集酵素を含む溶液に浸漬したカルスで、ルシフェラーゼ活性が検出されたことから、ゲノム編集が起きたことがわかる。一方、プラズマ処理後ネガティブコントロールとしてBSA(牛血清アルブミン)溶液に浸漬した場合はこのような活性は認められない。
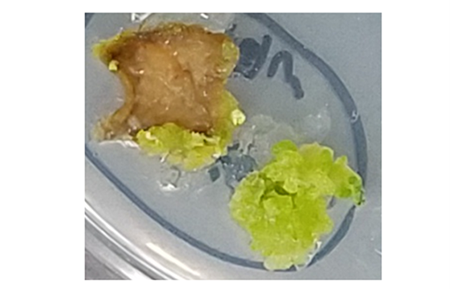
図3 薬剤耐性を獲得したタバコカルス
プラズマ処理を行ったタバコ葉片から培養したカルスは、ハイグロマイシンと呼ばれる抗生剤物質(薬剤)存在下でも旺盛に増殖でき、ゲノム編集の成功が確認できた。