巨大生体分子複合体の構造解析を加速
2018/10/19 理化学研究所
要旨
理化学研究所(理研)開拓研究本部杉田理論分子科学研究室の杉田有治主任研究員、森貴治研究員らの研究チーム※は、タンパク質の立体構造をクライオ電子顕微鏡[1]像から計算機シミュレーションを用いて精密化するための「高速並列計算アルゴリズム」を開発しました。
本研究成果は、従来難しかった巨大生体分子の立体構造解析の短時間化を可能にし、今後、リボソームやRNAポリメラーゼなどのさまざまなタンパク質・核酸複合体の精密な構造決定に貢献すると期待できます。
今回、研究チームは、クライオ電子顕微鏡を用いて得られるタンパク質の近原子分解能の立体像から、原子解像度の分子構造を分子動力学シミュレーション[2]に基づいて精密化する「フレキシブル・フィッティング法[3]」に対して、効率の良い並列計算アルゴリズムを考案しました。本手法の適用範囲は広く、ヘモグロビンのような小さなタンパク質から、リボソームのような巨大生体分子複合体に対しても高速計算が可能です。開発したソフトウェアは無償にて公開され、今後、クライオ電子顕微鏡と他の実験手法を組み合わせる統合的なタンパク質立体構造モデリングへ展開されると考えられます。
本研究は、米科学雑誌『Structure』(2019年1月2日号)の掲載に先立ち、オンライン版(10月18日付け:日本時間10月19日)に掲載されます。
※研究チーム
理化学研究所
開拓研究本部
杉田理論分子科学研究室
主任研究員 杉田 有治(すぎた ゆうじ)
研究員 森 貴治(もり たかはる)
特別研究員 クリク・マルタ(Marta Kulik)
専任技師 ジョン・ジェウン(Jaewoon Jung)
計算科学研究センター
粒子系生物物理研究チーム
上級研究員 宮下 治(みやした おさむ)
計算構造生物学研究チーム
チームリーダー タマ・フロハンス(Florence Tama)
背景
近年、クライオ電子顕微鏡を用いた単粒子解析法[4]によるタンパク質の立体構造解析が盛んに行われています。これは、対象とするタンパク質を含む溶液を極低温(-180℃以下)にまで冷却し、透過型電子顕微鏡を用いて撮影されたタンパク質の投影像から立体像を再構築する方法です。タンパク質の結晶化を必要としないため、これまでX線結晶構造解析[5]で解くことが難しかったリボソームなどの巨大生体分子やタンパク質複合体の立体像を、原子分解能に近い分解能で決定できます。
単粒子解析法により得られたタンパク質複合体の立体像から、分子構造をモデリングするためには、X線結晶構造解析や核磁気共鳴分光法(NMR法)[6]などで決定されたタンパク質の分子構造を、電子顕微鏡像にドッキングまたはフィッティングする方法が有効です。このとき、分子動力学シミュレーションによる方法がよく用いられます。これは、分子内の原子間相互作用を理論計算し、電子顕微鏡像に一致するようにバイアスをかけながら分子構造を変形させ、最適な構造を探索する方法です(フレキシブル・フィッティング法)(図1)。タンパク質の構造変化を考慮するため、タンパク質を剛体として扱うドッキング法に比べて、より自然な分子構造が得られます。
しかし、フレキシブル・フィッティング法を巨大生体分子複合体へ適用しようとすると、原子間相互作用の計算や電子顕微鏡像との一致度の見積もりに膨大な時間がかかることが問題となるため、高速な計算アルゴリズムの開発が求められていました。
研究手法と成果
コンピュータを用いて高速に計算するためには、複数の中央演算処理装置(CPU)と加速器(GPU[7])を利用した並列計算が有効です。これらのハードウェアに対して適切に演算を割り当て、バランス良く動作させることにより、コンピュータの性能を最大限に引き出した計算が可能になります。今回、研究チームは、フレキシブル・フィッティング法に対する効率の良い並列計算アルゴリズムとして、2種類の手法、「kd-tree型空間分割法」と「局所空間共有分割法」を考案しました。
kd-tree型空間分割法では、電子顕微鏡像と分子構造の一致度を計算する際、kd-tree法[8]に基づいてタンパク質分子を均等に分割し、各CPUが局所的な一致度を計算することで、CPU間での均等な負荷分散を実現します(図2(a))。
局所空間共有分割法は、空間を均等に分割した後、負荷率の高いCPUと低いCPUがペアを組み、共同して局所一致度を計算することで、均等な負荷分散を実現します(図2(b))。一致度の計算は、分散メモリ型と共有メモリ型を組み合わせたハイブリッド並列計算法[9]を用いてCPU上で行い、原子間相互作用の計算はGPUを用いて加速させます。
考案した並列計算アルゴリズムを、理研・計算科学研究センター粒子系生物物理研究チームが開発している分子動力学計算プログラム「GENESIS」注1)に組み込み、種々の生体分子系に対する計算速度を測定したところ、kd-tree型空間分割法と局所空間共有分割法はともに、巨大生体分子系に対して効率の良い性能を示しました。また、全原子モデル[10]だけでなく、粗視化モデル[11]などの近似モデルを用いた系や、小さなタンパク質に対しても高速計算を実現しました(図3)。
開発した高速フィッティング法は、GENESISバージョン1.4の新規機能として、ウェブサイト注2)にて公開されます。
注1)2015年5月8日プレスリリース「超並列分子動力学計算ソフトウェア「GENESIS」を開発」
注2)GENESIS公式ホームページ
今後の期待
細胞内に存在するタンパク質の多くは、酵素反応などの機能を発揮するとき、他のタンパク質や核酸、脂質分子などと過渡的複合体を形成します。近年、このようなタンパク質複合体の立体構造を、クライオ電子顕微鏡を用いて決定しようとする機運がますます高まっています。複合体の詳細な立体構造を明らかにするためには、クライオ電子顕微鏡だけでなく、X線結晶構造解析、NMR法などの複数の実験データを組み合わせた「統合的立体構造モデリング」が必要不可欠となります。
今後、ベイス推定[12]のような情報科学で用いられる技法なども駆使し、統合構造モデリングのアルゴリズムをさらに改良することで、構造生物学のさらなる発展が期待できます。
原論文情報
Takaharu Mori, Marta Kulik, Osamu Miyashita, Jaewoon Jung, Florence Tama, and Yuji Sugita, “Acceleration of cryo-EM flexible fitting for large biomolecular systems by efficient space partitioning”, Structure, 10.1016/j.str.2018.09.004
発表者
理化学研究所
主任研究員研究室 杉田理論分子科学研究室
主任研究員 杉田 有治(すぎた ゆうじ)
研究員 森 貴治(もり たかはる)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- クライオ電子顕微鏡
- タンパク質を含む溶液を極低温(液体窒素温度)にまで急速に冷却し、試料を観察する透過型電子顕微鏡。近年、試料調製法の改良や、電子直接検出器の開発、解析ソフトの進歩により、近原子分解能の性能が得られるようになった。2017年、タンパク質立体構造解析への応用に貢献したジャック・デュボシェ、ヨアヒム・フランク、リチャード・ヘンダーソンの3氏にノーベル化学賞が授与されている。
-
- 分子動力学シミュレーション
- コンピュータを用いた分子シミュレーション法の一つ。原子間相互作用をフックの法則やクーロンの法則などから計算し、分子系の運動をニュートン方程式F=maに基づいて数値的に解くことで、分子の動きを理論予測し解析する方法。
-
- フレキシブル・フィッティング法
- 単粒子解析法によって得られたタンパク質の電顕密度マップに対して、分子構造を当てはめる際、マップと一致するようにバイアスをかけながら分子シミュレーションを行い、一致する構造を探索する方法。このとき、分子動力学シミュレーションが広く用いられる。
-
- 単粒子解析法
- クライオ電子顕微鏡によって観察される、溶液中にランダムに配向したタンパク質の多数の投影像から立体像を再構築する手法。
-
- X線結晶構造解析
- タンパク質の結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、タンパク質の内部の原子の立体的な配置を調べる方法。この方法によって、タンパク質の立体構造や内部構造を知ることができる。
-
- 核磁気共鳴分光法(NMR法)
- 静磁場におかれた原子核の共鳴を観測し、分子の構造や運動状態などの性質を調べる分光法。NMRはNuclear Magnetic Resonanceの略。
-
- GPU
- 画像処理を高速に行うためにコンピュータに装着される補助的な演算装置。近年、科学技術計算における一般的な演算を加速させることを目的としても広く用いられるまた、GPUによる汎用演算をGPGPUという。GPUはGraphics Processing Unitの略。
-
- kd-tree法
- k次元空間に存在する点を分類するための空間分割アルゴリズム。例えば、3次元空間の場合、一般的には中間点をまず選び、X軸に対して垂直に分割平面を置く。2分割された空間をさらに分割するには、それぞれの空間の中間点を選び、Y軸に対して分割平面を置く。範囲探索や最近傍探索などに用いられる。
-
- ハイブリッド並列計算法
- 分散メモリ型並列と共有メモリ型並列を組み合わせた並列コンピューティング技法。前者は主にノード間、後者はノード内並列計算に用いられ、それぞれ、MPI(Message Passing Interface)、OpenMPプロトコルが広く用いられる。
-
- 全原子モデル
- 分子構造を表現するとき、原子1個を一つの粒子として扱うモデル。原子一つ一つが固有の半径と部分電荷を持ち、それぞれがバネでつながっていると考える。通常、溶液環境を考慮して(水分子やイオンを系に含めて)計算するため、粒子数が多くなり、必要な計算量が膨大になる。
-
- 粗視化モデル
- 分子構造を表現するとき、複数の原子を一つの粒子として近似するモデル。一般的に溶媒分子は系に含めず、溶液環境は近似的に扱う。全原子モデルと比べて粒子数を少なくできるため、計算量の削減によく用いられる。
-
- ベイス推定
- 観測された事象からその原因となる事象を確率的に推定するための方法。特にタンパク質の構造決定においては、「実験データDが観測されたときに、分子構造がXである確率 P(X |D)」を推定する際に適用できる。
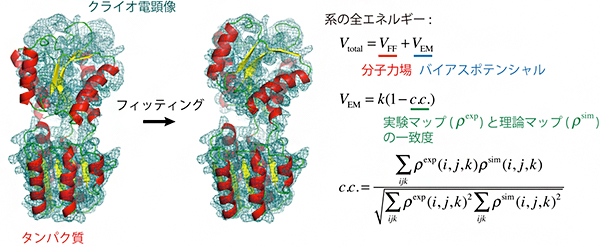
図1 フレキシブル・フィッティング法の概略
クライオ電子顕微鏡像に、X線結晶構造解析や核磁気共鳴分光法(NMR法)などで決定されたタンパク質の分子構造をフィッティングする。このとき、分子動力学計算に用いるエネルギー関数(分子力場)に、タンパク質構造が電子顕微鏡像に向かうようなバイアスポテンシャルを加え、ニュートンの運動方程式F=maに従って原子を動かす。
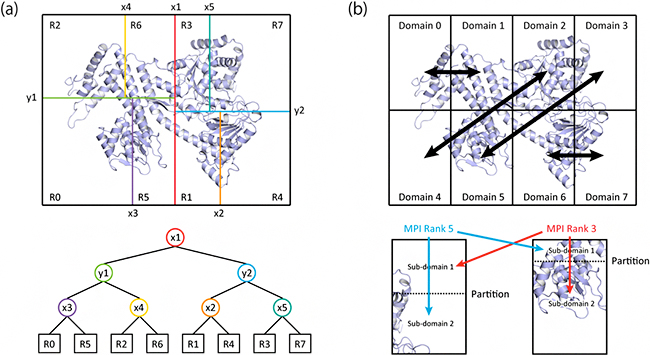
図2 開発した並列計算アルゴリズムの模式図
(a)はkd-tree型空間分割法、(b)は局所空間共有分割法。両手法とも、分子構造とクライオ電顕像との一致度を並列計算する際、系をなるべく均等に分割し、各CPUが局所空間における一致度を計算することで負荷分散を行う。図は、8個のCPUを用いて並列計算する場合の例を示している。(a)では、分子の中点において系を分割し(x1線)、さらに分割した後の空間に含まれる分子の中点(y1、y2線)で分割、これを繰り返すことで分子構造を均等に分割する。下図は、系を分割する順番と、分割後に各領域に割り当てられた番号(R0~R7:各CPUの番号に相当)を示す。(b)では、空間を均等に分割した後、原子を多く含む空間を担当するCPUと、少ない原子を含む空間を担当するCPUとでペアを組み(黒の両矢印)、それぞれの担当空間を協力しあって電顕像一致度を計算する。下図は、3番目と5番目のCPUがどの領域を分担して計算するかを表している。均等な負荷分散は、敷居の位置(点線)を自動調整することで実現する。(a)は原子分割分子動力学法、(b)は空間分割分子動力学法での利用に適している。
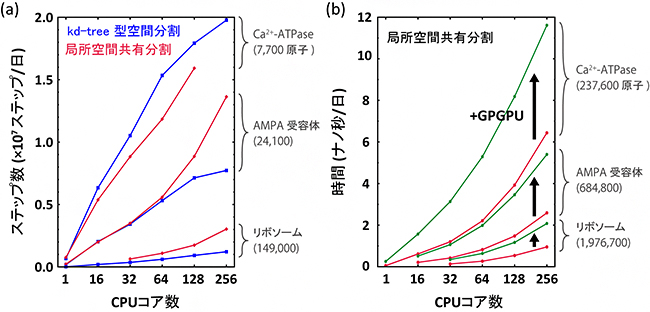
図3 開発した並列計算法のクラスター計算機における計算速度測定結果
(a)粗視化モデル、(b)全原子モデルを用い、小規模(Ca2+-ATPase)、中規模(AMPA受容体)、大規模(リボソーム)な生体分子系に対して測定を行った。図中の括弧内の数値は系の全粒子(原子)数を示す。(a)は、CPUの数が増えるに伴いkd-tree型空間分割法と局所空間共有分割法による1日に到達できる計算ステップ数が大きく増加したことを示す。(b)は、局所空間共有分割法によるシミュレーション時間がCPU計算だけの場合(赤線)に比べてGPU計算(GPGPU、緑線)により加速したことを示す(黒の矢印)。