2025-02-13 国際農研
ポイント
- 「インフィルトレーション法」により、圃場の植物サンプルを安定的に保存・輸送する遺伝子解析手法を開発
- アフリカのマダガスカル水田圃場の植物体の遺伝子発現解析に応用し、植物の生育不良の原因特定に成功
- 開発途上地域の圃場における遺伝子研究が飛躍的に進むことが期待
概要
国際農研は、開発途上地域で入手困難な液体窒素などの凍結剤を使用せずに植物の遺伝子の発現量を解析するための新たな手法を開発しました。
生物はゲノム1) 情報に基づいてDNAからRNAを転写し、主にタンパク質の合成を通して、ストレス耐性や植物の形態などの形質を表現します。RNAの解析は、高いストレス耐性と関わるメカニズムの解明や、優れた収量を持つ作物の開発の加速化に不可欠です。しかし、RNAは不安定であり、液体窒素やドライアイスなどの凍結剤の入手が困難な開発途上地域においては、圃場での植物遺伝子解析は難しく、作物開発のボトルネックとなっていました。
新たに開発したインフィルトレーション法は、植物の葉を構成する細胞の隙間に核酸安定化溶液を浸透させることで、凍結剤を使用せずに植物の葉組織中のRNAを安定的に保存できる手法です。この手法を用いて、アフリカのマダガスカルの水田において、イネの葉の遺伝子の発現量を解析し、植物の生育不良の原因の特定に成功しました。また、植物組織から抽出後のRNAを二酸化ケイ素膜に結合させることにより、凍結剤を使用しない状態で安定に運搬する技術も開発し、今後開発途上地域のサンプルを用いたRNAシーケンス2) などのゲノミクス解析が実施可能であることが示唆されました。
本研究の成果により、開発途上地域における植物の遺伝子研究が飛躍的に進むことが期待されます。具体的には、圃場における植物の分子生理的な応答の理解や、栄養欠乏や病害といったストレスに応答するメカニズムの解析などによる作物の開発が大幅に加速化されることが期待されます。
本研究成果は、国際科学専門誌「Plant Methods」電子版 (日本時間2024年12月19日) に掲載されました。
関連情報
- 予算
- 運営費交付金プロジェクト「レジリエンス強化作物とその生産技術の開発」
発表論文
- 論文著者 Y Ueda
- 論文タイトル Development of an infiltration-based RNA preservation method for cryogen-free storage of leaves for gene expression analyses in field-grown plants
- 雑誌 Plant Methods
DOI: https://plantmethods.biomedcentral.com/articles/10.1186/s13007-024-01311-2
問い合わせ先など
国際農研 (茨城県つくば市) 理事長 小山 修
- 研究推進責任者:
- 国際農研 プログラムディレクター 藤田 泰成
- 研究担当者:
- 国際農研 生産環境・畜産領域 植田 佳明
- 広報担当者:
- 国際農研 情報広報室長 大森 圭祐
研究の背景
生物はゲノム上の遺伝子からRNAを転写することで形質を発現します。細胞内のRNAの量や種類は、生育段階や生育環境によって大きく変化し、最適な応答を引き起こします。特に、栄養欠乏などのストレスへの耐性と深く関わるため、細胞内のRNAの種類や量の解析は、生物の状態把握とストレス耐性メカニズムの理解に不可欠です。
RNAは安定性が低く分解しやすいため、一般的には液体窒素やドライアイスで凍結させたサンプル、または採取直後のサンプルを解析に使用します。しかし、開発途上地域では、これらの凍結剤の入手が困難であり、実験圃場の近くに冷凍庫や実験施設がないことが多く、圃場のサンプルを用いた遺伝子発現解析はほとんど進められてきませんでした。
研究の経緯
これまで、生物組織中に存在するRNAを安定に保つ核酸安定化試薬3) が使用されていました。この試薬は、生物組織中に存在するRNAを分解する酵素の活性を抑制するもので、植物を含むいくつかの生物種で広く応用されてきました。特に、屋外における生物の遺伝子発現の解析に役立ってきました。
しかし、植物において、核酸安定化試薬の有効な処理方法や異なるサンプル保存条件が広範な遺伝子の発現に与える影響については、体系的な研究が行われていませんでした。これまで温室や人工気象器で育てた植物の解析が頻繁に行われてきましたが、近年、圃場と人工気象器で植物の環境応答の傾向が異なることが明らかになり、より圃場に近い条件での遺伝子発現解析および手法の開発が求められていました。
研究の内容・意義
- 新たに開発したインフィルトレーション法は、圃場で栽培された葉を界面活性剤で洗浄し、注射器のシリンジ内で加圧と減圧を繰り返すことで葉の細胞の隙間に核酸安定化溶液を浸透させる手法です (図1)。
- つくば市内の試験圃場で栽培したイネの葉を、①インフィルトレーション法により実験室に持ち帰り冷蔵庫で4℃で5日保存、②従来法 (核酸安定化溶液に浸漬) により4℃で5日保存、③液体窒素を用いた凍結により-80℃ (超低温条件) で保存し、RNAシーケンスにより遺伝子発現を解析しました。
- その結果、インフィルトレーション法を利用して保存したイネの葉は、従来法と比べて、超低温条件で保存した葉と類似した遺伝子発現の傾向が得られ、サンプル保存方法として適していることが明らかとなりました。また、インフィルトレーション後のサンプルの保存は-20℃よりも4℃の方が適していることも明らかとなりました (図2)。
- アフリカのマダガスカルで、生育の異なる圃場から採取したイネの葉をインフィルトレーション法により冷蔵保存し、現地実験室で抽出したRNAから合成したDNAを日本に持ち帰り、土壌栄養の欠乏に応じて発現が変化する遺伝子の解析を行いました。その結果、栄養欠乏により葉の黄化症状や分げつの抑制が見られる水田では、リン欠乏や鉄欠乏に応答する遺伝子の発現変化が観察され、生育不良の原因を特定できました (図3)。
- RNA抽出に広く使用される二酸化ケイ素膜にRNAを結合させた状態で保存することにより、凍結剤を利用しなくても抽出後のRNAを安定的に運搬できることを見出しました (図4)。これにより、これまで困難であった開発途上地域の圃場で取得されたRNAサンプルを長距離輸送し、RNAシーケンス解析やゲノミクス解析を行うことが可能になることが期待されます。
今後の予定・期待
新手法の開発により、開発途上地域で重要なソルガムにおいても、凍結剤を使用しなくても遺伝子発現解析が可能であることが確認されました。これまでほとんど行われてこなかった開発途上地域の圃場における遺伝子発現解析やそれを利用した植物の栄養状態等の簡易的な診断、およびRNAシーケンスなどのゲノミクス解析が飛躍的に進むことが期待されます。
これにより、開発途上地域で特に問題となる土壌栄養ストレスや、現地で優れた生育を示す作物系統の持つ遺伝生理的メカニズムの解明に寄与し、現地に適した作物開発の加速化が期待されます。
用語の解説
- 1) ゲノム
- 生物が持つ遺伝情報であり、DNAとして保存されているもの。RNAを合成する際の鋳型となる。
- 2) RNAシーケンス
- 細胞中のRNAの種類と量を網羅的に調べる実験手法。
- 3) 核酸安定化試薬
- 高濃度の塩により生物の組織中に存在するRNAを分解する酵素の活性を抑制する試薬。
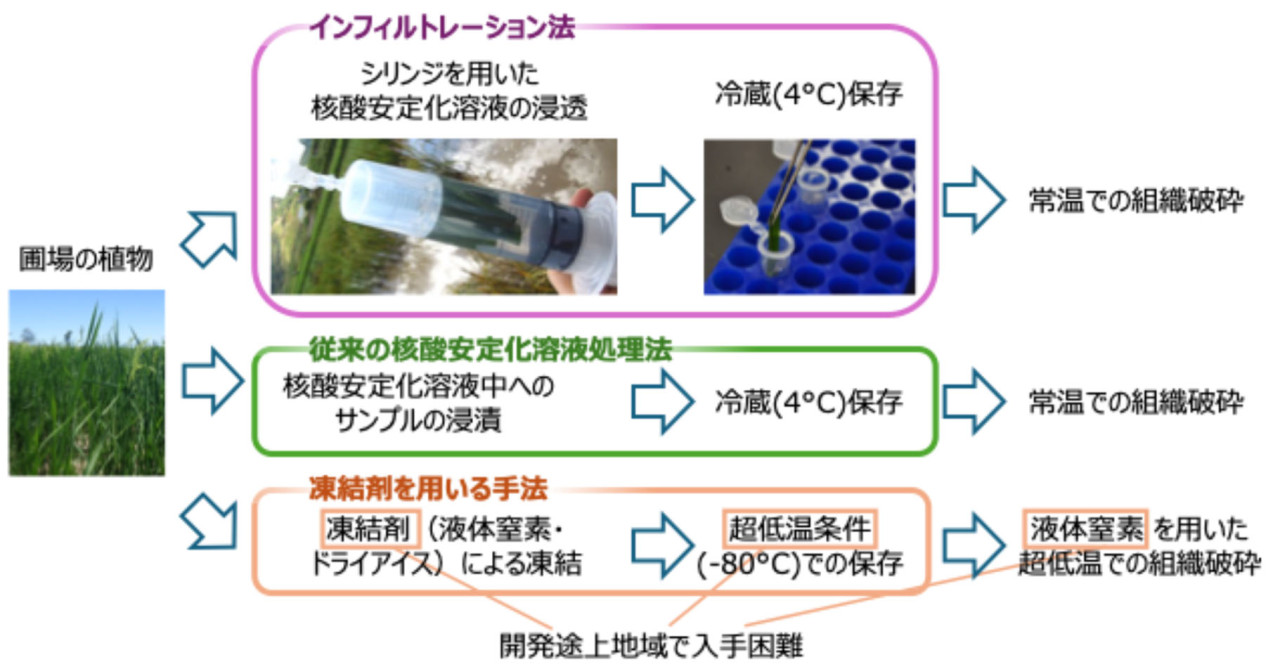 図1 インフィルトレーション法の概要とその利点
図1 インフィルトレーション法の概要とその利点
新開発したインフィルトレーション法では、シリンジを用いた加圧・減圧の反復により核酸安定化溶液を葉の細胞間隙に浸透させ、実験室に持ち帰り冷蔵で保存する。その後、液体窒素を使用せずにサンプルを破砕し、RNA抽出を行う。
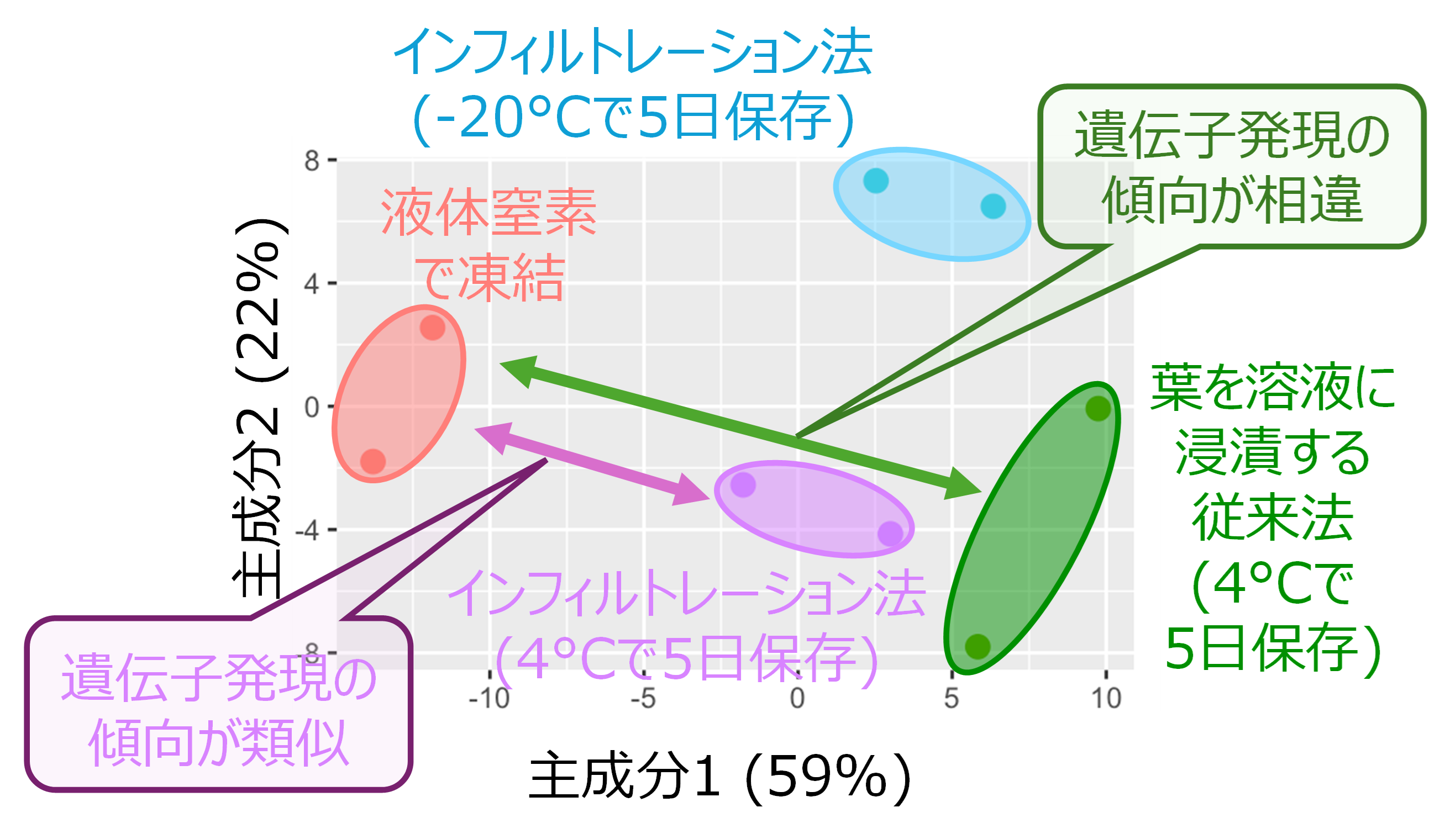
図2 新手法により保存した各サンプル間の遺伝子発現の関連性
各条件で保存したイネの葉サンプルを用いて実施したRNAシーケンスの結果を主成分分析プロットで示す。各ドットが各サンプルに対応する。近い位置にプロットされるサンプルは遺伝子発現の傾向が類似することを示す。インフィルトレーション後に4℃で5日間保存したサンプルは、液体窒素で凍結させたサンプル遺伝子発現パターンの傾向がより類似していることが分かる。
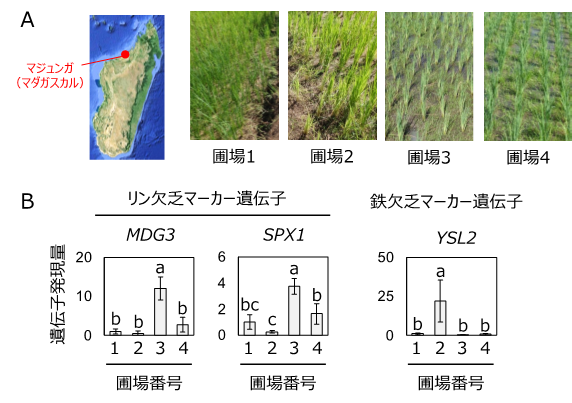
図3 インフィルトレーション法を利用した遺伝子発現解析による圃場での生育不良の原因の特定
マダガスカル農家圃場において、A:サンプルを採取した各水田の様子。圃場2および圃場3では栄養欠乏時に頻繁に見られる葉の黄化症状や分げつの抑制が発生している。
B:リン欠乏および鉄欠乏により誘導される遺伝子の各圃場における発現量。遺伝子の発現が高いほど、各栄養が欠乏していることを表す。エラーバーは標準偏差を示す。異なるアルファベットは、有意な差 (P < 0.05) を示す。
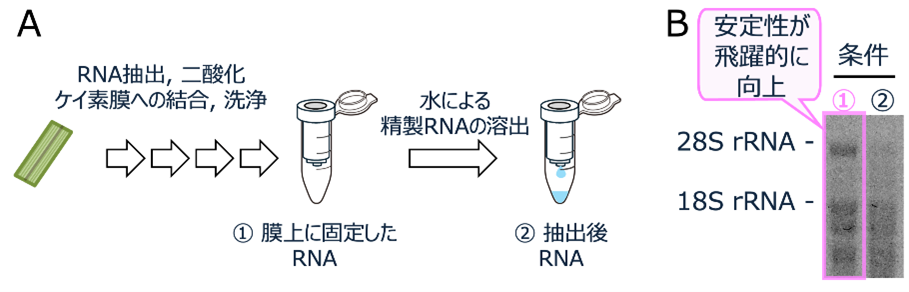 図4 RNAの抽出と精製に関わる作業手順の概要と各条件におけるRNAの安定性
図4 RNAの抽出と精製に関わる作業手順の概要と各条件におけるRNAの安定性
A:RNA抽出のステップ。
B:RNAを二酸化ケイ素膜上に固定した状態、および膜から溶出した状態でマダガスカルから日本に氷上で輸送したRNAサンプルの電気泳動結果。28S rRNA, 18S rRNAは、リボソーム由来のRNAを示すバンドで、これらのバンドが濃いほど、RNAが安定に存在していることを示す。二酸化ケイ素膜にRNAを吸着させた①の条件において、28S rRNA, 18S rRNAのバンドが、抽出後のRNAを氷上で運搬する②の条件のサンプルに比べて強くなっており、RNAが安定に運搬できていることを示す。